ВВЕДЕНИЕ
Пандемия новой коронавирусной инфекции привлекает все больше внимания медицинского сообщества, в том числе и с точки зрения изучения патогенеза, современной диагностики и лечения мультиорганных поражений, вызванных вирусом SARS-CoV-2. Помимо острых респираторных синдромов, у пациентов с COVID-19 встречается широкий спектр внелегочных проявлений, включая повреждение или дисфункцию гепатобилиарной системы [1].
Xu Z. et al. (2020) сообщают, что при аутопсии пациентов с новой коронавирусной инфекцией (COVID-19) наблюдается микро- и макровезикулярный стеатоз печени, при этом инфекция SARS‐CoV‐2 у таких пациентов является единственным фактором риска повреждения печени [2]. Также посмертно документированы пролиферативные изменения стенок желчных протоков, портальные воспалительные инфильтраты, а в некоторых случаях канальцевые/протоковые желчные пробки, ставшие причиной холестаза [4].
В настоящее время исследования в этом направлении продолжаются, но уже определены несколько механизмов повреждения гепатобилиарной системы при новой коронавирусной инфекции:
- прямое (цитопатическое) действие вируса SARS-CoV-2 на холангиоциты и/или гепатоциты. Отмечена высокая экспрессия рецепторов ангиотензинпревращающего фермента (АПФ) в более чем 50% холангиоцитов и 2,6% гепатоцитов [5];
- неконтролируемое иммунное повреждение гепатоцитов и холангиоцитов из-за выраженного воспалительного ответа («цитокиновый шторм») [6];
- гипоксический (ишемический) гепатит, часто встречающийся при тяжелом и крайне тяжелом течении коронавирусной инфекции. Он развивается в результате гипоксии и гиповолемии на фоне дыхательной и сердечно-сосудистой недостаточности и может быть возможной причиной тяжелого повреждения печени у пациентов с COVID-19 [7];
- лекарственные поражения в процессе лечения новой коронавирусной инфекции и ее осложнений [8].
Многие лекарственные средства, применяемые в лечении COVID-19, имеют гепатотоксический потенциал, что отражено в их инструкциях. В частности, это противовирусные препараты (фавипиравир, ремдесивир), антибиотики (макролиды, цефтриаксон, амоксициллин/клавулановая кислота), иммуномодулирующие (кортикостероиды, тоцилизумаб) и жаропонижающие средства (парацетамол). Применение кортикостероидов может стать причиной стеатоза или гликогеноза печени. Одна из нежелательных реакций, указанных в инструкции к цефтриаксону, – образование преципитатов кальциевых солей цефтриаксона в билиарном тракте [9]. Тоцилизумаб, который применяется начиная со средней степени тяжести заболевания, подвергается минимальному метаболизму в печени, и наиболее вероятной причиной его гепатотоксического действия является вмешательство в путь синтеза интерлейкина 6, играющего ключевую роль в регенерации печени.
Использование вышеперечисленных лекарственных средств регламентировано Временными методическими рекомендациями по профилактике, диагностике и лечению новой коронавирусной инфекции (COVID-19), и лечащий врач должен быть максимально осведомлен о механизмах действия и возможных побочных эффектах этих препаратов, должен мониторировать эффективность и безопасность терапии у курируемого пациента, принимать меры по устранению нежелательных явлений.
Анализ историй болезни 292 пациентов (исключая переведенных в отделение интенсивной терапии или умерших в течение первых суток), проведенный на базе больницы Humanitas (Италия), показал, что умеренное повышение печеночных трансаминаз (АЛТ, АСТ) более 50 Ед/л наблюдалось у 18,5 и 26,7% пациентов соответственно. При этом увеличение содержания гамма-глутамилтрансферазы (ГГТП) свыше 55 Ед/л отмечалось у 36,2%, щелочной фосфатазы (ЩФ) выше 150 Ед/л – у 9,6%, а общего билирубина более 1,2 мг/дл – у 10,6% больных. Авторы подчеркивают, что повреждения печени могут выступать потенциальным фактором риска, ухудшающим прогноз у пациентов c COVID-19, и поэтому важно обращать внимание на возникновение повреждений этого органа при коронавирусной инфекции [10].
Установлено, что существует прямая зависимость активности гепатита, возникшего вследствие атаки COVID-19, и летальностью больных новой коронавирусной инфекцией [1, 11].
Корреляция нарушений функции печени, оцениваемая по уровням печеночных трансаминаз, общего билирубина и альбумина, с тяжелым исходом инфекции COVID-19 продемонстрирована в 20 исследованиях китайских ученых [13]. Кроме того, известно, что и гипераммониемия коррелирует со степенью выраженности изменений функции печени [12, 14, 15]. Получены данные о взаимосвязи гипераммониемии с другими маркерами «цитокинового шторма» (ферритином, количеством лейкоцитов) и летальным исходом при COVID-19 [12, 15].
В систематическом обзоре с метаанализом (36 исследований, 20 724 пациента) по распространенности поражения билиарного тракта и его корреляция с клиническими исходами у пациентов с COVID-19 было выявлено снижение экспрессии транспортеров желчных кислот SLC10A2/ASBT и ABCC7/CFTR. Кроме того, описано формирование реактивного воспаления холангиоцитов, выработка ими провоспалительных и профиброгенных веществ и цитокинов, что способствует развитию воспалительного отека и фиброза [16].
Таким образом, вирус SARS-CoV-2 поражает не только дыхательные пути, но и имеет тропизм ко многим органам и тканям, включая печень и желчевыводящие пути. Поэтому новая коронавирусная инфекция может привести к патологии гепатобилиарной системы даже у пациентов без отягощенного преморбидного фона, и ее формирование стоит расценивать как многофакторный процесс.
В качестве иллюстрации приводим собственное клиническое наблюдение.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Обследуемая – пациентка М., 59 лет. По данным медицинской документации и со слов самой пациентки, ранее заболеваниями печени и билиарного тракта она не страдала.
Данные анамнеза: в декабре 2020 г. женщина перенесла новую коронавирусную инфекцию в тяжелой форме, с развитием тяжелой вирусно-бактериальной пневмонии (68%, КТ-3). В соответствии с актуальной на тот период времени версией Временных методических рекомендаций [17] получала лечение препаратами фавипиравир, парацетамол, барицитиниб, метилпреднизолон. В связи с появлением лейкоцитоза со сдвигом влево ей был назначен также цефтриаксон в комбинации с амоксициллином/клавулановой кислотой. После получения двух отрицательных результатов мазков со слизистой носоглотки на РНК COVID-19 пациентка была переведена в реабилитационное отделение, где на второй день лечения у нее появилось пожелтение кожи и склер. Больная отмечала, что периодически ее каловые массы имеют неоднородное окрашивание с обесцвеченными фрагментами.
По данным лабораторных исследований были зафиксированы повышенная скорость оседания эритроцитов (СОЭ) до 37 мм/ч при неизмененной лейкоцитарной формуле; повышение более чем в 20 раз показателя билирубина с преобладанием прямой фракции (494–291–203 мкмоль/л); 2-кратное возрастание уровня ЩФ, 4,5-кратное – ГГТП, 1,5-кратное – трансаминаз сыворотки крови. Вирусный гепатит исключен (маркеры вирусных гепатитов А, В, С, E, F отрицательные).
Для исключения механического генеза поражения билиарного тракта пациентке срочно провели ультразвуковое исследование органов брюшной полости (билиарный сладж и конкременты в желчном пузыре и желчевыводящих протоках не обнаружены), компьютерную томографию брюшной полости с внутривенным контрастированием (данных в пользу калькулезного холецистита и расширения внутрипеченочный желчных протоков также обнаружено не было). Настойчивое продолжение поиска механического генеза патологического процесса с помощью магнитно-резонансной холангиографии выявило дефект контрастирования в верхней части общепеченочного протока: по данным специалистов-рентгенологов, не исключалось наличие конкремента (рис. 1).
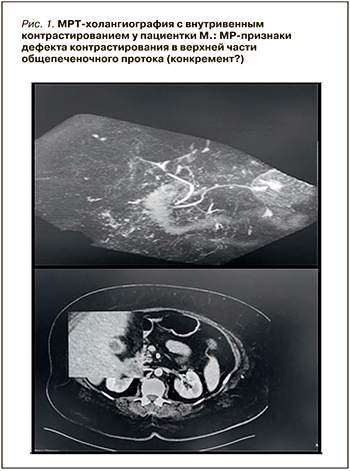
В процессе наблюдения отмечалось прогрессивное ухудшение состояния пациентки, признаками которого были нарастание астенизации, тошноты, сдвиг лейкоцитарной формулы влево (возрастание палочкоядерных нейтрофилов до 14%), повышение уровней маркеров холестаза (ЩФ до 404 Ед/л, ГГТП до 198 Ед/л, общего билирубина до 567 мкмоль/л, АЛТ до 160 Ед/л), ахоличность каловых масс несмотря на интенсивную дезинтоксикационную, спазмолитическую, гепатотропную, антибактериальную, антисекреторную терапию, назначение урсодезоксихолевой кислоты в дозе 12 мг/кг массы тела. В связи с этим мультидисциплинарным гастрохирургическим консилиумом принято решение об экстренной процедуре дренирования билиарного тракта.
В ходе предоперационной подготовки при эзофагогастродуоденоскопии была обнаружена гигантская язва (3 см) луковицы двенадцатиперстной кишки с признаками кишечного кровотечения, спровоцировавшего в последующие 2 ч острую сердечную недостаточность и гибель пациентки.
Результаты аутопсии: печень значительно увеличена в размерах (масса 1650 г), паренхима печени дряблая, поверхность серовато-зеленоватого цвета, в средней трети отчетливо определяются реберные вдавления, край печени острый. Желчный пузырь дряблый, не напряжен, длина 6,5 см, ширина тела 2,5 см, ширина шейки до 0,8 см. При надавливании на тело желчного пузыря пассаж желчи частично сохранен. В нижней трети общего печеночного протока, в месте слияния с пузырным протоком, отмечается наличие разнонаправленных полупрозрачных плоскостных сращений сероватого цвета, суживающих просвет холедоха на 80% и формирующих в месте сужения обширное муфтообразное разрастание волокнистой ткани серовато-желтого цвета со множеством мелкоточечных кровоизлияний. Слизистая оболочка внепеченочных желчных протоков сероватого цвета. Ниже места сужения холедох диаметром 0,5 см (рис. 2).
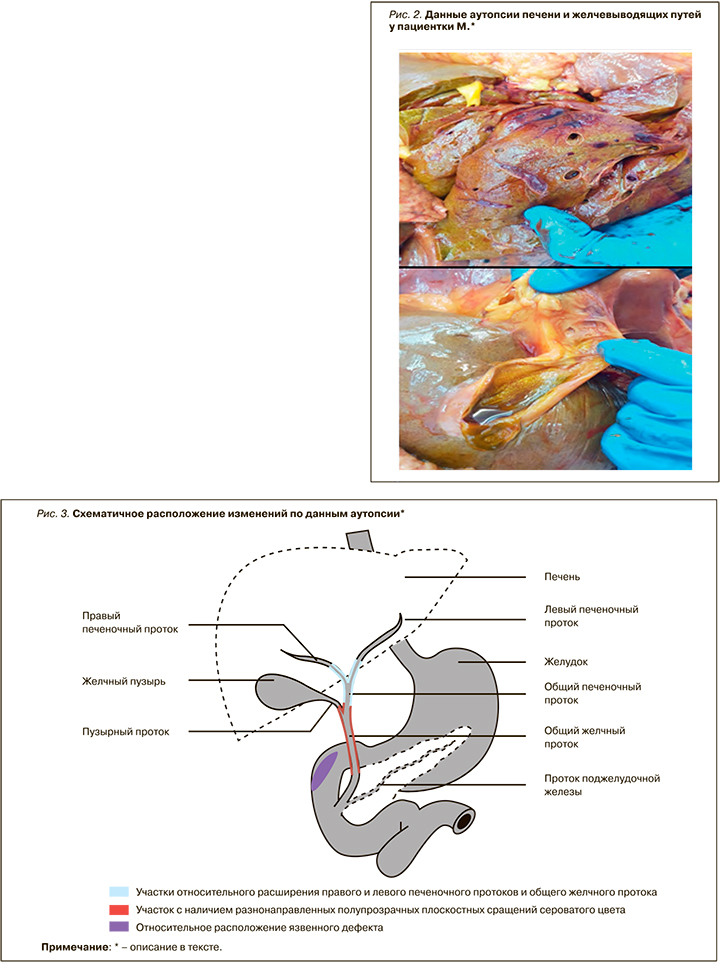
ЗАКЛЮЧЕНИЕ
Приведенный клинический случай демонстрирует развитие фиброзирующего процесса в желчевыводящих путях (рис. 3) у пациентки без предшествующей патологии печени и билиарного тракта вследствие цитопатического действия вируса SARS-CoV-2, приведшего к частичной механической обструкции с развитием тяжелого фульминантного холестатического гепатита. Нельзя исключить, что в стимуляции процесса фиброобразования внутри холедоха приняли участие широко используемые при лечении новой коронавирусной инфекции антибактериальные препараты цефалоспоринового ряда и полусинтетические пенициллины. Совокупность указанных факторов привела к изменениям в желчевыводящих путях, выраженному холестазу и летальному исходу.



