ВВЕДЕНИЕ
Пандемия новой коронавирусной инфекции оказалась серьезным вызовом для человечества и разработчиков методов лечения вирусных заболеваний. Беспрецедентно широкий круг проблем, с которым столкнулись национальные системы здравоохранения в России и за рубежом, послужил катализатором регистрации и внедрения в терапию COVID-19 новых перспективных и ранее созданных перепрофилированных лекарственных препаратов.
Учитывая особую патогенетическую значимость гипервоспалительного ответа при этом заболевании, особое внимание уделялось и продолжает уделяться лекарственным средствам, блокирующим/предупреждающим избыточные воспалительные реакции, в частности выброс провоспалительных хемокинов и цитокинов, ведущий к эндогенному повреждению тканей. Однако далеко не все попытки в этом плане a posteriori можно признать успешными.
В данном контексте значимым и положительным событием стала регистрация 28 февраля 2022 г. в России фармакологического вещества 1-[2-(1-метилимидазол-4-ил)-этил]пергидроазин-2,6-диона (условное обозначение XC221GI) как лекарственного препарата Атериксен®, разрешенного к применению в лечении COVID-19 легкого течения у взрослых в качестве средства подавления вирус-индуцированного воспаления. 3 октября 2023 г. показания к применению этого препарата расширились: в их перечень вошли неосложненные формы ОРВИ и гриппа [1].
Инновационное лекарственное средство Атериксен® относится к производным имидазола – химической группе фармакологических веществ, которая уже давно привлекает внимание ученых и врачей в связи с плейотропными биологическими/фармакологическими эффектами – от противовоспалительных и антиоксидантных до противовирусных и антибактериальных [2]. Внедрение в клиническую практику препарата Атериксен® и последовавшее расширение показаний для его применения базировались, помимо солидного доклинического бэкграунда [3], на целой серии успешных многоцентровых рандомизированных двойных слепых плацебо-контролируемых исследований.
Цель настоящего обзора – анализ опубликованных доказательств эффективности и безопасности препарата Атериксен® как средства лечения COVID-19, гриппа и других ОРВИ, полученных в клинических исследованиях и реальной клинической практике.
РАНДОМИЗИРОВАННОЕ КОНТРОЛИРУЕМОЕ ИСПЫТАНИЕ ПРЕПАРАТА АТЕРИКСЕН® КАК СРЕДСТВА ЛЕЧЕНИЯ СРЕДНЕТЯЖЕЛОЙ И ТЯЖЕЛОЙ ФОРМ COVID-19
Первой опубликованной работой, доказывающей действенность и безопасность препарата Атериксен® при COVID-19, было исследование этого лекарственного средства у госпитализированных пациентов со среднетяжелой и тяжелой формами новой коронавирусной инфекции [4]. В рамках многоцентрового адаптивного рандомизированного двойного слепого плацебо-контролируемого исследования III фазы авторы проанализировали результаты лечения 116 больных, рандомизированных в 2 группы, сопоставимые по возрасту, полу, индексу массы тела и клиническим проявлениям COVID-19. 57 пациентов, включенных в группу «Атериксен», получали этот препарат в таблетках по 100 мг 2 р./сут. в течение 14 дней. 59 больных, вошедших в группу «Плацебо», принимали таблетки плацебо по такой же схеме. Кроме того, все включенные в работу пациенты получали стандартную терапию в соответствии с утвержденными Минздравом России временными методическими рекомендации по профилактике, диагностике и лечению новой коронавирусной инфекции (версия 9), действовавшими в период исследования [5]. За пациентами наблюдали в течение 2 нед. лечения и еще 2 нед. после его завершения.
Первичной конечной точкой (ПКТ) оценки эффективности в этом исследовании служила доля пациентов, у которых констатировали клиническое улучшения к 10-му дню от старта лечения. Под клиническим улучшением понимали сочетание 3 факторов в течение 2 сут.: температура тела без приема парацетамола и/или нестероидных противовоспалительных средств – не выше 37,5 ºС, частота дыхательных движений (ЧДД) без оксигенотерапии – не выше 22 в минуту, сатурация крови кислородом (SpO2) без оксигенотерапии – не меньше 95%. Основной анализ эффективности проводился в популяции пациентов, которые получили хотя бы одну дозу препарата Атериксен® или плацебо (intention-to-treat population – ITT-популяция). Дополнительная оценка была выполнена в популяции больных, завершивших исследование в строгом соответствии с протоколом (per-protocol population – РР-популяция).
О безопасности препарата Атериксен® судили по числу, частоте встречаемости и характеристике нежелательных явлений (НЯ), зафиксированных в течение всего периода исследования, и их связи с исследуемым препаратом в PP-популяции.
Доля пациентов, достигших клинического улучшения к 10-м суткам терапии, в группе «Атериксен» была в 1,3 раза больше по сравнению с группой «Плацебо» как в ITT-популяции, так и в PP-популяции (рис.).
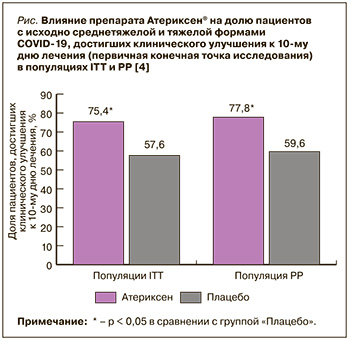
Исследуемый препарат статистически значимо превосходил плацебо и по целому ряду вторичных конечных точек (ВКТ) оценки эффективности, использованных в этой работе. Так, в группе «Атериксен» по сравнению с группой «Плацебо» время достижения SpO2 ≥ 95% оказалось примерно на сутки короче, амплитуда снижения температуры тела к вечеру 2-го дня и к утру 3-х суток лечения – на 0,3 ºС выше, время достижения температуры ≤ 37,5 ºС – на 0,7 сут. меньше, степень тяжести болезни по шкале NEWS [6] к вечеру 2-го дня – на 1,3 балла ниже, а доля пациентов, у которых тяжесть состояния к 2–6-м суткам снизилась по шкале NEWS до 2 баллов и менее, – на 10% больше.
НЯ были зарегистрированы у 28 больных, получавших Атериксен®, и у 18 пациентов, принимавших плацебо. При этом математически подтвержденных межгрупповых различий по числу, частоте встречаемости и характеру НЯ установлено не было.
Авторы сделали вывод о высокой эффективности препарата Атериксен® и его статистически значимом превосходстве над плацебо, что с учетом положительных результатов оценки безопасности позволило им сформулировать тезис о перспективности использования этого лекарственного средства в патогенетической терапии COVID-19 у пациентов, находящихся на стационарном лечении [4].
РАНДОМИЗИРОВАННОЕ КОНТРОЛИРУЕМОЕ ИСПЫТАНИЕ ПРЕПАРАТА АТЕРИКСЕН® КАК СРЕДСТВА ЛЕЧЕНИЯ COVID-19 ЛЕГКОГО ТЕЧЕНИЯ
Вторым опубликованным исследованием, демонстрирующим эффективность и безопасность препарата Атериксен® при COVID-19, стало многоцентровое адаптивное рандомизированное двойное слепое плацебо-контролируемое испытание у амбулаторных пациентов с легким течением этого заболевания [7]. Результаты исследования особенно информативны с учетом того, что сегодня Атериксен® разрешен к применению у больных новой коронавирусной инфекцией только при легких формах заболевания. Авторы рандомизировали 272 больных COVID-19 легкого течения в возрасте 18–75 лет в две группы, в которых участники исследования получали либо Атериксен® по 100 мг 2 р./сут. в течение 2 нед. (n = 137), либо плацебо по той же схеме (n = 135). Кроме того, как и в описанном выше исследовании, все участники получали стандартное лечение в рамках действовавших в тот период временных методических рекомендаций по профилактике, диагностике и лечению COVID-19, утвержденных Минздравом России (версии 11–14) [8–11]. Группы были сопоставимы по клиническим проявлениям новой коронавирусной инфекции и общим характеристикам, за исключением возраста: в группе активного препарата больные были в среднем на 5 лет старше, чем в группе «Плацебо». За включенными в работу пациентами наблюдали в течение месяца.
В комплексную ПКТ оценки действенности препарата Атериксен® входили две составляющие:
- суммарная частота перехода исходно легкого течения COVID-19 к среднетяжелым и более тяжелым формам болезни за весь период исследования;
- медиана времени до стойкого снижения суммарной выраженности симптомов COVID-19 до 1 балла и меньше по шкале основных симптомов.
Использованная авторами шкала симптомов COVID-19 представляла собой сумму оценок, выраженных в баллах от 0 до 3, общей утомляемости, ощущения заложенности в грудной клетке, боли в горле, заложенности носа, ринореи, нарушений обоняния, расстройств вкуса, миалгии и головной боли. Стойкое снижение суммарного балла до заданного уровня (≤1) констатировали при подтверждении такой оценки на втором из двух последовательных определений. Основной анализ эффективности проводился в ITT-популяции, дополнительный – в PP-популяции. Безопасность терапии оценивалась в ITT-популяции.
Анализ эффективности по обеим составляющим комплексной ПКТ в PP-популяции продемонстрировал превосходство Атериксен® над плацебо:
- доля пациентов, перешедших к среднетяжелому и более тяжелому течению COVID-19 за весь период исследования, в группе «Атериксен» была в 5 раз меньше, чем в группе «Плацебо»: 1,5% (2 из 137 пациентов) против 7,4% (10 из 135 пациентов);
- на фоне приема исследуемого препарата стойкое клиническое улучшение наступало на сутки быстрее по сравнению с группой «Плацебо». Дополнительная оценка действенности проводимой терапии по комплексной ПКТ в ITT-популяции подтвердила межгрупповые различия примерно с такой же степенью превосходства препарата Атериксен® над плацебо, как и в PP-популяции.
Оценка эффективности проводимого лечения по большинству ВКТ сделала представленные выше данные еще более убедительными. Так, в группе «Атериксен» доля пациентов, достигших клинического улучшения по шкале Всемирной организации здравоохранения на одну категорию и более через 1 нед. лечения, оказалась в 1,5 раза больше; показатели SpO2 на 5-е и 17-е сутки от старта лечения превышали аналогичные значения в контроле; время достижения улучшения по симптому «заложенность носа» и срок достижения оценки ≤ 1 балл по шкале ночного кашля были короче, чем в группе «Плацебо». Госпитализация потребовалась только 1 больному, получавшему Атериксен®, и 5 пациентам, у которых использовалось плацебо.
В ходе исследования были зарегистрированы 26 НЯ у 18 (13,2%) пациентов, применявших плацебо, в том числе 6 серьезных НЯ (СНЯ) у 5 (3,7%) больных; в группе активного лечения эти показатели составили 21 НЯ у 12 (8,8%) пациентов, включая 1 СНЯ (0,7%).
В группе «Атериксен» выявили 1 случай вирусного поражения легких («пневмонии»), при этом не было зафиксировано ни одного летального исхода. В группе «Плацебо» имели место 4 случая вирусного поражения легких, один из которых завершился летальным исходом. Математически подтвержденных межгрупповых различий по частоте, структуре, степени тяжести и связи НЯ/СНЯ с исследуемой терапией не обнаружили.
Результаты этого исследования не оставили сомнений в целесообразности и безопасности применения препарата Атериксен® при COVID-19 легкого течения у амбулаторных пациентов.
НАБЛЮДАТЕЛЬНОЕ КЛИНИЧЕСКОЕ ИССЛЕДОВАНИЕ ЭФФЕКТИВНОСТИ И БЕЗОПАСНОСТИ ПРЕПАРАТА АТЕРИКСЕН® У БОЛЬНЫХ COVID-19
Положительные результаты рандомизированных контролируемых испытаний были подтверждены и в рамках наблюдательного исследования «СУПРА», в котором оценивался опыт практического использования препарата Атериксен® терапевтами и врачами общей практики [12]. В работу, проведенную с 19 ноября 2022 г. по 15 марта 2023 г. (на закате пандемии COVID-19) в 15 городах России, включили 115 взрослых (18–60 лет) пациентов с лабораторно подтвержденной SARS-CoV-2-инфекцией легкого течения. Из них 106 человек завершили лечение к запланированной дате окончания наблюдательной программы. Основным сопутствующим заболеванием в этой выборке пациентов была артериальная гипертензия.
Все участники исследования, помимо стандартной терапии, предусмотренной актуальными на тот период временными методическими рекомендациями по профилактике, диагностике и лечению COVID-19, утвержденными Минздравом России (версии 16 и 17) [13, 14], получали Атериксен® по 100 мг 2 р./сут. в течение 2 нед. Действенность проводимой терапии определяли по средней длительности заболевания и степени удовлетворенности лечением врачей и пациентов по 5-балльной шкале Ликерта.
Средняя длительность заболевания не превышала 9,5 сут., что подтверждало продемонстрированную в рандомизированных исследованиях способность препарата Атериксен® предупреждать переход заболевания в более тяжелое/осложненное течение. Как лечащие врачи, так и пациенты характеризовали свою удовлетворенность лечением по шкале Ликерта главным образом максимально высокой оценкой. Авторы этой работы не зарегистрировали ни одного случая НЯ и констатировали хорошую переносимость исследуемого лекарственного средства у всех пациентов [12].
РАНДОМИЗИРОВАННОЕ КОНТРОЛИРУЕМОЕ ИСПЫТАНИЕ ПРЕПАРАТА АТЕРИКСЕН® КАК СРЕДСТВА ЛЕЧЕНИЯ ОРВИ И ГРИППА
На «хвосте» пандемии COVID-19 в осенне-зимне-весенний эпидемический сезон 2022–2023 гг., который получил название «тридемия» (хотя, на наш взгляд, более точно сложившуюся тогда и повторившуюся в сезоне 2023–2024 гг. эпидемическую ситуацию характеризуют определения «мультидемия», или «x-демия»), наряду с новыми субтипами омикрон-варианта SARS-CoV-2 активно циркулировали вирусы гриппа А (преимущественно сероподтипа H1N1) и В, респираторно-синцитиальный вирус (РСВ), риновирус, метапневмовирус, аденовирус, вирус парагриппа и бокавирус. Частичная потеря коллективного иммунитета к данным возбудителям за два года реализации мер, направленных на предотвращение распространения COVID-19, после ослабления/отмены этих мер способствовала большей частоте развития среднетяжелых и тяжелых форм ОРВИ и гриппа по сравнению с показателями, регистрировавшимися до пандемии. Это вновь актуализировало проблему оптимизации лечения сезонных инфекций дыхательных путей.
Именно в этих условиях весьма своевременно было проведено многоцентровое рандомизированное двойное слепое плацебо-контролируемое испытание III фазы, в котором оценивались действенность и безопасность препарата Атериксен® у пациентов с легкими и среднетяжелыми формами гриппа или других ОРВИ [15]. Критерием невключения/исключения в этом исследовании выступал верифицированный или вероятный диагноз COVID-19. 260 больных гриппом или другими сезонными ОРВИ в возрасте 18–65 лет, включенных в работу, рандомизировали в две сопоставимые группы по 130 человек, в которых они, помимо стандартной симптоматической терапии, предусмотренной актуальными клиническими рекомендациями, получали либо Атериксен® по 100 мг 2 р./сут. в течение 5 дней, либо плацебо в том же режиме. Участники в течение 10 дней 2 р./ сут. (до очередного применения симптоматических средств) оценивали по 4-балльной шкале от 0 до 3 и регистрировали в дневнике выраженность основных симптомов ОРВИ (заложенности носа / насморка, боли в горле, кашля, боли в мышцах, головной боли, усталости, озноба/потливости), а также фиксировали результаты измерения температуры тела. В качестве ПКТ оценки эффективности лечения использовалось время с момента первого приема препарата до клинического улучшения. Клиническое улучшение констатировали, когда все указанные симптомы регрессировали и сохранялись не менее суток на уровне ≤ 1 балл при температуре тела < 37,0 °C без использования антипиретиков. Основной анализ эффективности выполнялся в популяции пациентов (n = 104) с лабораторно подтвержденным гриппом или ОРВИ, завершивших исследование по протоколу (per protocol infected, PPI). Основными возбудителями заболевания в этой популяции выступали риновирус (52%), вирусы гриппа А (H1N1) (31,7%) и В (5,7%), метапневмовирус (5,7%). Дополнительно эффективность терапии оценивалась в популяциях ITT и РР, включающих и пациентов с неидентифицированным возбудителем. Безопасность лечения анализировалась у всех пациентов, получивших как минимум одну дозу исследуемого препарата/плацебо.
В исследовании было установлено математически подтвержденное превосходство препарата Атериксен® над плацебо по ПКТ как при основном, так и дополнительном анализе во всех популяциях: исследуемый препарат ускорял достижение клинического улучшения примерно на 1-е сутки. В основной популяции (PPI) Атериксен® сокращал на 20,6% среднее значение и на 20% медиану времени достижения клинического улучшения.
Оценка эффективности по ВКТ подтвердила превосходство препарата Атериксен® над плацебо в отношении купирования отдельных катаральных симптомов и симптомов интоксикации. В частности, под влиянием исследуемого препарата в популяции PPI медиана времени купирования лихорадки сокращалась на 20%, а среднее значение этого показателя – на 17,2%, т. е. примерно на сутки. Сходные по амплитуде и значимости межгрупповые различия были обнаружены в популяциях РР и ITT.
Также Атериксен® статистически значимо ускорял регрессию и других симптомов ОРВИ и гриппа: головной боли, заложенности носа / насморка.
Наряду с прочим исследование продемонстрировало благоприятный профиль безопасности препарата. Так, частота развития НЯ, относящихся к категории «нарушения со стороны дыхательной системы, органов грудной клетки и средостения», в группе «Плацебо» более чем вдвое превышала таковую в группе «Атериксен». При анализе частоты других НЯ существенных межгрупповых различий выявлено не было. Зарегистрированные НЯ имели легкую (89,1%) или среднюю (10,9%) степень тяжести, не требовали госпитализации, не приводили к отмене исследуемого препарата и исключению пациента из исследования. При этом связь с приемом препарата в подавляющем большинстве случаев была классифицирована как неопределенная или сомнительная.
На основании приведенных результатов авторы сделали вывод, что Атериксен® является эффективным и безопасным средством лечения гриппа и других ОРВИ у взрослых [15].
ОБСУЖДЕНИЕ
Обращает на себя внимание убедительность доказательств эффективности и безопасности препарата Атериксен® при новой коронавирусной инфекции, полученных в течение достаточно большого отрезка времени, в ходе которого наблюдались разные волны пандемии COVID-19, происходили последовательные смены доминирующих субтипов SARS-CoV-2, а также систематически обновлялись временные методические рекомендации по профилактике, диагностике и лечению COVID-19, утвержденные Минздравом России (версии 9–17). Это говорит о том, что эволюция SARS-CoV-2 и модернизация базисной терапии COVID-19 не оказывают существенного влияния на степень эффективности исследуемого препарата как компонента комплексного лечения этого заболевания.
Не меньшая амплитуда терапевтических эффектов препарата Атериксен® выявлена и в рамках рандомизированного контролируемого испытания у пациентов с сезонными ОРВИ и гриппом в условиях мультидемии/х-демии сезона 2022–2023 гг.
Очевидно, Атериксен® блокирует универсальные звенья патогенеза респираторных инфекций, что положительно влияет на клинически значимые исходы при этиологически различных вирусных заболеваниях дыхательных путей. Раскрытые и предполагаемые механизмы действия исследуемого препарата освещены и проанализированы в недавней работе А.Г. Малявина с соавт. [15].
Фармакологические эффекты препарата Атериксен®, установленные в клинических исследованиях, принципиально отличают его от нестероидных противовоспалительных средств и парацетамола, которые, обладая бесспорным антипиретическим действием, в то же время не улучшают клинически значимые исходы при COVID-19 [16, 17], риновирусной инфекции [18] и гриппе [19, 20].
Кортикостероиды, широко используемые в лечении COVID-19, также не могут рассматриваться как альтернатива препарату Атериксен® при лечении сезонных ОРВИ и гриппа в связи с их неоднозначным действием на показатели смертности и частоту развития вторичных инфекций, достаточно высоким риском НЯ [21, 22] и негативным влиянием на эффективность противовирусного иммунитета [23].
Несмотря на то что ПКТ и ВКТ, применявшиеся в проанализированных исследованиях, не позволили зафиксировать ускорения эрадикации возбудителей, клиническую эффективность препарата Атериксен® можно по крайней мере отчасти связать с его способностью опосредованно снижать вирусную нагрузку, продемонстрированную ранее на модели РСВ-инфекции in vivo [3].
ЗАКЛЮЧЕНИЕ
Выверенный дизайн и солидные объемы выборок в серии рандомизированных контролируемых испытаний, подкрепленные данными наблюдательного исследования, позволяют сформулировать убедительные рекомендации по использованию препарата Атериксен® в комплексной терапии COVID-19, гриппа и других сезонных ОРВИ, что следует учесть разработчикам/составителям клинических рекомендаций по ведению пациентов с этими заболеваниями.



