ВВЕДЕНИЕ
Патогенетические механизмы острого и хронического воспалительного процесса слизистых оболочек верхних дыхательных путей определяются активностью патогенов на их поверхности и состоянием факторов колонизационной резистентности слизистых полости носа [1]. Инфекционный агент может быть причиной иммунных нарушений, вызванных своими факторами адгезии, инвазии, выработкой токсинов (рис. 1) [2].
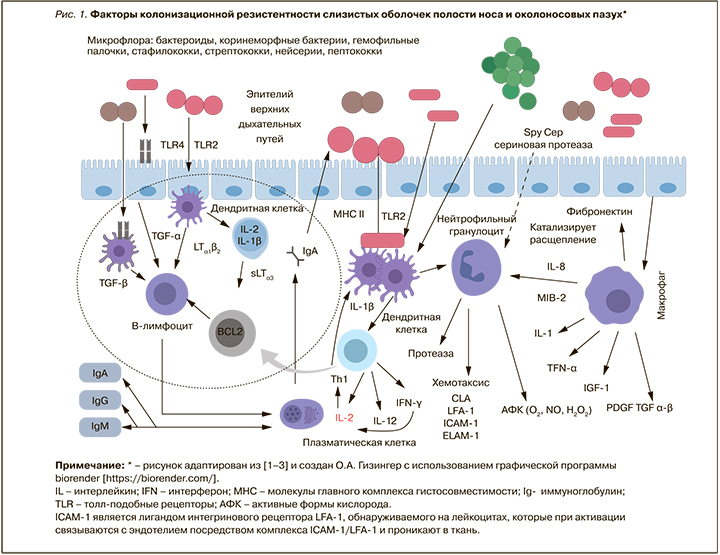
В работах О.В. Калюжина показано, что такие патогенные и условно-патогенные микроорганизмы на поверхности слизистых оболочек полости носа и околоносовых пазух, как Staphylococcus aureus, Streptococcus pyogenes, Streptococcus viridans, Klebsiella pneumoniae, Klebsiella ozenae, Haemophilus influenzae, Neisseria catarrhalis, Streptococcus pneumoniae и др., способны подавлять иммунный ответ, манипулируя механизмами супрессии избыточных иммунных реакций, связывая иммуносупрессорные рецепторы, усиливая местное и системное воспаление [3]. Например, пиогенный стрептококк может паразитировать на механизмах трансляции эпителиальных клеток дыхательных путей, путях его распознавания дендритными клетками и макрофагами, что приводит к нарушению продукции интерферона (IFN) I типа. Данный процесс, по мнению Stark G.R. et al., напрямую связан с количественным и качественным потенциалом цитозольных патоген-распознающих рецепторов (PRR). Взаимодействие толл-подобных рецепторов (TLR) с лигандами на поверхности бактериальной клетки приводит к индукции сигнальных путей NF-kB и МАР-киназы, которые, в свою очередь, индуцируют избыточный синтез и секрецию провоспалительных цитокинов, таких как интерлейкин 1 (ИЛ-1), ИЛ-8, а также молекул, стимулирующих презентацию антигена (см. рис. 1) [4].
В процессе реализации иммунного ответа синтезированные IFN I типа могут запускать индукцию экспрессии генов при участии янус-киназ (JAK) с активацией сигнальной трансдукции и белков STAT (активаторов факторов транскрипции) [4]. Но тут формируется патогенетический замкнутый круг, поскольку для синтеза столь важных и нужных IFN необходима активация клеток с участием TLR, RIG-I-подобных рецепторов (RLR – RIG- I, MDA5), фермента хеликазы, cGas (циклической GMP-AMP-синтазы), рецепторов на клетках макроорганизмов, колонизирующих дыхательные пути. Совокупность иммунных факторов и взаимодействий микро- и макроорганизма принимает участие в распознавании чужеродных сайтов антигена и нуклеиновых кислот эпителиоцитов дыхательных путей, стимулирует выработку IFN I типа [4]. Поскольку же зависимая от антигенных воздействий гиперактивация иммунных механизмов оказывает деструктивные воздействия на скорость репарации слизистых оболочек верхних дыхательных путей, то направлениями стабилизации иммунных нарушений являются как снижение количества патогенов на поверхности слизистых оболочек («входных воротах» для инфекционных возбудителей), так и активация факторов местной антимикробной и противовирусной защиты.
ЭЛИМИНАЦИОННО-ИРРИГАЦИОННАЯ ТЕРАПИЯ КАК ВАЖНОЕ НАПРАВЛЕНИЕ В ТЕРАПИИ ЗАБОЛЕВАНИЙ ВЕРХНИХ ДЫХАТЕЛЬНЫХ ПУТЕЙ
Воспалительный процесс в полости носа и околоносовых пазухах сопровождается отеком слизистой оболочки, затруднением носового дыхания и ринореей, что негативно отражается на качестве жизни пациентов. К настоящему времени накоплена солидная доказательная база применения солевых растворов различных концентраций (гипотонических, гипертонических, физиологических) при лечении инфекционно-воспалительных заболеваний полости носа, в том числе в комплексной терапии интермиттирующего аллергического ринита [5]. Для очищения полости носа используют элиминационно-ирригационную терапию изотоническими или гипотоническими солевыми растворами на основе морской воды или натрия хлорида [6].
Исследования 2020–2022 гг. показали, что наряду с распространением в популяции неинвазивных форм стрепто- и стафилококковой инфекции, бактерионосительства, отмечается рост резистентности микроорганизмов и частоты встречаемости мультирезистентных штаммов, формирования биопленок с преобладанием на поверхности слизистых оболочек полости носа патогенных микроорганизмов и условно-патогенных видов в количестве, превышающем КОЕ 104/мл [7]. Биопленки, содержащие в планктонной и сесильной части антигены бактерий, вирусов и грибов рода Candida, вызывают хронические инфекции носоглотки, при которых инфекция и воспалительный ответ сохраняются, несмотря на адекватную терапию и работающие механизмы иммунной защиты макроорганизма [8].
Глубокое и всестороннее изучение возможностей использования солевых ирригационных растворов позволило рекомендовать эти средства для снижения количества патогенов и нормализации содержания провоспалительных компонентов на слизистых оболочках полости носа и околоносовых пазух [9]. Обоснована целесообразность применения гипертонического раствора натуральной стерильной морской соли в качестве альтернативы топическим сосудосуживающим средствам, имеющим значительное число противопоказаний и побочных эффектов [10].
Использование ирригационных процедур и солевых растворов (в том числе с дополнительными активными компонентами) для очищения носа и лечения не только имеет доказательную и необходимую нормативно-правовую базу, но и прошло проверку временем и приверженностью пациентов и врачей к их применению. По мнению В.М. Свистушкина с соавт., введение солевых растворов уже стало рутинным методом лечения в арсенале практикующего оториноларинголога, терапевта, врача семейной медицины, подтвердившим свою безопасность и эффективность [11]. Растворы морской соли рекомендованы к применению в большинстве схем и алгоритмов лечения заболеваний слизистой оболочки полости носа и околоносовых пазух, например в рекомендациях Российского общества ринологов, Европейских согласительных документах по риносинуситу и назальным полипам (EPOS), аллергическому риниту и его влиянию на астму (ARIA) [12]. Промывание полости носа солевыми растворами различных концентраций хлорида натрия может быть использовано для лечения пациентов с острыми и хроническими воспалительными ЛОР-заболеваниями, для постоперационного туалета после внутриносовых хирургических вмешательств.
Важно отметить, что назальное использование солевых растворов различной концентрации не влияет отрицательно на антимикробную активность факторов врожденного иммунитета [13]. Орошение полости носа и околоносовых пазух изотоническими солевыми растворами способствует повышению гидратации подлежащей водной основы, что, в свою очередь, увеличивает частоту биения ресничек и уменьшает концентрацию локальных медиаторов воспаления [14]. Назальный спрей гипертонического раствора морской соли, обогащенный дополнительными комплексами, обладает протективным эффектом от бактерий и вирусов, позволяет нормализовать клиническую картину, снизить количество рецидивов ЛОР-инфекций, восстановить функционально-метаболический статус нейтрофилов поверхности слизистой оболочки полости носа, баланс факторов перекисного окисления липидов и ферментов антиоксидантной системы – супероксиддисмутазы и каталазы [2]. Применение гипертонического раствора морской соли с концентрацией хлорида натрия 19–23 г/л для орошения слизистых оболочек полости носа при острых риносинуситах приводит к сокращению сроков лечения, уменьшению частоты повторных эпизодов заболевания, восстановлению функционально-метаболического статуса клеток врожденного иммунитета. Анализ результатов исследований позволяет рекомендовать гипертонический солевой раствор для включения в комплекс лечебных мероприятий при обострении рецидивов риносинусита [15].
ОБОСНОВАНИЕ ПРИМЕНЕНИЯ СОЛЕВЫХ ИРРИГАЦИОННЫХ РАСТВОРОВ В ЛЕЧЕНИИ И ПРОФИЛАКТИКЕ COVID-19 И ОРВИ, РЕАБИЛИТАЦИИ ПОСТКОВИДНЫХ РАССТРОЙСТВ
Назальная ирригация является высокоэффективным методом неспецифической профилактики острых респираторных инфекций [11]. Включение этого метода в терапию больных риносинуситами на этапе постковидной реабилитации позволяет быстрее достичь улучшения субъективного состояния.
По нашему мнению, в основе выбора ирригационного солевого раствора обязательно должны учитываться такие факторы, как его эффективность, безопасность и физиологичность действия, состояние пациента, цели, которые планирует достигнуть врач при использовании препарата [16]. Благодаря своим смачивающим свойствам физиологический раствор морской соли способствует лучшему увлажнению слизистых верхних дыхательных путей, снижает биоаэрозольную и вирусную нагрузку, превращает слизь, покрывающую респираторный эпителий, в гель, поддерживает биение ресничек и улучшает мукоцилиарный клиренс.
Известно, что коронавирусы, включая SARS- CoV-2, повреждают реснитчатый эпителий носа и дыхательных путей; при этом показано, что солевой раствор ингибирует репликацию SARS- CoV-2 в клетках Vero за счет нарушения проникновения вируса с привлечением АПФ 2 рецепторов и формированием хлорид-зависимой конфигурации АПФ 2 и активации натриевого канала ENaC. Кроме этого, изотонический, гипотонический и гипертонические солевые растворы способны изменять активность фермента миелопероксидазы в эпителиальных или фагоцитарных клетках с образованием хлорноватистой кислоты, потенциируя кислородзависимый метаболизм нейтрофильных гранулоцитов и макрофагов [17]. Клинически обработка носа или дыхательных путей солевым раствором уменьшает симптомы, вызываемые сезонными коронавирусами и другими вирусами ОРВИ [18].
Поскольку очищение от патогенов, соблюдение элементного баланса, водородного показателя и вязкости назального секрета наиболее важны для поддержания нормальной активности местного иммунитета и микрофлоры верхних дыхательных путей, вопрос выбора назальных солевых средств, используемых для достижения этой цели, требует детального рассмотрения. Российским препаратом этого класса с инновационным минеральным составом является Акваназаль (производитель АО «Алтайвитамины», Россия), предназначенный для орошения и промывания носа у детей с 2 лет и взрослых.
Акваназаль содержит природную минеральную воду Алтая, которая добывается из артезианских источников, находящихся в Алтайском крае (село Стан-Бехтемир). Отличительная особенность этой минеральной воды – высокое содержание природных ионов серебра (Ag+), кальция (Ca2+), натрия (Na+), калия (К+) и магния (Mg2+). Природная минеральная вода, обогащенная натуральной морской солью, обеспечивает широкое терапевтическое действие благодаря противовоспалительному, антисептическому, бактерицидному и бактериостатическому эффектам, а также фунгицидным свойствам. Параметры и состав такого раствора позволяют рекомендовать его для следующих целей:
- профилактика в периоды эпидемий ОРВИ и гриппа;
- ускорение восстановления слизистой оболочки после хирургических манипуляций в полости носа и носовых пазухах;
- ежедневная гигиена и увлажнение носа;
- комплексная терапия ринитов, синуситов, аденоидитов;
- профилактика развития аллергических реакций в период цветения «аллергенных» растений;
- поддержание физиологических параметров слизистой оболочки полости носа, в том числе при длительном нахождении в неблагоприятных условиях внешней среды (сухой воздух, наличие во вдыхаемом воздухе пыли, гаптенных форм, агрессивных химических веществ, перепады температур).
В публикациях пандемического периода COVID-19 отмечен высокий уровень эффективности назальной ирригации у пациентов с острым вирусным и поствирусным риносинуситом (Ib) и реабилитации пациентов на этапе пост-ковида при сохранении собственных механизмов защиты от патогенов с реализацией врожденных и адаптивных иммунных факторов [19, 20].
РОЛЬ И ВОЗМОЖНОСТИ ИОНОВ СЕРЕБРА В РЕГУЛИРОВАНИИ СИСТЕМНЫХ И ЛОКАЛЬНЫХ ГОМЕОСТАТИЧЕСКИХ ПРОЦЕССОВ И ИММУННЫХ РЕАКЦИЙ
Терапевтическая ценность препаратов и нутриентных комплексов, содержащих ионы серебра, подтверждается ростом числа исследований, демонстрирующих их микробиологическую и этологическую эффективность в отношении различных групп патогенных и условно-патогенных микроорганизмов [9].
Серебро относится к группе биогенных элементов, являющихся постоянным компонентом тканей человека [21]. По данным Всемирной организации здравоохранения (ВОЗ), среднее потребление серебра современным человеком находится в пределах примерно 5–8 мкг/сут, суточная норма составляет 30 мкг, максимально допустимая доза для приема внутрь – 80 мкг. Необходимо отметить, что серебро в ионизированной, хелатной и наноформах [22] не накапливается в организме человека и не обладает кумулятивным эффектом при условии соблюдения указанных ограничений ВОЗ [23].
Ионы серебра вовлечены в функционировании нуклеиновых кислот, стабилизируя их структуру, участвуют в биосинтезе IFN и цитокинов. Метаболизм серебра на уровне макроорганизма основан на его связывании с протеинами и образовании металлотионеинов, которые уменьшают клеточную токсичность этого микроэлемента и способствуют восстановлению и репарации слизистых оболочек [24]. В исследованиях А.Я. Айдиева с соавт. зарегистрирована биоцидная и лечебная эффективность лекарственных средств с Ag+, основанная на блокировании сульфгидpидных групп, которые участвуют в образовании активного центра ряда ключевых ферментов, «тормозя» их активность [25]. Имеется ряд работ, свидетельствующих об антимикробной активности ионов серебра [26, 27]. Выявлены изменения макромолекул, наблюдаемые у обработанных серебром бактерий, заключающиеся в конденсации ДНК, повреждении мембраны и белка, взаимодействии с тиоловыми группами, дестабилизации железо-сульфидных соединений и нарушении метаболизма и гомеостаза железа, а также замещении металлов в металлопротеинах [28]. Анализ обработанных серебром бактерий позволил выявить плотную электронно-световую область, представленную конденсированной ДНК в центре клеток.
Серебро является также эффективным противогрибковым средством широкого спектра действия: в исследованиях доказано подавление серебром C. albicans, C. glabrata, C. parapsilosis, C. krusei, T. mentagrophytes и др. Возможный механизм действия на грибы Ag+ – разрушение их клеточной мембраны [29].
В исследованиях in vitro продемонстрировано, что серебро может приводить к модификации ДНК, обеспечивая предпосылки к мутациям или ингибированию репликации нуклеиновых кислот [30]. По данным М.А. Носуровой, ионы серебра в зависимости от дозы могут как стимулировать, так и подавлять функции захвата, лизиса и переваривания патогенов фагоцитирующими клетками. Под влиянием ионов серебра повышается количeство иммуноглобулинов классов sА, А, М, G на поверхности слизистых оболочек [31].
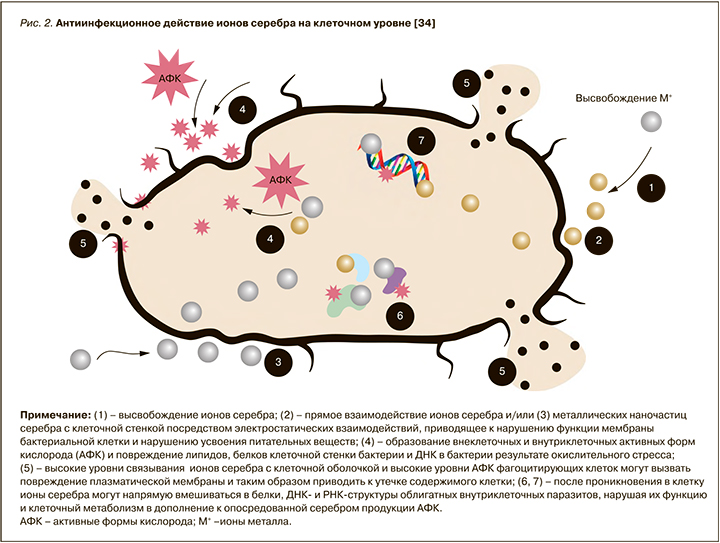
Обобщая имеющиеся литературные данные и собственные наблюдения, мы можем сформулировать механизм бактерицидного действия ионов серебра на поверхности слизистых оболочек верхних дыхательных путей и с патогенетических позиций проанализировать регистрируемую эффективность назального спрея с ионами серебра. Итак, под воздействием катионов Ag+ модифицируется слой фосфолипидов клеточной стенки патогенного микроорганизма, вследствие чего она начинает быстро терять протоны через мембранные каналы. В дальнейшем фагоцитами генерируются свободные гидроксильные радикалы, разрушающие клеточную стенку. Инфекционный агент входит внутрь клетки, нарушает транскрипцию, вступает во взаимодействие с тиоловыми группами ферментов клетки, например с дегидрогеназой-2 в дыхательной системе; это приводит к формированию гидроксильных радикалов, атакующих бактерию и повреждающих ее ДНК [32, 33]. Детальный механизм антибактериального действия ионного серебра, который включает как металло-опосредованную продукцию активных форм кислорода, так и прямое воздействие Ag+ на белки и ДНК патогена [34, 35], вызывающего нарушение его функции и клеточного метаболизма, отражен на рисунке 2.
ЗАКЛЮЧЕНИЕ
Недостаточность мер, направленных на специфическую профилактику и терапию острых и хронических респираторных бактериально-вирусных инфекций, воспалительных процессов в полости носа и околоносовых пазухах, может приводить не только к хронизации воспаления и учащению рецидивов заболеваний верхних отделов респираторного тракта, но и к формированию стойкой тугоухости, развитию патологических процессов в нижних дыхательных путях, аллергических реакций немедленного типа. Использование назальных солевых растворов с различным содержанием морской соли в форме спрея рационально на этапах профилактики, терапии и реабилитации пациентов с инфекционно-воспалительными заболеваниями верхних дыхательных путей. Ионы металлов в составе ирригационных растворов оказывают стабилизирующее, нормализующее, репарационное действие на слизистые оболочки полости носа и околоносовые пазухи.
Спреи, содержащие гипертонический, изотонический, гипотонический солевые растворы на основе натуральной артезианской воды из источников, находящихся в Алтайском крае, могут быть рекомендованы в рамках стартовой и поддерживающей терапии острых инфекционных заболеваний полости носа с целью безопасного устранения затрудненного носового дыхания, комплексной профилактики инфекционно-воспалительных заболеваний верхних дыхательных путей, а также в реабилитационном периоде после перенесенных вирусных и бактериальных поражений слизистой оболочки полости носа.



