ВВЕДЕНИЕ
Сахарный диабет (СД) является тяжелым социально значимым заболеванием, темпы распространения которого занимают лидирующие позиции во всем мире. Особую угрозу представляют тяжелые осложнения СД, приводящие к высокой инвалидизации и увеличению экономических затрат систем здравоохранения большинства стран. По данным за 2020 г., в России было зарегистрировано более 5 млн человек с диабетом [2], среди которых свыше 90% страдают СД 2-го типа (СД 2) [3]. Ранее было установлено, что 60,5% пациентов с СД 2 относятся к старшей возрастной группе, в том числе 14,3% – к категории старше 80 лет [4]. Это определяет отдельный интерес специалистов к вопросам особенностей терапии СД в группе пожилых пациентов.
В целом за последние годы стратегии терапии СД 2 претерпели колоссальные изменения. Фокус лечения сместился с чисто гликемического контроля на общее управление факторами риска с достижением индивидуализированных целевых показателей компенсации. Ставшие доступными в последние десятилетия новые классы лекарственных средств, такие как препараты инкретинового ряда и ингибиторы натрий-глюкозного транспортера-2 (иНГЛТ-2), демонстрируют высочайшие результаты в снижении риска основных неблагоприятных кардиоваскулярных событий и тяжелой почечной дисфункции. Важная роль также придается возрастающей безопасности сахароснижающих средств. В связи с этим инновационные сахароснижающие препараты, в дополнение к базовой терапии метформином, занимают сегодня видное место в алгоритмах лечения пациентов с СД 2 в большинстве стран. С учетом же того, что в развитии СД 2 ключевое значение имеет прогрессирующая дисфункция β-клеток, своевременное назначение патогенетически обоснованной протективной терапии может оказать значительное положительное влияние на долгосрочный прогноз заболевания [5].
ИНКРЕТИНОВЫЙ ДЕФЕКТ В РАЗВИТИИ САХАРНОГО ДИАБЕТА 2-ГО ТИПА
В патогенезе СД 2 одним из ключевых звеньев является нарушение продукции инсулинотропных гормонов кишечника (инкретинов), наибольшей активностью среди которых обладают глюкагоноподобный пептид-1 (ГПП-1) и гастроингибирующий пептид (ГИП). Вырабатываясь в кишечнике в ответ на пероральное поступление глюкозы, инкретины стимулируют секрецию инсулина β-клетками поджелудочной железы, подавляют продукцию глюкагона α-клетками, а также обладают рядом других, внепанкреатических эффектов (рис. 1) [6, 7]. Под влиянием инкретинов стимулируется до 70% секреции инсулина в ответ на поступление глюкозы, что указывает на важную роль инкретиновой оси в поддержании баланса глюкозы.
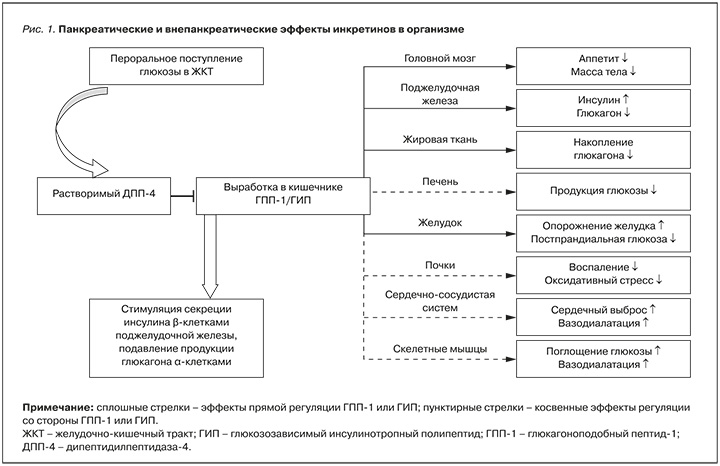
Фермент дипептидилпептидаза 4 (ДПП-4) представляет собой трансмембранный гликопротеин типа II, широко экспрессирующийся во многих тканях, включая иммунные клетки, почки, печень, поджелудочную железу, жировые клетки [8]. Механизм влияния на метаболизм глюкозы и инсулина сериновой протеазы ДПП-4 опосредован расщеплением и инактивацией ГПП-1 и ГИП, что в конечном итоге приводит к снижению постпрандиальной секреции инсулина. Наряду с относительной инсулиновой недостаточностью, разрушение инкретинов сопровождается повышением уровня глюкагона натощак и снижением подавления глюкагона после приема углеводов, что также вносит свой вклад в развитие и поддержание дисгликемии [9].
Понимание функционирования инкретиновой оси и роли ее дефекта в развитии углеводных нарушений способствовало значительным успехам в терапии пациентов с диабетом. Так, возможность предотвращения инактивации ГПП-1 стала рассматриваться как новая мишень в лечении и контроле СД 2 типа [10–12]. Благодаря расширению понимания патофизиологии СД 2 в клиническую практику были внедрены два новых класса сахароснижающих препаратов, чье действие связано с эффектами инкретинов – агонисты рецептора ГПП-1 (арГПП-1) и ингибиторы дипептидилпептидазы 4-го типа (иДПП-4).
Механизм действия последних заключается в поддержании уровня эндогенного ГПП-1 за счет ингибирования активности фермента ДПП-4, участвующего в разрушении эндогенного ГПП-1. Таким образом, использование иДПП-4 сопровождается поддержанием физиологической концентрации ГПП-1 в организме и его инсулинотропного действия.
МЕСТО ИНГИБИТОРОВ ДИПЕПТИДИЛПЕПТИДАЗЫ 4-ГО ТИПА В СОВРЕМЕННЫХ СТРАТЕГИЯХ КОНТРОЛЯ САХАРНОГО ДИАБЕТА 2-ГО ТИПА
Большинство современных клинических рекомендаций по ведению пациентов с СД 2, включая российские алгоритмы, фокусирует внимание на целесообразности определения доминирующей клинической проблемы еще на старте терапии [13]. В первую очередь при наличии у пациента атеросклеротических сердечно-сосудистых заболеваний (АССЗ) или высокого риска их развития рекомендовано назначение арГПП-1 или иНГЛТ-2 с доказанными преимуществами для этой популяции пациентов. При наличии у больного хронической сердечной недостаточности (ХСН) к терапии необходимо добавить препарат из группы иНГЛТ-2. Если у пациента выявлена хроническая болезнь почек (ХБП), терапия, наряду с прочим, должна включать препараты с нефропротективными возможностями, к которым также относятся иНГЛТ-2 и арГПП-1.
В случае же, если у пациента нет сердечно-сосудистых заболеваний (ССЗ) и ХБП, ведущие клинические рекомендации предлагают фокусироваться на безопасности в отношении развития гипогликемических состояний (с этой точки зрения в качестве приоритетной группы сахароснижающих средств рассматриваются иДПП-4), а также на необходимости влияния на массу тела пациента.
Несмотря на важные преимущества арГПП-1 в плане кардиоваскулярных прогнозов и почечной функции, применение этих препаратов в рутинной практике не слишком широко, в том числе из-за их высокой стоимости, а также риска развития нежелательных эффектов у части больных. Предпочтительной альтернативой в таком случае могут выступать иДПП-4, характеризующиеся высоким профилем безопасности и переносимости. Препараты этого класса достаточно просты в использовании, так как не требуют титрования дозы. В целом иДПП-4 считаются безопасными в отношении сердечно-сосудистых рисков, что подтверждено в ряде крупных работ, таких как EXAMINE, CARMELINA, TECOS и др. [14–20]. Более того, в одном из исследований установлено, что прием иДПП-4 ассоциирован со снижением долгосрочного сердечно-сосудистого риска у пациентов с СД 2, перенесших чрескожное коронарное вмешательство [21]. Единственным препаратом данного класса, продемонстрировавшим неблагоприятные сердечно-сосудистые эффекты, стал саксаглиптин, применение которого в исследовании SAVOR-TIMI [16] сопровождалось статистически значимым повышением частоты госпитализаций по поводу ХСН.
В связи с этим ХСН выступает противопоказанием к использованию данного препарата [22].
Стоит отметить, что, несмотря на отсутствие значимых кардио- и нефропротективных возможностей, в реальной клинической практике иДПП-4, по данным Федерального регистра больных с сахарным диабетом, являются самыми часто назначаемыми препаратами среди всех инновационных групп сахароснижающих средств. Так, за период с 2010 по 2022 г. среди новых классов сахароснижающих препаратов доля назначений иДПП-4 составила 13,3%, иНГЛТ-2 –8,7%, арГПП-1 – 1,0%.
В большинстве случаев иДПП-4 назначались в рамках комбинированной терапии, в большинстве случаев – с метформином. Значительно реже, лишь в 3,2% случаев, они использовались в рамках монотерапии [23].
Классическим примером, когда следует рассмотреть назначение иДПП-4, может быть дебют СД 2.
Немаловажно, что применение препаратов этой группы не имеет ограничений по возрасту. Основная целевая категория для назначения иДПП-4 – лица пожилого возраста, зачастую с АССЗ и риском развития тяжелых последствий на фоне гипогликемий. Нередко пациенты этой когорты имеют умеренное течение СД 2 с уровнем гликированного гемоглобина (HbA1c) 7–8% и, соответственно, не нуждаются в «мощной» сахароснижающей терапии. Препараты из группы иДПП-4 характеризуются рядом преимуществ, важных для пожилых пациентов: обладают наиболее благоприятным профилем безопасности, в том числе в плане развития гипогликемии и возможности приема на любой стадии ХБП, не увеличивают массу тела, не повышают риск сердечно-сосудистых событий, удобны в применении, что улучшает приверженность пациентов лечению [13].
В настоящее время иДПП-4 – наиболее широко представленный класс сахароснижающих препаратов, превышающий по количеству присутствующих на российском фармрынке МНН даже группу производных сульфонилмочевины. На 2023 г. 7 из 12 представителей иДПП-4 входят в Перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения в Российской Федерации [24], что подтверждает их востребованность в лечении пациентов с СД 2.
Первым препаратом класса иДПП-4, получившим одобрение к применению, стал ситаглиптин. Он подавляет активность фермента ДПП-4 на протяжении 24 ч, при этом уровень эндогенного ГПП-1 возрастает в 2–3 раза. Препарат не требует титрации, быстро всасывается при пероральном приеме в дозе 100 мг и достигает максимальной концентрации в плазме через 14 ч. Абсолютная биодоступность ситаглиптина составляет 87% и не зависит от приема пищи [25].
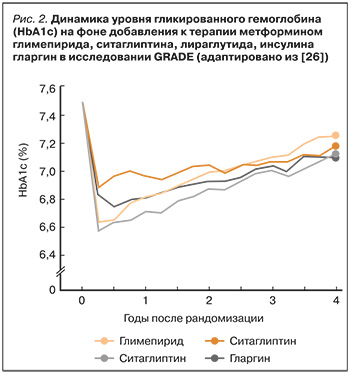
Считается, что ситаглиптин, как и другие иДПП- 4, имеет умеренно выраженное влияние на уровень глюкозы. Монотерапия этим препаратом снижает HbA1c на 0,77–0,8%, однако при выраженной декомпенсации СД (HbA1c >10%) уменьшение уровня этого маркера происходит более чем на 3%. В исследовании GRADE, включившем 5047 больных СД 2 с умеренным гликемическим контролем (средний HbA1c на момент включения 6,8–8,5%) и непродолжительным стажем заболевания, ситаглиптин, продемонстрировав на старте терапии умеренное снижение HbA1c, через 4 года терапии показал в этом отношении результаты, сопоставимые с арГГП-1 лираглутидом и инсулином гларгин (рис. 2) [26].
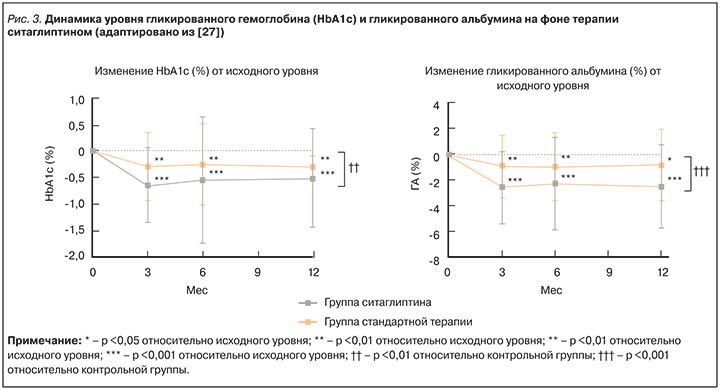
В недавнем рандомизированном многоцентровом исследовании STREAM ситаглиптин продемонстрировал эффективный и безопасный контроль гликемии у пожилых пациентов 65–80 лет (n=176) с умеренно контролируемым СД 2 [27]. В данном исследовании компенсация заболевания оценивалась не только по динамике HbA1c, но и по показателю гликированного альбумина, который в числе прочего отражает постпрандиальную гипергликемию и последующую вариабельность гликемии (рис. 3).
Еще одно преимущество иДПП-4 – возможность применения при ХБП тяжелых стадий, включая терминальную почечную недостаточность. Поскольку ситаглиптин, алоглиптин и саксаглиптин выводятся через почки, при тяжелой почечной дисфункции рекомендовано снижение дозировки этих препаратов. Корректировка дозы при этом связана с особенностями фармакокинетики, а не безопасности. Любое увеличение дозы не приведет к гипогликемии или другим нежелательным реакциям, обусловленным механизмом действия этих средств, поскольку фермент максимально ингибируется уже при приеме терапевтической дозировки [28]. Согласно данным Mori H. et al., терапия ситаглиптином ассоциирована со значительным снижением показателя микроальбуминурии у пациентов с СД 2 [29].
Результаты рандомизированного плацебо-контролируемого исследования безопасности ситаглиптина у пациентов >50 лет с АССЗ в анамнезе (n=14 671) TECOS свидетельствуют, что ситаглиптин не повышает сердечно-сосудистые риски в данной группе пациентов [30]. Таким образом, иДПП-4 можно считать одним из лучших примеров безопасной и эффективной группы сахароснижающих препаратов, широко применяющихся на практике.
ПРЕИМУЩЕСТВА КОМБИНИРОВАННОЙ САХАРОСНИЖАЮЩЕЙ ТЕРАПИИ САХАРНОГО ДИАБЕТА 2-ГО ТИПА
Так как в прогрессировании СД 2 ключевую роль играет снижение функциональных резервов β-клеток на фоне инсулинорезистентности или без нее, патогенетически обоснованным является назначение схемы терапии, воздействующей сразу на несколько мишеней развития заболевания. С учетом такой концепции во всех современных практических руководствах отражены рекомендации по выбору ранней комбинированной терапии, которая может обеспечить дополнительные преимущества по долгосрочному поддержанию гликемического контроля. При этом результаты анализа структуры медикаментозной сахароснижающей терапии при СД 2 за период 2017–2022 гг. указывают на сохраняющееся преобладание назначения пероральных сахароснижающих препаратов в виде монотерапии (45,3–41,6%), с постепенным увеличением доли двойных (с 25,8 до 30,0%) и тройных (с 1,3 до 5,8%) комбинаций лекарственных средств [3]. При этом в зоне оптимальной компенсации СД 2 (HbA1c <7,0%) за 2022 г. находились только 42,2% российских пациентов, в то время как у большинства больных СД 2 сохранялась необходимость модификации лечения [3]. Несмотря на положительную тенденцию к увеличению доли комбинированной терапии, тем не менее очевиден существующий факт недостаточной и отсроченной интенсификации сахароснижающей терапии.
Появление концепции раннего назначения комбинированной терапии, включающей иДПП-4, в значительной степени предопределили результаты исследования VERIFY с применением вилдаглиптина. В нем была показана эффективность иДПП-4 с точки зрения достижения и стойкого поддержания гликемического контроля в целевом диапазоне у больных СД 2 с небольшой продолжительностью заболевания. Это может объясняться протективным влиянием препаратов на β-клетки поджелудочной железы и, таким образом, замедлением прогрессирования заболевания [31]. Данные объединенного анализа различных исследований иДПП-4, включая VERIFY, указывают на то, что в среднем скорость потери β-клеток у пациентов с СД 2, не получавших лечение, в первые 3,8 лет в два раза выше, чем в последующие годы. Для использования же преимуществ секреции и активности эндогенного инсулина необходимо инициировать интенсивную терапию СД 2 еще на этапе, когда уровень HbA1c составляет менее 7,0% [32]. На этой стадии особенно необходима терапия, направленная на сохранение инсулин-секреторной функции β-клеток. Исходя из полученных данных, в большинстве случаев приоритетной признана стартовая комбинированная терапия СД 2 метформином и иДПП-4.
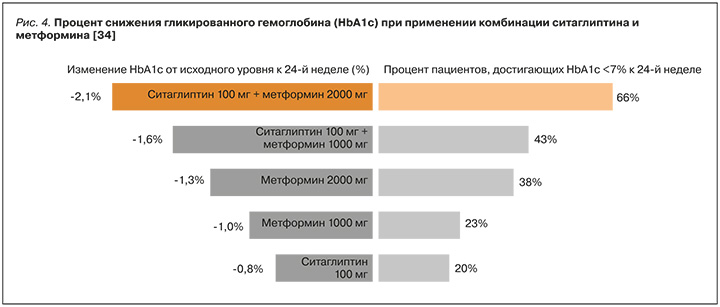
Препараты класса иДПП-4 достаточно удобны для применения в рамках двух- и трехкомпонентной комбинированной сахароснижающей терапии, в том числе у пациентов с ССЗ (с учетом противопоказаний) и ХПБ. Добавление к терапии иДПП-4 может способствовать улучшению гликемического контроля без увеличения риска гипогликемий и набора массы тела [13]. Имеются данные о том, что метформин в некоторой степени стимулирует секрецию ГПП-1, что может объяснять значимое повышение эффективности его комбинации с иДПП-4. [33]. Важным преимуществом класса иДПП-4 можно считать также наличие их фиксированных комбинаций с метформином, что, несомненно, предполагает большую приверженность пациентов терапии и, соответственно, ее эффективность. Примером может служить комбинация метформин + ситаглиптин, обеспечивающая возможность долгосрочного удержания гликемического контроля за счет сохранения инсулин-секреторной функции. При этом под влиянием ситаглиптина восстанавливается как первая, так и вторая фаза секреции инсулина. Наиболее выраженный процент снижения HbA1c был достигнут на комбинации 100 мг ситаглиптина и 2000 мг метформина в сутки (среднее внутригрупповое изменение HbA1с по сравнению с исходным уровнем составило -2,9%; рис. 4) [34].
По данным канадского ретроспективного когортного исследования историй болезней пациентов с СД 2, стартовое назначение терапии ситаглиптин + метформин снижает вероятность инициации применения инсулина на 24% по сравнению с отложенным назначением ситаглиптина [35]. Кроме того, добавление ситаглиптина к метформину уменьшает вариабельность гликемии, улучшая ее суточный контроль у пациентов с СД 2 [36].
Появление на российском фармацевтическом рынке ситаглиптина от компании КРКА – Асиглия®,и фиксированной комбинации метформина и ситаглиптина Асиглия®Мет значительно увеличило доступность применения иДПП-4 для пациентов. Доступность применения в сочетании с доказанной эффективностью и высокой безопасностью класса иДПП-4, а также потенциальным протективным эффектом в отношении β-клеток поджелудочной железы позволяет расширить возможности имплементации раннего комбинированного подхода в ведении СД 2.
ЗАКЛЮЧЕНИЕ
Внедрение в клиническую практику новых классов сахароснижающих лекарственных средств, включая препараты инкретинового ряда, глобально изменили подходы к лечению СД 2. Взаимодополняющее действие ситаглиптина и метформина обеспечивает существенное улучшение контроля гликемии, а благодаря сохранению инсулин-секреторной функции замедляет прогрессирование заболевания. Более раннее назначение комбинации ситаглиптина и метформина обеспечивает лучший долгосрочный контроль гликемии. Высокий профиль безопасности и переносимости определяет приемлемость использования иДПП-4 у разных категорий пациентов, без ограничений по возрасту и коморбидности.



