20 ноября 2023 г. в Москве под эгидой Общерос-сийской общественной организации «Российское научное медицинское общество терапевтов» (РНМОТ) состоялось заседание Совета экспертов, посвященное актуальным вопросам влияния артериальной гипертензии (АГ) на головной мозг как орган-мишень.
Целями мероприятия стали рассмотрение влияния АГ на головной мозг в аспекте его когнитивного функционирования, обсуждение актуальности и распространенности этой проблемы; определение роли когнитивного дефицита в снижении качества жизни пациентов; оценка целесообразности нового подхода к терапии сосудистых когнитивных нарушений (СКН) с применением препарата этилметилгидроксипиридина сукцинат для врачей первичного амбулаторного звена.
АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ И КОГНИТИВНЫЕ НАРУШЕНИЯ: ТЕСНАЯ СВЯЗЬ
По данным российских и зарубежных авторов, почти треть взрослого населения в мире имеет артериальное давление (АД) выше 140/90 мм рт. ст., и более половины – выше 130/90 мм рт.ст. При этом повышенное АД более распространено у мужчин [1, 2].
АГ выступает основным модифицируемым фактором риска развития когнитивных расстройств [3, 4]. Согласно актуальным данным зарубежных авторов, частота умеренных когнитивных расстройств (УКР) находится в диапазоне от 11 до 20% среди лиц старше 65 лет [5]. Пациенты, страдающие АГ, часто испытывают прогрессирующее снижение когнитивного статуса и физической активности, что негативно отражается на качестве их жизни [6]. Доказано, что степень снижения качества жизни и общей функциональной активности пациентов варьирует в зависимости от процесса старения и сопутствующих заболеваний [7]. Повышение АД ассоциируется с развитием когнитивных нарушений в среднем возрасте и деменции в пожилом, а интенсивная терапия АГ с достижением целевых цифр АД уменьшает риски развития этих нарушений [8]. УКР у пациентов с АГ, как правило, не приводят к утрате независимости и самостоятельности в повседневной жизни, но вызывают затруднения при осуществлении сложных видов деятельности, приобретении новых навыков и обучении [9].
В стандарты ведения пациентов с АГ должно быть обязательно включено регулярное нейропсихологическое обследование, по крайней мере для лиц 65 лет и старше [10].
АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ КАК ЧРЕЗВЫЧАЙНО АКТУАЛЬНАЯ И РАСПРОСТРАНЕННАЯ МЕДИЦИНСКАЯ ПРОБЛЕМА В МИРЕ И РОССИИ
АГ остается одним из наиболее часто встречающихся сердечно-сосудистых заболеваний (ССЗ) в мире. Ее распространенность среди взрослого населения в мире варьирует в пределах 30–45% [3]. В России среди мужчин в возрасте 25–65 лет распространенность АГ достигает 47%, среди женщин – около 40% [11]. При анализе частоты встречаемости АГ в зависимости от возраста пациентов в нашей стране было установлено, что после 60 лет это заболевание наблюдается в 60% случаев, а по достижении 80-летнего возраста регистрируется почти у 80% населения [12]. По данным за 2019 г., 32% женщин и 34% мужчин в возрасте 30–79 лет в мире страдали АГ [13].
АГ является ведущим фактором риска развития сердечно-сосудистых (инфаркт миокарда, ишемическая болезнь сердца, хроническая сердечная недостаточность), цереброваскулярных (инсульт ишемический или геморрагический, транзиторная ишемическая атака) и почечных (хроническая болезнь почек) заболеваний [12].
ГОЛОВНОЙ МОЗГ КАК ОРГАН-МИШЕНЬ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ
При АГ развиваются патологические деструктивные изменения сосудов головного мозга. Прежде всего поражаются интрацеребральные артерии диаметром 50–70 мкм и микроциркуляторное русло. Патоморфологической основой поражения сосудов при АГ служат плазмо- и микрогеморрагии, некротические изменения сосудистой стенки [14]. Кроме интракраниальных сосудов, при этом заболевании страдают и экстрацеребральные артерии: развивается гипертрофия их мышечной оболочки, формируются стенозы и облитерация просвета, что приводит к ишемии головного мозга. Получены данные, свидетельствующие о негативном влиянии системного воспаления на эластичность сосудистой стенки крупных (магистральных) артерий, а также о его значимой роли в прогрессировании эндотелиальной дисфункции у больных АГ [15].
Наряду с этим доказана тесная взаимосвязь выраженности эндотелиальной дисфункции и уровня центрального аортального давления, а также ухудшение эластических свойств артерий у пациентов с метаболическим синдромом [16]. Основной мишенью для АГ в головном мозге являются все сосуды малого калибра (от 5 мкм до 2 мм), при этом поражаются глубокие артерии-перфоранты, в результате чего страдает белое вещество головного мозга, т.е. развивается «болезнь малых сосудов» (БМС), или церебральная микроангиопатия [14]. БМС выявляется практически у половины пациентов с АГ [17].
СОСУДИСТЫЕ КОГНИТИВНЫЕ НАРУШЕНИЯ – ОСНОВНЫЕ КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ ПОРАЖЕНИЯ ГОЛОВНОГО МОЗГА ПРИ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ
Начальные признаки СКН на фоне АГ отражаются в жалобах пациентов, объективно определить которые можно только при проведении развернутого нейропсихологического тестирования. В дальнейшем когнитивная дисфункция у больных АГ проявляется в первую очередь ухудшением управляющих функций (планирования и контроля познавательной деятельности и поведения), способности к переключению с одного вида деятельности на другой, навыков планирования повседневной деятельности, адаптации к меняющимся окружающим условиям. Кроме этого, страдают концентрация внимания, зрительно-пространственный праксис (трудности рисования объемных изображений). Для пациентов с АГ характерна замедленность при выполнении когнитивных задач. Важно отметить, что у больных АГ в отличие от пациентов с нейродегенеративными заболеваниями память затронута в меньшей степени [18].
ДИАГНОСТИКА СОСУДИСТЫХ КОГНИТИВНЫХ НАРУШЕНИЙ
Алгоритм диагностики СКН, позволяющий определить выраженность когнитивной дисфункции у пациента с АГ, представлен на рисунке [18].
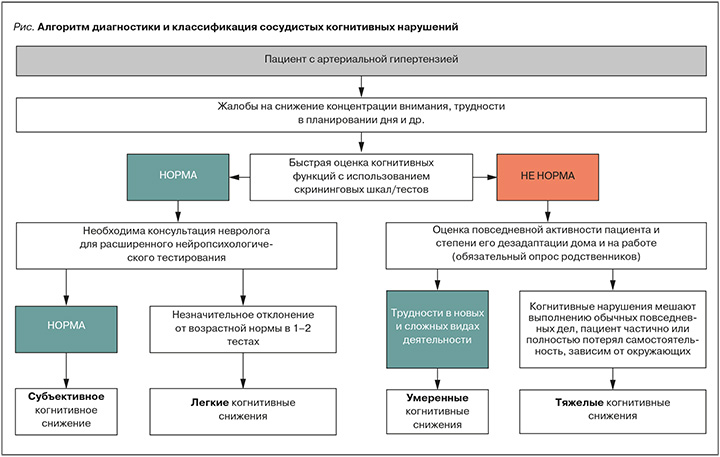
Для диагностики СКН в настоящее время используются нейропсихологические методики, позволяющие определить степень когнитивного снижения, а также вид когнитивных функций (КФ), который страдает в большей степени. Ксожалению, не существует единой рекомендованной шкалы для оценки КФ у пациентов с АГ, поскольку проявления СКН довольно многообразны. Наиболее известными и часто применяемыми инструментами оценки СКН служат Монреальская шкала оценки когнитивных функций (MoCA-тест), краткая шкала оценки психического статуса (MMSE), тест рисования часов, тест подбора цифр к символам (DSST), оценивающий концентрацию внимания, оперативную память и другие КФ [18].
Нейроанатомические исследования свидетельствуют, что более легкие нарушения КФ чаще всего связаны с патологическими изменениями мелких сосудов мозга, тогда как более выраженная когнитивная дисфункция наблюдается у больных с обширными нейроморфологическими изменениями, включая постинсультные очаги, лакунарные инфаркты, выраженный лейкоареоз, атрофию ткани мозга (корковую и гиппокампальную) и другие сосудистые изменения. Когнитивная сохранность пациентов с АГ зависит от их возраста, определяется генетическими факторами, контролем АД (нахождением этого показателя в целевом диапазоне), когнитивным резервом и наличием сосуществующей нейродегенеративной патологии [19].
ВЛИЯНИЕ АНТИГИПЕРТЕНЗИВНОЙ ТЕРАПИИ НА КОГНИТИВНЫЕ ФУНКЦИИ У БОЛЬНЫХ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИЕЙ
Достижение и поддержание целевых уровней АД с помощью адекватно подобранной антигипертензивной терапии (АГТ) способствует сохранности когнитивного статуса и предотвращает деменцию. В настоящее время изучаются несколько классов антигипертензивных препаратов как средств профилактики развития и прогрессирования когнитивных расстройств и оценка их влияния на КФ у пациентов с АГ [20]. По данным наблюдательных, популяционных исследований и метаанализов, АГТ оказывает положительное влияние на состояние КФ, на ее фоне снижается риск развития сосудистой деменции [21, 22]. Также получены данные о снижении частоты встречаемости деменции у пациентов с болезнью Альцгеймера при применении АГТ [23, 24]. Доказано, что адекватно подобранная АГТ способна предотвратить развитие и прогрессирование умеренных (додементных) СКН [21].
Результаты влияния отдельных классов антигипертензивных препаратов на КФ и риск развития деменции довольно противоречивы и требуют дальнейшего изучения. Наиболее перспективным на сегодняшний день считается изучение воздействия на КФ блокаторов ренин-ангиотензин-альдостероновой системы, дигидропиридиновых антагонистов кальция и диуретиков. Также следует отметить, что в современной литературе недостаточно освещен вопрос влияния АГТ на конкретные КФ. Необходимо проведение рандомизированных контролируемых исследований (РКИ), спланированных по всем правилам доказательной медицины, целью которых станет изучение состояния управляющих функций у пациентов с АГ и влияние на них разных классов антигипертензивных средств [20].
ВОЗМОЖНОСТИ НЕЙРОПРОТЕКЦИИ В ТЕРАПИИ СОСУДИСТЫХ КОГНИТИВНЫХ НАРУШЕНИЙ У БОЛЬНЫХ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИЕЙ
С целью коррекции умеренных (додементных) СКН в клинической практике активно и давно используются различные ноотропные, нейрометаболические и нейропротекторные препараты [25]. В последние годы появилось значительное число исследований, посвященных изучению механизма нейропротекции, и препаратов, обладающих нейропротективным эффектом. Под нейропротекцией понимают любую стратегию лечения, которая обеспечивает защиту клеток головного мозга от гибели в результате ишемии, т.е. предотвращает, останавливает или замедляет повреждающие окислительные, биохимические и молекулярные процессы, наблюдающиеся при развитии необратимого ишемического повреждения [26, 27].
У пациентов с АГ развивается эндотелиальная дисфункция, вызывающая церебральную микроангиопатию, что, в свою очередь, формирует ишемический процесс, который приводит к характерным повреждениям белого вещества головного мозга и СКН [28]. При церебральной ишемии развиваются сложные многоступенчатые изменения, в которых значительную роль играет окислительный стресс; это обусловливает важность применения мультимодальных нейроцитопротекторов с антиоксидантным действием [29]. Таким образом, применение нейропротекторов является патогенетически оправданным и абсолютно необходимым направлением в лечении пациентов с АГ. Применение препаратов нейропротекторного ряда у пациентов с АГ целесообразно при значениях по шкале MoCA ниже 26 баллов, а при использовании теста подбора цифр к символам – ниже 45 баллов (символов) за 90 с. Выбор нейропротектора должен в первую очередь основываться на доказательной базе, подтверждающей не только его эффективность в коррекции СКН, но и хорошую переносимость, а также отсутствие нежелательных межлекарственных взаимодействий. Назначение препаратов с мультимодальным механизмом действия исключает полипрагмазию и позволяет положительно влиять на различные звенья патогенеза поражения головного мозга как органа-мишени АГ. Одним из таких лекарственных средств является оригинальный препарат этилметилгидроксипиридина сукцината [30].
ЭТИЛМЕТИЛГИДРОКСИПИРИДИНА СУКЦИНАТ КАК СОВРЕМЕННЫЙ ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ ДЛЯ ЛЕЧЕНИЯ СОСУДИСТЫХ КОГНИТИВНЫХ НАРУШЕНИЙ У ПАЦИЕНТОВ С АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИЕЙ, ОБЛАДАЮЩИЙ ВЫСОКОЙ ЭФФЕКТИВНОСТЬЮ И БЕЗОПАСНОСТЬЮ
Оригинальный (референтный) этилметилгидроксипиридина сукцинат – отечественный препарат, обладающий мощным противоишемическим действием. Он представляет собой уникальную разработку отечественной фармацевтической отрасли. Этилметилгидроксипиридина сукцинат синтезирован в ГУ НИИ фармакологии РАМН в начале 80-х гг. XX в. [31]. Его молекула состоит из двух связанных и функционально значимых соединений – 2-этил-6-метил-3-гидроксипиридина и сукцината, сочетание которых определяет его мультимодальные свойства и широкий спектр фармакологических эффектов. Основные эффекты этилметилгидроксипиридина сукцината — антиоксидантный, антигипоксантный и мембраностабилизирующий. Препарат оказывает ноотропный, антиамнестический, противотревожный и другие клинические эффекты [9, 30–35].
Оригинальный этилметилгидроксипиридина сукцинат неоднократно доказал свою эффективность и высокий профиль безопасности в многочисленных исследованиях, в том числе двойных слепых мультицентровых плацебо-контролируемых (РКИ «ЭПИКА» в 2017 г., РКИ «МЕМО» в 2021 г.), которые имеют высокие уровни достоверности доказательств и убедительности рекомендаций [33, 35].
ЭФФЕКТИВНОСТЬ ЭТИЛМЕТИЛГИДРОКСИПИРИДИНА СУКЦИНАТА В КОРРЕКЦИИ УМЕРЕННЫХ (ДОДЕМЕНТНЫХ) СОСУДИСТЫХ КОГНИТИВНЫХ НАРУШЕНИЙ У ПАЦИЕНТОВ С ХРОНИЧЕСКОЙ ИШЕМИЕЙ МОЗГА
В международное многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование МЕМО (МЕксидол – хроническая ишемия МОзга) были включены 318 пациентов (возраст 40–90 лет) с ССЗ и СКН, имеющие умеренные когнитивные расстройства. Участники исследования были рандомизированы на 2 группы. Основная группа получала длительную последовательную терапию этилметилгидроксипиридина сукцинатом по следующей схеме: инъекционная форма препарата в дозе 500 мг/сут внутривенно капельно в течение 14 дней с дальнейшим переходом на таблетированную форму (ФОРТЕ 250) по 1 таблетке 250 мг 3 раза/сут на фоне базисной терапии в течение 60 дней. Пациенты контрольной группы совместно с базисной терапией получали плацебо по аналогичной схеме. В качестве первичного критерия эффективности было выбрано среднее значение изменения балла по шкале MoCA на этапе завершения пациентом исследования в сравнении с исходным уровнем. К концу периода наблюдения (75-й день) в основной группе отмечалось статистически значимое улучшение и нормализация КФ: +4,22 балла по шкале МоСА с суммарным баллом 26,22, что соответствует норме (в группе плацебо прирост показателей по MoCA составил +2,17 балла, а суммарный балл – 24,17, что соответствует когнитивным нарушениям); +8 баллов по тесту замены цифровых символов (против +5 баллов в контроле, р <0,0001). Полученные результаты свидетельствуют о высокой эффективности последовательной терапии этилметилгидроксипиридина сукцинатом внутривенно + этилметилгидроксипиридина сукцинат ФОРТЕ 250 перорально в коррекции когнитивных нарушений у пациентов с коморбидными ССЗ. Кроме того, в исследовании МЕМО было отмечено статистически значимое снижение уровня тревоги у пациентов основной группы к концу терапии (на 75-й день): -3 балла по шкале Бека против -1 балла в группе плацебо (р <0,0001). Это указывает на дополнительный анксиолитический эффект исследованного препарата. Улучшение КФ и уменьшение выраженности эмоциональных нарушений нарастали постепенно, достигая максимума к концу терапии (т.е. на 75-й день лечения) [35].
СУБАНАЛИЗ ИССЛЕДОВАНИЯ МЕМО В ГРУППАХ ПАЦИЕНТОВ С АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИЕЙ И БЕЗ НЕЕ В АСПЕКТЕ ВЛИЯНИЯ ПРЕПАРАТА НА КОГНИТИВНОЕ ФУНКЦИОНИРОВАНИЕ, ВЫРАЖЕННОСТЬ АСТЕНИЧЕСКИХ, ТРЕВОЖНЫХ, ВЕГЕТАТИВНЫХ, ДВИГАТЕЛЬНЫХ НАРУШЕНИЙ И КАЧЕСТВО ЖИЗНИ НА ФОНЕ ХРОНИЧЕСКОЙ ИШЕМИИ МОЗГА
В рамках субанализа исследования МЕМО пациенты с хронической ишемией мозга (ХИМ) были разделены на 4 подгруппы: 1-я – пациенты с АГ, получавшие последовательную терапию этилметилгидроксипиридина сукцинатом (n=144); 2-я – пациенты с АГ, получавшие плацебо (n=146); 3-я – пациенты без АГ, получавшие последовательную терапию этилметилгидроксипиридина сукцинатом (n=15); 4-я – пациенты без АГ, получавшие плацебо (n=12). В конце периода наблюдения были выявлены статистически значимые различия в динамике баллов по шкале МоСА между группами участников, получавших этилметилгидроксипиридина сукцинат и плацебо (p=0,000), что свидетельствует о превосходящей эффективности применения активного препарата в подгруппе пациентов с АГ. На фоне терапии этилметилгидроксипиридина сукцинатом, в отличие от плацебо, медианное значение балла по шкале МоСА в конце периода наблюдения достигло уровня нормы у всех пациентов. При оценке вторичных конечных точек эффективности статистически значимое преимущество этилметилгидроксипиридина сукцината над плацебо в популяции пациентов с АГ на конечном визите было достигнуто по следующим параметрам: результаты теста подбора цифр к символам, показатели шкалы оценки астении MFI-20, шкалы тревоги Бека, шкалы Тинетти, значение психологического компонента здоровья по опроснику SF-36. При этом был установлен сопоставимый характер профиля безопасности этилметилгидроксипиридина сукцината и плацебо.
Полученные результаты дают основания рекомендовать длительное последовательное применение оригинального препарата этилметилгидроксипиридина сукцината в комплексном лечении пациентов с АГ и ХИМ в качестве эффективного инструмента защиты головного мозга как органа-мишени АГ и средства патогенетически обоснованной терапии когнитивных, эмоциональных, астенических, вегетативных и двигательных нарушений [36]. По результатам исследования и субанализов МЕМО, на фоне последовательной терапии у пациентов с ХИМ, особенно при наличии сопутствующей АГ, статистически значимо улучшаются когнитивные функции, уменьшаются уровень тревожности и степень астении, повышается качество жизни. Вероятно, более выраженный клинический эффект этилметилгидроксипиридина сукцината в подгруппе пациентов с АГ достигается за счет нескольких точек приложения действия препарата: регресса изменений в головном мозге, ассоциированных с АГ, на фоне мультимодальных эффектов препарата, повышения эффективности АГТ и прямой нейропротекции [37].
РЕЗУЛЬТАТЫ СУБАНАЛИЗА ИССЛЕДОВАНИЯ МЕМО У ПАЦИЕНТОВ С ХРОНИЧЕСКОЙ ИШЕМИЕЙ МОЗГА РАЗНЫХ ВОЗРАСТНЫХ ПОПУЛЯЦИЙ, В ТОМ ЧИСЛЕ У БОЛЬНЫХ СТАРЧЕСКОГО ВОЗРАСТА
В субанализ данных исследования МЕМО были включены 318 пациентов (25% мужчин) в возрасте от 40 до 90 (медиана – 60) лет. Эффективность лечения оценивалась в трех возрастных группах: 40–60 (n=163), 61–75 (n=141) и 76–90 (n=13) лет. В качестве первичной конечной точки эффективности рассматривалось увеличение в динамике суммы баллов по шкале MoCA в виде абсолютной разницы между суммой баллов до начала лечения и на 75-й день терапии. В качестве вторичных конечных точек эффективности оценивалась динамика суммы баллов по следующим опросникам и шкалам: тест подбора цифр к символам (DSST), опросник качества жизни SF-36, шкала субъективной оценки астении MFI-20, опросник вегетативных нарушений Вейна, шкала тревоги Бека, шкала двигательной активности Тинетти. Согласно результатам субанализа, положительная динамика выраженности когнитивных, эмоциональных и двигательных нарушений в группах 40–60 и 61–75 лет через 75 дней терапии была выявлена у больных, получавших как этилметилгидроксипиридина сукцинат, так и плацебо, но у пациентов, применявших лекарственный препарат, эти изменения оказались более выраженными. На это указывают более высокие значения медианы абсолютной разницы суммы баллов изучаемых показателей.
Таким образом, результаты исследования показали, что у пациентов с ХИМ через 75 дней терапии на фоне применения этилметилгидроксипиридина сукцината наблюдались значимо более выраженные по сравнению с плацебо улучшение когнитивных и двигательных функций, повышение качества жизни, уменьшение выраженности вегетативных нарушений, астении и тревожности. Полученные данные о клинической эффективности, безопасности и переносимости последовательной терапии этилметилгидроксипиридина сукцинатом позволяют рекомендовать эту схему для лечения СКН, не достигающих выраженности деменции, а также других проявлений ХИМ пациентам различных возрастных групп, в том числе старческого возраста [38].
РЕЗЮМЕ
В своем заключительном слове председатели Совета экспертов подчеркнули актуальность рассмотренных вопросов и плодотворный характер обсуждения. После обсуждения и подведения итогов эксперты сделали следующие заключения.
1. В мире и России АГ остается одной из наиболее актуальных проблем современной медицины. АГ выступает ведущим фактором риска развития сердечно-сосудистых, цереброваскулярных и почечных заболеваний. Головной мозг при этом заболевании – один из органов-мишеней, первыми симптомами поражения которого становятся СКН.
2. Для выявления и оценки выраженности СКН у больных с АГ необходимо проводить нейропсихологическое тестирование пациентов с помощью специализированных шкал и опросников. Ведение и обследование пациентов с АГ осуществляет врач первичного амбулаторного звена.
3. Для профилактики и лечения когнитивных расстройств у большинства пациентов с АГ одной лишь АГТ недостаточно, нужна программа нейропротекции. Ключевое значение для профилактики и замедления прогрессирования, а также коррекции СКН имеет адекватно подобранная АГТ и применение нейропротекторов. Такой подход позволит положительно влиять на различные звенья патогенеза поражения головного мозга как органа-мишени АГ. Применение препаратов нейропротекторного ряда у пациентов с АГ показано при наличии когнитивных жалоб и снижении КФ по результатам тестов.
4. Выбор нейропротектора должен основываться на доказательной базе, подтверждающей не только его эффективность в коррекции СКН, но и хорошую переносимость. Также следует ориентироваться на мультимодальный механизм действия препарата, исключающий возможность полипрагмазии, и отсутствие нежелательных межлекарственных взаимодействий. Одним из таких препаратов является оригинальный этилметилгидроксипиридина сукцинат.
5. Оригинальный (референтный) этилметилгидроксипиридина сукцинат представляет собой уникальную разработку отечественной фармацевтической отрасли. Его молекула состоит из двух связанных и функционально значимых соединений – 2-этил-6-метил-3-гидроксипиридина и сукцината, сочетание которых обусловливает его мультимодальные свойства и широкий спектр фармакологических эффектов. Основные эффекты этилметилгидроксипиридина сукцината – антиоксидантный, антигипоксантный и мембраностабилизирующий. Оригинальный этилметилгидроксипиридина сукцинат неоднократно подтвердил свою эффективность и высокий профиль безопасности в многочисленных исследованиях, в том числе двойных слепых мультицентровых плацебо-контролируемых (РКИ «ЭПИКА» в 2017 г., РКИ «МЕМО» в 2021 г.), которые имеют высокие уровни достоверности доказательств и убедительности рекомендаций.
6. По данным международного многоцентрового рандомизированного двойного слепого плацебо-контролируемого исследования МЕМО, схема последовательной терапии этилметилгидроксипиридина сукцинатом показала высокую эффективность в коррекции умеренных (додементных) СКН, а также способствовала уменьшению выраженности астенических, тревожных, вегетативных, двигательных нарушений и улучшению качества жизни пациентов с АГ и без нее на фоне ХИМ. По результатам субанализа, более выраженный клинический эффект этилметилгидроксипиридина сукцината наблюдался у пациентов с АГ.
7. Оригинальный этилметилгидроксипиридина сукцинат обладает высоким профилем эффективности и безопасности, что позволяет применять его у больных разных возрастных групп, в том числе у пациентов старческого возраста. Рекомендуемая схема последовательной терапии препаратом, по результатам клинических исследований, включая рандомизированные, 200–500 мг/сут внутривенно или внутримышечно в течение 14 дней с переходом на пероральную форму по 250 мг 3 раза/сут в течение 60 дней.
8. Нейропротекция должна служить неотъемлемой частью ведения пациентов с АГ. Рекомендовано дополнить алгоритм медикаментозного лечения пациентов с АГ путем включения этилметилгидроксипиридина сукцината в клинические рекомендации «Артериальная гипертензия у взрослых» (I10/I11/I12/I13/I15, согласно МКБ-10).



