За период с 1990 по 2010 г. распространенность фибрилляции предсердий (ФП) в мире, связанные с ней заболеваемость и смертность, несмотря на все усилия медицинской науки и здравоохранения, увеличились примерно в 2 раза [1]. По данным эпидемиологических исследований, проведенных в Западной Европе, ФП выявляется в общей популяции уже в 2,0—4,7% случаев [2].
Согласно прогнозам, к 2050 г. число больных ФП может возрасти более чем в 2 раза [3]. ФП является одной из главных причин инсульта, хронической сердечной недостаточности (ХСН), даже у больных моложе 65 лет без сопутствующих заболеваний сопровождается повышением смертности в 2 раза по сравнению с населением в целом [4].
В 6 рандомизированных клинических исследованиях у больных ФП (PIAF, AFFIRM, RACE, STAF, HOT CAFÉ, AF CHF) тактика лечения с целью восстановления и поддержания синусового ритма не снижала смертность по сравнению с тактикой урежения частоты желудочковых сокращений при сохранении ФП. Такой результат связан как с недостаточной эффективностью и безопасностью современных антиаритмических препаратов, так и с ограничениями дизайна перечисленных исследований [5]. Между тем даже в них убедительно показано уменьшение симптомов и улучшение качества жизни при тактике поддержания синусового ритма, а также достоверное снижение общей смертности на 47% (p<0,0001) при реальном сохранении нормального синусового ритма в период наблюдения [6].
В целом далекие от желаемых результаты лечения ФП нередко объясняют недостаточным пониманием механизмов ее развития. При этом уже хорошо изучены клеточные и молекулярные механизмы инициации ФП [7]. Применительно к клинической практике особое внимание привлекает концепция прогрессирования ФП от пароксизмальной к постоянной клинической форме.
Пароксизмальная ФП может продолжаться до 7 сут, но отличается самопроизвольным прекращением, обычно в течение первых 48 ч. При пароксизмальной форме ФП, длящейся более 48 ч, вероятность спонтанного прекращения аритмии низкая, однако существенно возрастает риск системных тромбоэмболий, что требует рассмотрения возможности проведения антитромботической терапии. Персистирующая ФП в отличие от пароксизмальной самостоятельно не прекращается, продолжается более 7 сут и для ее устранения необходима медикаментозная или электрическая кардиоверсия. Диагноз длительной персистирующей ФП устанавливают в случае, если ФП продолжается в течение года и более, но выбрана стратегия восстановления синусового ритма и его сохранения с использованием антиаритмических препаратов и/или абляции в левом предсердии. Постоянную форму ФП констатируют в тех случаях, когда пациент и врач считают возможным сохранение аритмии или когда предшествующие попытки кардиоверсии или кардиохирургического лечения оказались безуспешными [8, 9].
В последние годы наибольшее распространение получила антитромботическая терапия ФП, реально изменяющая прогноз у пациентов. Подчеркивается, что риск развития инсульта зависит не от формы ФП (пароксизмальная, персистирующая или постоянная), а от других клинических факторов, суммированных в шкалах оценки риска развития инсульта CHADS2 и более современной CHA2DS2-VASc [8, 9].
Действительно, по данным исследования ACTIVE W, частота развития инсульта у больных пароксизмальной (n=1202, средняя оценка по CHADS2 1,79±1,03 балла) а также персистирующей и постоянной формами ФП (n=5495, средняя оценка по CHADS2 2,04±1,12 балла; р<0,00001) существенно не различалась (р=0,496), в том числе после коррекции с учетом исходных клинических различий (р=0,755) [10]. Можно предполагать, что при пароксизмальной форме ФП имеется более короткий период времени застоя крови в предсердиях при их фибрилляции, но быстрое восстановление механической систолы предсердий способствует дислокации свежих тромбов в артериальную систему. При персистирющей/постоянной форме ФП длительный/непрерывный застой крови в предсердиях создает и постоянные условия для тромбообразования в предсердиях, но длительное/постоянное отсутствие механической систолы предсердий позволяет образовавшимся тромбам организовываться, срастаться со стенкой предсердия и даже рассасывать ся под влиянием фибринолитической системы организма.
Однако в более крупном современном исследовании ARISTOTLE частота развития инсульта или системной эмболии оказалась значительно выше у пациентов с персистирующей или постоянной формой ФП (n=15 412), чем у больных пароксизмальной ФП (n=2786) — 1,52% против 0,98% (р=0,003, с поправкой на исходные клинические различия р=0,015). Наблюдалась также тенденция к более высокой смертности у больных персистирующей или постоянной ФП (3,9% против 2,81%; р=0,0002, с поправкой р=0,066) [11].
К. Imai и соавт. [12] недавно разработана и апробирована шкала оценки риска развития тяжелой сердечной недостаточности III или IV функционального класса по классификации Нью-Йоркской ассоциации сердца у больных неклапанной ФП — ARC2H. Согласно этой шкале, пациент набирает по 1 баллу при возрасте 72 года и старше, частоте сердечных сокращений 80 уд/мин и более, артериальной гипертензии и 2 балла — при ранее установленной сердечной недостаточности. Ежегодный риск развития тяжелой сердечной недостаточности варьировал от 0,8 до 35% у пациентов с оценкой 0 и 4—5 баллов по шкале ARC2H соответственно. В наиболее крупном исследовании AFFIRM по сравнительной оценке тактики восстановления и поддержания синусового ритма с тактикой урежения частоты желудочковых сокращений при сохранении ФП большая длительность ФП была прямо связана с высокой распространенностью симптомов ХСН [13].
Представленные данные подтверждают известное положение [14] о том, что замедление прогрессирования ФП к более продолжительным ее формам может рассматриваться в качестве одной из целей ее терапии, способной обеспечить снижение риска развития тромбоэмболий, сердечной недостаточности и смертности. Современные представления о факторах такого прогрессирования ФП обязательно включают структурное и электрическое ремоделирование предсердий. Устойчивая ФП может вызвать воспалительную реакцию, которая приводит к активации миофибробластов и высвобождению цитокинов, таких как трансформирующий β-фактор роста и фактор роста тромбоцитов, а также профибротических белков. Активация сигнальных каскадов с участием последних играет важнейшую роль в развитии фиброза, приводит к дисфункции ионных каналов, апоптозу кардиомиоцитов и росту внеклеточного матрикса, что способствует как электрическому, так и структурному ремоделированию — основе сохранения ФП [15, 16].
Исследования современных фармакологических средств для лечения основного заболевания с целью предупреждения электрического (блокаторы медленных кальциевых каналов) и структурного ремоделирования — фиброза (блокаторы ренин-ангиотензиновой системы, статины, омега-3 полиненасыщенные жирные кислоты) дали противоречивые, в основном негативные результаты [17, 18]. Несмотря на это одной из задач лечения больных ФП должен быть регресс гипертрофии левого желудочка (ГЛЖ). С помощью многофакторного анализа данных проекта AFFIRM показано, что утолщение стенки левого желудочка (ЛЖ), особенно межжелудочковой перегородки, является независимым предиктором как смерти от всех причин (относительный риск — ОР 1,46 при 95% доверительном интервале — ДИ от 1,14 до 1,86; р=0,003), так и развития инсульта (ОР 1,89 при 95% ДИ от 1,17 до 3,08; р=0,01). Концентрическая ГЛЖ ассоциировалась с самой высокой общей смертностью (ОР 1,53 при 95% ДИ от 1,11 до 2,12; р=0,009) [19]. Известно, что ГЛЖ повышает риск смерти в результате желудочковой тахиаритмии, в том числе спровоцированной антиаритмической терапией.
 По данным регистра Euro Heart Survey [20] и исследования J-RHYTHM II [21], в течение 1 года у 10—15% больных отмечается прогрессирование ФП от пароксизмальной к персистирующей форме. Показано, что прогрессированию к более устойчивым формам ФП способствует пожилой возраст, органическое заболевание сердца, артериальная гипертензия, ФП продолжительностью более 3 мес, тактика урежения частоты желудочковых сокращений, а не восстановления и поддержания синусового ритма, дилатация левого предсердия и ожирение [22].
По данным регистра Euro Heart Survey [20] и исследования J-RHYTHM II [21], в течение 1 года у 10—15% больных отмечается прогрессирование ФП от пароксизмальной к персистирующей форме. Показано, что прогрессированию к более устойчивым формам ФП способствует пожилой возраст, органическое заболевание сердца, артериальная гипертензия, ФП продолжительностью более 3 мес, тактика урежения частоты желудочковых сокращений, а не восстановления и поддержания синусового ритма, дилатация левого предсердия и ожирение [22].
Кроме того, предложена система HATCH, согласно которой больному начисляется оценка 2 балла при наличии сердечной недостаточности и транзиторной ишемической атаки/инсульта в анамнезе, по 1 баллу — за возраст старше 75 лет, артериальную гипертензию, хроническую обструктивную болезнь легких [14]. При общей оценке от 5 до 7 баллов риск прогрессирования ФП от пароксизмальной к персистирующей клинической форме на фоне медикаментозной терапии может достигать 35—50%, а при 0 баллов — около 6%.
Важно отметить, что психологический статус пациентов с ФП ухудшается по мере прогрессирования аритмии. В исследовании A.F. von Eisenhart Rothe и соавт. [23]
после устранения влияния пола, возраста и других значимых факторов большое депрессивное расстройство встречалось на 44% чаще (р=0,007) при персистирующей ФП, чем при пароксизмальной.
Антиаритмические препараты, несмотря на известные их недостатки, остаются единственным широкодоступным средством эффективного подавления ФП, т.е. реализации тактики поддержания синусового ритма. Способны ли они замедлять прогрессирование этой аритмии к постоянной форме? У пациентов с ФП при поддержании синусового ритма уменьшается размер левого предсердия и улучшается систолическая функция ЛЖ, причем оба эти показателя являются важными факторами, связанными с прогрессированием ФП [24]. Однако в исследовании С.B. de Vos и соавт. [25] только антиаритмические препараты IС класса достоверно (р=0,0013) замедляли прогрессирование ФП в течение 1 года наблюдения.
Наиболее опасным, хотя и редким побочным эффектом применения препаратов I класса является желудочковая тахиаритмия. Ее предвестником служит расширение комплекса QRS на электрокардиограмме. В исследовании AFFIRM, в котором для поддержания синусового ритма разрешалось использовать препараты IА (дизопирамид, прокаинамид, хинидин) и IС класса (морицизин, пропафенон, флекаинид) продолжительность комплекса QRS 120 мс и более ассоциировалась с существенным (ОР 1,61 при 95% ДИ от 1,29 до 2,03; р<0,001) повышением риска смерти (от всех причин, сердечно-сосудистой и от аритмии) и госпитализации (ОР 1,14 при 95% ДИ от 1,07 до 1,34; р=0,043). Повышение смертности (р=0,03) наблюдалось также у больных с продолжительностью комплекса QRS 90—119 мс и сопутствующей сердечной недостаточностью [26].
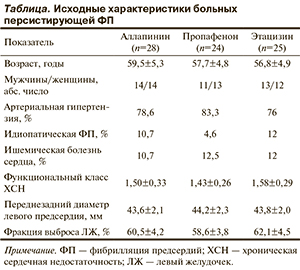
Эти недавно опубликованные данные требуют учета при выборе между доступными в России антиаритмическими препаратми IC класса аллапинином, пропафеноном и этацизином. При их применении в обычных дозах аллапинин в наименьшей степени расширяет комплекс QRS, что обеспечивает наибольшую безопасность терапии, но, по меньшей мере, не уступает пропафенону и этацизину в эффективности. Согласно полученным нами данным, в сопоставимых группах пациентов с высокосимптоматичной персистирующей ФП (см. таблицу) аллапинин в дозе 67±12 мг/сут вызывал расширение комплекса QRS в среднем на 14%, пропафенон в дозе 385±44 мг/сут — на 19%, а этацизин в дозе 126±20 мг/сут — на 23%. Частота сохранения синусового ритма через 12 мес наблюдения составляла 64, 38 и 44% соответственно. Среднее число кардиоверсий (амиодарон внутрь и/или внутривенно) в группах лечения аллапинином, пропафеноном или этацизином за этот период существенно не различалась — 5,4±2,6, 4,8±3,0 и 5,5±3,3 соответственно.
Для предупреждения такого побочного эффекта антиаритмических препаратов IC класса, как трепетание предсердий с высокой частотой проведения импульсов к желудочкам, достижения высокой противорецидивной активности терапии в отношении ФП даже при снижении доз лекарственных средств целесообразно принимать их в сочетании с соталолом или амиодароном [27]. Согласно последним данным регистра PREFER [28], в 461 центре 7 стран Европы наиболее часто для поддержания синусового ритма больным ФП назначается амиодарон (24,1%), реже — флекаинид или пропафенон (13,5%), соталол (5,5%), дронедарон — всего в 4% случаев. Подобную статистику по 9 странам Европы представили и авторы программы EORP-AF [29]. Перед началом лечения амиодароном и через каждые 6—12 мес терапии требуется контроль состояния легких, печени и щитовидной железы. Регистр ORBIT-AF в США [30] показал, что среди 10 061 пациента с ФП большинство (чаще лица пожилого возраста с артериальной гипертензией, ХСН, перенесенным инсультом, мало выраженными симптомами аритмии) получали терапию, урежающую частоту желудочковых сокращений. Разумеется, такая тактика лечения не обеспечивает обратного развития ремоделирования сердца.
В настоящее время в исследование EAST с целью профилактики инсульта и других неблагоприятных событий путем раннего проведения терапии, сохраняющей синусовый ритм, включаются больные с недавно возникшей ФП, с оценкой по шкале CHA2DS2-VASc 2 балла и более [31]. Предполагается, что тактика сохранения синусового ритма, начиная с ранних сроков от выявления ФП, позволит сохранить структуру и функцию предсердий более эффективно, чем стандартный принцип лечения (переход к тактике восстановления и поддержания синусового ритма в случае сохранения симптомов при эффективном урежении желудочковых сокращений на фоне ФП). В проекте EAST предусмотрено не только назначение медикаментозной антиаритмической терапии ФП, но и проведение катетерной абляции в левом предсердии.
Недавно опубликованы результаты первого многоцентрового проспективного рандомизированного исследования SARA 146 больных персистирующей ФП, в котором установлено превосходство катетерной абляции в поддержании синусового ритма по сравнению с лекарственной антиаритмической терапией. С 3-го по 12-й месяц после начала терапии не регистрировалось эпизодов ФП или трепетания предсердий продолжительностью более 24 ч у 70,4% пациентов, перенесших абляцию, и 43,7%, получавших антиаритмические препараты IC или III класса (р=0,002) [32].
После катетерной изоляции легочных вен у больных ФП отмечается обратное развитие дилатации и ремоделирования левого предсердия [33]. В результате восстановления и поддержания синусового ритма значительно повышается исходно сниженная фракция выброса ЛЖ, улучшаются переносимость физической нагрузки и качество жизни по сравнению с таковыми в случае использования тактики урежения частоты желудочковых сокращений при сохранении ФП [34, 35].
Несмотря на эти позитивные данные, прямо указывающие на предпочтительность тактики контроля синусового ритма, сама катетерная абляция левого предсердия как средство ее реализации требует дальнейших исследований [36]. По-прежнему внимательно изучается и оценивается частота таких непосредственных осложнений этой инвазивной процедуры, как экссудативный перикардит, тампонада сердца, стеноз легочной вены, язва или перфорация пищевода с образованием предсердно-пищеводного свища, инсульт/транзиторная ишемическая атака, травма диафрагмального нерва, артериовенозная фистула в месте прокола на бедре [37]. Не опровергнуты предположения о возможном ухудшении функции предсердия через годы после проведения абляции. Продолжающиеся крупные проекты CABANA и EAST в будущем помогут ответить на остающиеся вопросы, в том числе об отдаленной эффективности катетерной абляции и влиянии основного заболевания на результаты лечения.
Лечение, предполагающее урежение частоты желудочковых сокращений, сопровождается более быстрым прогрессированием ФП к персистирующей и постоянной ее клинической форме вследствие нарастающих морфологических изменений в предсердиях, которые способствуют сохранению аритмии [38]. Следовательно, для относительно молодых пациентов и/или имеющих выраженные симптомы ФП, тактика восстановления и сохранения синусового ритма является предпочтительной. Индивидуально подобранная антиаритмическая лекарственная терапия не противоречит современной идее продвижения к персонализированному лечению больных ФП [39].



