В последние годы в Российской Федерации значительно увеличилось число пациентов, перенесших операцию коронарного шунтирования (КШ). Между тем хирургическая реваскуляризация миокарда не останавливает непрерывно прогрессирующего течения ишемической болезни сердца (ИБС). У больного сохраняется вероятность рецидива ИБС по причине несостоятельности шунтов и неполной реваскуляризации в первые 5 лет после КШ, прогрессирования атеросклеротических изменений в нативных нешунтированных коронарных артериях и/или появления стенозирующих поражений в сформированных шунтах в отдаленные сроки [1, 2]. По данным литературы, через 15 лет после КШ клинические признаки ИБС выявляются у 62% больных, инфаркт миокарда (ИМ) развивается у 36%, повторное КШ или чрескожные коронарные вмешательства переносят 28% пациентов [3—5]. Возобновление клинических проявлений ИБС после успешно проведенной операции в большинстве случаев ассоциируется с изменениями венозных шунтов. Около 10% шунтов из большой подкожной вены подвергается окклюзии в первый месяц после операции, 10% — в первый год, еще 25% — в последующие 6 лет. Через 10 лет после операции только около 45% аутовенозных шунтов остаются проходимыми [6]. Характерная динамика патологических процессов в венозных шунтах после операции послужила основой для формирования понятия «болезнь венозного шунта». Это состояние включает три взаимосвязанных процесса: тромбоз, гиперплазию интимы («артериализацию») и атеросклеротическое поражение шунта. Они имеют очерченные временны'е рамки и представляют собой последовательную эволюцию изменений в венозном шунте после выполнения операции [7]. Выявление предикторов раннего и отдаленного стеноза шунтов и нативных коронарных артерий представляется чрезвычайно актуальной задачей в связи с высокими рисками повторной реваскуляризации миокарда.
Артериальная гипертензия (АГ) — общеизвестный фактор риска (ФР) возникновения и прогрессирования коронарного атеросклероза. По данным российского проспективного наблюдения у больных ИБС, ассоциированной с АГ, при эффективном контроле артериального давления (АД) в отличие от пациентов с неэффективным контролем АД через 3—5 лет после КШ реже диагностировался рецидив стенокардии, отмечалась более высокая толерантность к физической нагрузке, в меньшей степени были выражены процессы патологического ремоделирования левого желудочка, достоверно реже отмечалось прогрессирование коронарного атеросклероза и стеноз шунтов [8]. У больных АГ по сравнению с пациентами без АГ наблюдается более выраженное утолщение стенок в венозных шунтах после КШ [9]. В одном из недавно опубликованных регистров больных ИБС, подвергшихся повторной реваскуляризации после КШ, показано, что АГ является наиболее значимым предиктором подобного вмешательства (табл. 1) [10].
Коррекция АГ у больных ИБС после КШ является стратегической задачей предупреждения клинического рецидива заболевания и снижения риска повторной реваскуляризации. Особое место среди антигипертензивных препаратов у больных ИБС, в том числе после реваскуляризации миокарда, занимают β-адреноблокаторы, ингибиторы ангиотензинпревращающего фермента (АПФ) и блокаторы медленных кальциевых каналов (БКК).
 Ведущие позиции β-адреноблокаторов в ряду антигипертензивных препаратов очевидны, особенно у больных сочетанной АГ и ИБС. В настоящее время накапливается все больше данных, свидетельствующих о необходимости более широкого применения ингибиторов АПФ у пациентов ИБС после КШ, включая больных с сохраненной сократительной способностью миокарда [11]. Положительные эффекты ингибиторов АПФ у больных после КШ связывают, в том числе с их потенциальной способностью предупреждать вазоконстрикцию, прогрессирование атеросклероза в нативных сосудах, а также ограничивать гиперплазию интимы шунтов и усиливать ангиогенез [12]. Известно, что ангиотензин II (АТII) присутствует в местах атеросклеротического повреждения, в том числе в макрофагах атеросклеротических бляшек. Он является одним из важнейших модуляторов пролиферации клеток. Хирургическая реваскуляризация миокарда приводит к непривычному повышению давления на стенки венозных шунтов, которое вызывает феномен up-регуляции пролиферативного эффекта АТII, что сопровождается увеличением восприимчивости сосудистой стенки к факторам роста и гиперплазией интимы. Рекомендации Европейского общества кардиологов (2014) определяют необходимость длительного применения ингибиторов АПФ после КШ у больных АГ, сахарным диабетом (СД), сердечной недостаточностью с клиническими проявлениями, дисфункцией левого желудочка и при наличии высокого риска развития сердечно-сосудистых осложнений [6]. Последнее предполагает назначение препаратов этой группы практически всем пациентам после хирургической реваскуляризации миокарда.
Ведущие позиции β-адреноблокаторов в ряду антигипертензивных препаратов очевидны, особенно у больных сочетанной АГ и ИБС. В настоящее время накапливается все больше данных, свидетельствующих о необходимости более широкого применения ингибиторов АПФ у пациентов ИБС после КШ, включая больных с сохраненной сократительной способностью миокарда [11]. Положительные эффекты ингибиторов АПФ у больных после КШ связывают, в том числе с их потенциальной способностью предупреждать вазоконстрикцию, прогрессирование атеросклероза в нативных сосудах, а также ограничивать гиперплазию интимы шунтов и усиливать ангиогенез [12]. Известно, что ангиотензин II (АТII) присутствует в местах атеросклеротического повреждения, в том числе в макрофагах атеросклеротических бляшек. Он является одним из важнейших модуляторов пролиферации клеток. Хирургическая реваскуляризация миокарда приводит к непривычному повышению давления на стенки венозных шунтов, которое вызывает феномен up-регуляции пролиферативного эффекта АТII, что сопровождается увеличением восприимчивости сосудистой стенки к факторам роста и гиперплазией интимы. Рекомендации Европейского общества кардиологов (2014) определяют необходимость длительного применения ингибиторов АПФ после КШ у больных АГ, сахарным диабетом (СД), сердечной недостаточностью с клиническими проявлениями, дисфункцией левого желудочка и при наличии высокого риска развития сердечно-сосудистых осложнений [6]. Последнее предполагает назначение препаратов этой группы практически всем пациентам после хирургической реваскуляризации миокарда.
БКК являются основными средствами лечения больных ИБС. Помимо антиангинального и антиишемического действия предполагается целый ряд позитивных эффектов препаратов этой группы у больных после КШ. Так, в исследовании PREVENT амлодипин сравнивали с плацебо по возможности влияния на замедление и обратное развитие атеросклеротического поражения коронарных и сонных артерий [13]. Амлодипин не предотвращал прогрессирования атеросклеротических бляшек в коронарных артериях, но значительно замедлял увеличение толщины интимы—медии в области общей сонной артерии. Расхождения в выраженности влияния амлодипина на атеросклеротическое поражение различных участков сосудистого русла объясняют различиями в чувствительности двухмерной ультрасонографии и коронарной ангиографии в отношении выявления ранних атеросклеротических изменений в артериях. Результаты этого исследования подтвердили существующие экспериментальные данные об антиатерогенных эффектах амлодипина. Применение БКК является основным методом профилактики спазма лучевой артерии в случае ее применения при аутоартериальном КШ. Мета-анализ 41 рандомизированного клинического исследования с применением БКК у 3327 пациентов, которым проводилось КШ, показал снижение риска развития периоперационного ИМ на 42% (р=0,02). Кроме того, на фоне приема БКК наблюдалась тенденция к снижению смертности во время КШ [14].
Согласно последним рекомендациями Европейского общества кардиологов (2014 г.), целевой уровень АД у пациентов после реваскуляризации миокарда составляет менее 140/90 мм рт.ст. (при наличии CД менее 140/85 мм рт.ст.) [6]. Антигипертензивная терапия (АГТ), как правило, начинается с небольших доз одного препарата с последующим их увеличением при недостаточном эффекте и добавлением второго или третьего препаратов для максимально эффективного снижения АД. В ряде крупных клинических исследований (SHEP, MAPHY, STOP, COOPE, НОТ) было показано, что для достижения целевого уровня АД 45—93% пациентам с АГ требовалось применение комбинации 2 антигипертензивных препаратов и более. Поэтому взгляд на больного АГ с позиций стратификации риска чаще всего предполагает отказ от последовательной монотерапии до выбора эффективного и хорошо переносимого средства и назначение комбинации антигипертензивных средств. Следует подчеркнуть, что назначение рациональной комбинации антигипертензивных препаратов может осуществляться либо в произвольном виде (такой подход дает возможность маневра при подборе доз и кратности приема препаратов), либо путем применения лекарственных форм с фиксированными дозами. Назначение последних помимо гипотензивного эффекта обеспечивает простой и удобный режим дозирования, что способствует повышению приверженности больных лечению. Теоретические предпосылки целесообразности совместного применения ингибиторов АПФ и БКК при АГ у больных ИБС очевидны и находят практическое отражение в широком применении многочисленных, зарегистрированных в Российской Федерации фиксированных комбинаций указанных групп препаратов.
В последние годы возрастает интерес к обсервационным наблюдениям — регистрам и другим электронным базам как способу получения объективной информации для оптимального использования рекомендаций в повседневной врачебной деятельности [15]. Создание регистров больных, подвергающихся хирургической реваскуляризации миокарда в Российской Федерации, перспективно с позиций получения информации о пациентах, направляемых на операцию КШ в клинической практике.
Целью настоящего исследования явилось изучение на основании анализа регистра больных ИБС, направляемых для планового КШ в 3 регионах Российской Федерации (регистр РИКОШЕТ), распространенности АГ и проводимой АГТ, а также оценка эффективности фиксированной комбинации ингибитора АПФ и БКК.
Материал и методы
Материалом послужили данные историй болезни больных стабильной ИБС, последовательно госпитализированных для плановых операций КШ в кардиохирургические отделения 3 регионов Российской Федерации (Санкт-Петербург, Оренбургская и Самарская области) с 12 января по 30 октября 2012 г. (регистр РИКОШЕТ — РегИстр больных, перенесших операцию КОронарного Шунтирования при ишЕмической болезни сердца сТабильного течения). Исследование было запланировано в 2 направлениях: ретроспективное и проспективное, наблюдательное, когортное. Его дизайн разрабатывался с учетом основных принципов создания регистров.
В исследование не включали пациентов, перенесших ИМ или эпизод нестабильной стенокардии давностью менее 6 мес, проживавших в других регионах, пациентов, истории болезни которых отсутствовали в архиве, а также пациентов, которым выполнялось экстренное КШ. Предварительно для участия в исследовании по журналам регистрации были отобраны 300 пациентов (по 100 в каждом регионе), каждому из которых был присвоен уникальный порядковый номер. Данные из историй болезни и полученные при последующем наблюдении заносились в специально разработанную для исследования базу данных «Регистр больных со стабильной ИБС, перенесших коронарное шунтирование». Повторные «визиты» через 12 мес осуществляли в большинстве случаев с помощью телефонного интервью пациента, в ряде случаев осуществлялся очный визит. При невозможности установления телефонного контакта с пациентом или его родственниками по адресу регистрации направлялось письмо с уведомлением о вручении и запрашивались материалы из органов ЗАГС для выявления умерших больных. В результате работы удалось установить судьбу 299 больных; таким образом, отклик составил практически 100%. В случае смерти больного причины смерти устанавливались на основании информации, полученной у родственников. В окончательном виде в регистр включены 299 больных стабильной ИБС — 236 мужчин и 63 женщины. Средний возраст больных составлял 59,7±6,5 года (минимальный — 32, максимальный — 77 лет). Анализ основных результатов регистра был представлен нами ранее [16].
Для изучения эффективности фиксированной комбинации ингибитора АПФ и БКК дополнительно на базе ФГБУ «Северо-Западный федеральный медицинский исследовательский центр» было проведено открытое контролируемое исследование препарата экватор («Gedeon Richter», Венгрия) — комбинированного средства с вариантами фиксированных доз амлодипина (5—10 мг) и лизиноприла (10—20 мг). Включены 30 больных АГ 1—2-й степени, относящихся к категории «очень высокого» риска развития сердечно-сосудистых осложнений (как имеющие установленное сердечно-сосудистое заболевание в виде ИБС) согласно классификации рекомендованной ESH/ESC (2013) [17]. Средний возраст больных основной группы составил 57,65±1,59 года, длительность АГ — 10,55±1,99 года. Не включались в исследование больные с текущим ИМ, острым нарушением мозгового кровообращения, нарушениями функции почек и печени, сердечной недостаточностью II—IV функционального класса (по классификации NYHA) и дисфункцией левого желудочка (фракция выброса менее 40%), CД 1-го типа, наличием в анамнезе указаний на непереносимость ингибиторов АПФ.
В качестве контрольной группы в анализ были включены 30 больных АГ 1—2-й степени, также последовательно включенных в регистр РИКОШЕТ, ранее получавших в качестве АГТ какие-либо ингибиторы АПФ и БКК и которым при выписке было рекомендовано продолжение соответствующей АГТ. Статистически значимых различий по возрасту, длительности ИБС, тяжести стенокардии, перенесенным сосудисто-мозговым осложнениям, наличию СД, статусу курения, показателям липидного состава крови, данным коронарографии между группами больных на момент операции выявлено не было.
У всех пациентов основной группы перед КШ выполнялось полное обследование в соответствии принятыми в учреждении протоколами подготовки к операции. Оценивались исходная тяжесть АГ, проводимая АГТ, подтверждалась возможность проведения выбранной комбинированной терапии препаратом экватор. Препарат назначался в минимальной фиксированной дозировке (5 мг амлодипина и 10 мг лизиноприла) за 12—21 день до проведения КШ. После выполнения операции на 8—17-й день пребывания в стационаре или при контрольном осмотре через 6 мес при необходимости применялась дозировка экватора с повышенным содержанием комбинируемых компонентов. Препарат выдавался бесплатно. Лечение проводилось в течение 12 мес, по окончании этого периода оценивался гипотензивный эффект препарата, развитие рецидива стенокардии и острых коронарных эпизодов. Проводился общеклинический осмотр, при необходимости — нагрузочная эхокардиография, анализировались биохимические показатели.
Оценка антигипертензивной эффективности осуществлялась по следующим параметрам:
- снижение от исходного уровня к концу наблюдения систолического АД (САД) и диастолического АД (ДАД);
- доля пациентов, ответивших на лечение (снижение ДАД как минимум на 5 мм рт.ст. или САД – на 10 мм рт.ст.);
- доля пациентов, достигших целевого уровня АД (<140/90 мм рт.ст., при СД — <140/85 мм рт.ст.), определенного для больных после реваскуляризации миокарда [6];
- доля пациентов, достигших нормального уровня АД (<130/85 мм рт.ст.) [17].
Приверженность больных медикаментозному лечению оценивалась в ходе устного опроса больных через 6 (основная группа) и 12 мес (основная и контрольная группы), анализа соответствия принимаемой терапии врачебным назначениям и расчета комплаентности: как полное (точное) соблюдение рекомендаций расценивались случаи регулярного и непрерывного приема пациентом назначенной врачом дозы соответствующего препарата в течение 85% времени отчетного периода.
Результаты исследования анализировались с помощью компьютерного программного обеспечения Statistica v. 6.0. Для каждого непрерывного количественного признака приводились среднее, стандартное отклонение, медиана, минимальное и максимальное значения. Для оценки достоверности отличий между показателями использовали критерий Стьюдента. Статистически значимыми признавались различия при р<0,05.
Результаты и обсуждение
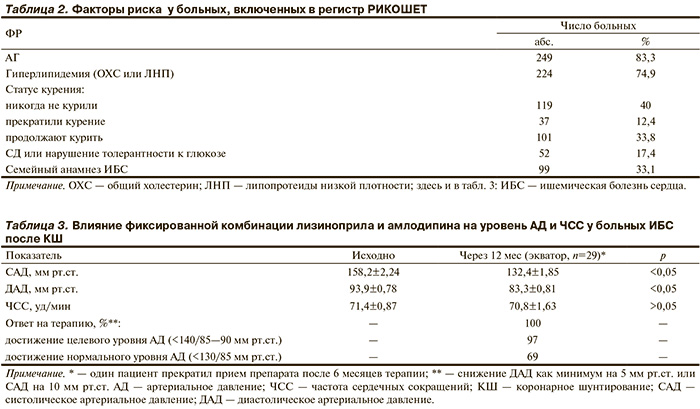
Данные, полученные в ходе настоящего регистра, позволили установить, что среди ФР у больных ИБС, направляемых на КШ, наибольшую распространенность имеет АГ — 83,3%. Кроме АГ у 74,9% больных имелись дислипидемия, у 33,1% — отягощенная по ИБС наследственность, у 45,5% — поражение брахицефальных артерий и артерий нижних конечностей, у 13% — сопутствующая патология дыхательной системы, у 17 % — СД; 1/3 пациентов курили на момент госпитализации (табл. 2). В целом полученные результаты соответствуют данным о распространенности ФР развития атеротромботических заболеваний, полученным в других исследованиях. Так, анализ данных о российской популяции в известном регистре REACH [18] также показал, что среди ФР наиболее частым была АГ (82,2%). Гиперхолестеринемия встречалась в 52,5% случаев, проявления атеротромботического поражения более чем в одном сосудистом бассейне — в 21% случаев, распространенность СД отмечалась реже, чем во всем регистре (18,8% против 44,3%). Ситуация с курением в нашей стране характеризовалась как крайне неблагоприятная: 24,9% больных курили на момент включения в регистр.

За годы, прошедшие со времени проведения регистра REACH (2006), распространенность ФР среди пациентов, подвергавшихся операциям КШ в 2012 г., не изменилась, что свидетельствует о необходимости совершенствования мероприятий по их снижению во всех регионах.
При оценке эффективности медикаментозной терапии у пациентов регистра в целом оказалось, что перед КШ лекарственные препараты в соответствии с современными рекомендациями принимали 257 (86%) больных, при этом регулярно — только 137 (58%). До реваскуляризации миокарда 251 (84%) больной принимал ацетилсалициловую кислоту, БКК — 234 (78%), ингибиторы АПФ — 204 (68%), блокаторы рецепторов к ангиотензину II — 16 (5%), статины — 196 (65%). Через 12 мес после КШ число пациентов, регулярно принимающих рекомендованные препараты, достигло 76%. Ацетилсалициловую кислоту принимали 87,5% больных, клопидогрел — 14%, БКК — 80,5%, ингибиторы АПФ или блокаторы рецепторов к ангиотензину II — 56%, статины — 82%, диуретики — 7,5%, блокаторы минералкортикоидных рецепторов — 7%, варфарин — 3%.
При изучении антигипертензивной эффективности экватора оказалось, в контрольной группе пациентов среди БКК в большинстве случаев назначали дигидропиридиновые производные (амлодипин, нифедипин) для предотвращения возможных негативных взаимодействий с β-адреноблокаторами. Среди ингибиторов АПФ преимущественно применяли эналаприл или периндоприл. Пациенты основной группы начинали принимать экватор на этапе подготовки к операции КШ. Анализ применения препарата показал отсутствие негативного влияния в отношении периоперационных осложнений, связанных с хирургической реваскуляризацией миокарда.
В табл. 3 представлены основные результаты применения фиксированной комбинации лизиноприла и амлодипина в течение 12 мес наблюдения.
Отмечено статистически значимое снижение САД и ДАД через 12 мес терапии фиксированной комбинацией лизиноприла и амлодипина. Повышение дозы препарата перед выпиской больного из стационара после КШ и через 6 мес наблюдения потребовалось у 8 пациентов; 5 пациентов перешли на прием фиксированной комбинации амлодипин 5 мг + лизиноприл 20 мг, 3 — на амлодипин 10 мг +лизиноприл 20 мг. В дополнение к повышенной дозе экватора 4 пациента принимали гидрохлоротиазид. Среднее снижение САД составило 25,8 мм рт.ст., снижение ДАД — 10,5 мм рт.ст. ЧСС в процессе лечения статистически значимо не изменилось в обеих группах больных. Следует подчеркнуть, что большинство пациентов принимали β-адреноблокаторы.
Пациенты и врачи одинаково высоко оценили эффективность фиксированной комбинации лизиноприла и амлодипина в составе комбинированной терапии. За весь период наблюдения отмечены следующие побочные явления: головная боль (у 1 пациента), головокружение у 1 пациента на фоне избыточного снижения АД (пациент вернулся к приему минимальной фиксированной комбинации). Кашель (не требующий отмены препарата) был зарегистрирован у 1 пациента, еще 1 пациент связывал с приемом экватора усталость. Этот пациент прекратил прием препарата после 6 месяцев терапии. Динамика лабораторных показателей на фоне применения фиксированной комбинации лизиноприла и амлодипина представлена в табл. 4.
Как видно из представленных данных существенных отклонений от нормы по анализируемым показателям в ходе лечения экватором не произошло.
Целевое АД в ходе 12-месячного наблюдения достигнуто у 28 (97%) больных основной группы, что в 1,5 раза больше, чем в контрольной, — 17 (57%) больных, нормализация АД достигнута у 20 (69%) больных основной группы и у 13 (43%) контрольной. При этом приверженность медикаментозной терапии (всех рекомендованных к приему препаратов) больных основной группы оставалась на высоком уровне (97—93%) во время контрольных визитов после 6 и 12 месяцев, в то время как в контрольной группе составила 80% к концу 1-го года после КШ. Очевидна связь между приверженностью пациентов рекомендованной терапии и достижением заданных параметров АД. С одной стороны, дизайн исследования предполагал большую кратность посещения кардиолога пациентами основной группы (4 визита), с другой стороны, исследуемый препарат экватор пациенты получали бесплатно. Эти два обстоятельства, безусловно, явились решающими факторами повышения степени приверженности больных назначаемой терапии в целом. При этом следует добавить, что для больных, имеющих заболевания с длительным сроком лечения, особенно при состояниях, не сопровождающихся существенной субъективной симптоматикой, в том числе болевым синдромом (это в полной мере можно отнести к пациентам после КШ), характерна низкая приверженность выполнению рекомендаций [19].
Основные клинические исходы у пациентов, перенесших КШ через 12 месяцев наблюдения, представлены в табл. 5.
Приведенные данные свидетельствуют о благоприятном влиянии реваскуляризации миокарда на течение ИБС в виде низких показателей смертности, частоты развития ИМ и инсульта. Вместе с тем нельзя не отметить частые рецидивы стенокардии после КШ как в контрольной группе пациентов, так и в целом по регистру РИКОШЕТ. Подобные результаты можно объяснить особенностями дизайна исследования в этих группах. Контроль статуса и сердечно-сосудистых осложнений у пациентов осуществлялся преимущественно на основании телефонного опроса, а это применительно к рецидиву стенокардии, очевидно, недостаточно и требует безусловной объективизации. В отличие от этих двух групп у пациентов основной группы с применением экватора проводились повторные очные визиты и при необходимости преходящая ишемия миокарда подтверждалась в ходе проведения нагрузочной эхокардиографии. В любом случае тяжесть синдрома стенокардии не превышала II функционального класса.
Таким образом, результаты проведенного исследования показали высокую антигипертензивную эффективность и хорошую переносимость экватора в составе комплексной терапии больных ИБС и АГ 1—2-й степени тяжести при КШ и в течение 12 мес наблюдения после хирургической реваскуляризации. Применение и доступность фиксированных комбинаций лекарственных препаратов у больных после КШ, активное наблюдение за пациентами в рамках программ комплексной кардиологической реабилитации перспективно с позиций повышения приверженности пациентов лечению и улучшения исходов реваскуляризации миокарда.
Выводы
Артериальная гипертензия является одним из наиболее распространенных факторов риска у больных ишемической болезнью сердца, направляемых на хирургическую реваскуляризацию миокарда.
Несмотря на то что польза от мероприятий по контролю артериальной гипертензии у больных ишемической болезнью сердца после коронарного шунтирования доказана, приверженность больных выполнению рекомендаций по коррекции артериальной гипертензии недостаточна.
При использовании фиксированной комбинации лизиноприла и амлодипина (экватора) у 30 больных ишемической болезнью сердца после коронарного шунтирования отмечалась высокая антигипертензивная эффективность и безопасность препарата. Практически у всех пациентов удалось достигнуть ответа на терапию и целевого уровня артериального давления в соответствии с заданными критериями. У большинства больных произошла нормализация уровня артериального давления.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов. Работа в рамках регистра РИКОШЕТ выполнена при поддержке Министерства здравоохранения РФ.



