Ревматоидный артрит (РА) – иммуновоспалительное (аутоиммунное) ревматическое заболевание неизвестной этиологии, характеризующееся хроническим эрозивным артритом (синовитом) и системным поражением внутренних органов, приводящее к ранней инвалидности и сокращению продолжительности жизни пациентов [1, 2]. В последние годы для лечения РА разработан (и продолжает разрабатываться) широкий спектр инновационных генно-инженерных биологических препаратов (ГИБП) – моноклональных антител и рекомбинантных белков, блокирующих активность «провоспалительных» цитокинов и/или патологическую активацию Т- и В-лимфоцитов, участвующих в развитии иммуновоспалительного процесса при этом заболевании [3, 4] (табл. 1). Применение ГИБП не только позволило существенно улучшить прогноз, но и расширило представления о патогенетических механизмах, лежащих в основе развития и прогрессирования РА [4].
Однако кардинальное улучшение прогноза зависит не только от внедрения инновационных лекарственных средств, но и от совершенствования стратегии фармакотерапии РА, базирующейся на использовании стандартных базисных противовоспалительных препаратов (БПВП), в первую очередь метотрексата (МТ) и глюкокортикоидов (ГК), которые широко применяются в ревматологии в течение многих лет [2, 5].
Современная стратегия ведения пациентов с РА сформулирована в рамках концепции «Лечение до достижения цели» («Treat To Target»), разработанной группой экспертов EULAR (The European League Against Rheumatism) [6–8], и поддержана многими национальными ревматологическими ассоциациями, в том числе Американской коллегией ревматологов (American College of Rheumatology – ACR) [9] и Общероссийской общественной организацией «Ассоциация ревматологов России» (АРР) [10, 11]. Эта стратегия базируется на ранней диагностике РА, определяющей возможность инициации активной тщательно контролируемой (tight control) противовоспалительной терапии в дебюте болезни («окно возможностей») [6, 12].
Особый интерес представляют новые рекомендации EULAR, касающиеся стратегии и тактики лечения раннего артрита, который потенциально может трансформироваться в достоверный РА, являясь первым проявлением широкого круга ревматических заболеваний, «самолимитирующим» артритом или артритом, в течение длительного времени остающимся недифференцированным (НДА) [13]. Именно ревматологи – специалисты, которые должны оказывать первичную медицинскую помощь пациентам с ранним артритом, поскольку исходы у пациентов, наблюдающихся у ревматологов, лучше, чем у врачей общей практики. Достоверный диагноз пациентам с ранним артритом может быть поставлен только после тщательного обследования, которое должно быть подкреплено анамнестическими данными, осмотром, лабораторными и инструментальными исследованиями:
- анамнез (семейный анамнез по РА);
- общий осмотр (утренняя скованность, число болезненных и припухших суставов, выявление внесуставных проявлений);
- общий анализ крови (СОЭ);
- общий анализ мочи;
- ревматоидный фактор (РФ);
- антитела к цитруллинированным белкам (АЦБ);
- С-реактивный белок;
- биохимическое исследование крови;
- микробиологическое исследование;
- С3 и С4 компоненты комплемента;
- иммуноглобулины (IgG, IgA, IgM);
- специальное серологическое исследование (антинуклеарный фактор, при показаниях антиядерные антитела);
- HLA-B27;
- исследование функции щитовидной железы;
- рентгенологическое исследование легких;
- рентгенологическое исследование кистей и стоп;
- магнитно-резонансная томография (МРТ) суставов (включая крестцово-подвздошные сочленения и позвоночник);
- ультразвуковое исследование (УЗИ) периферических суставов.
Пациент с артритом, который рассматривается как отек любого сустава в сочетании с болями и скованностью (более 30 мин), должен быть направлен на консультацию к ревматологу в течение не более 6 нед от момента появления указанных симптомов. Эта рекомендация подкрепляется данными многочисленных исследований, свидетельствующих о том, что задержка с направлением к ревматологу является одной из причин поздней постановки диагноза и назначения неадекватной терапии.
Клиническое обследование является методом выбора для выявления артрита и может быть подтверждено данными УЗИ и/или МРТ. Однако хотя УЗИ и МРТ характеризуются более высокой чувствительностью в отношении выявления синовита мелких суставов кистей и коленного сустава, чем клиническое обследование, следует принимать во внимание низкую специфичность выявляемых с их помощью изменений в отношении диагностики РА и дифференциальной диагностики при раннем РА. Следует исключить другие заболевания, которые могут протекать со сходной суставной симптоматикой, к которым относятся [14]:
- остеоартрит;
- спондилоартриты (реактивный, псориатический артрит, анкилозирующий спондилит, недифференцированный спондилоартрит);
- микрокристаллические артриты;
- заболевания соединительной ткани (системная красная волчанка, системная склеродермия, синдром Шегрена, воспалительные миопатии);
- ювенильный идиопатический артрит;
- палиндромный ревматизм;
- септический артрит;
- саркоидоз;
- ревматическая полимиалгия;
- болезнь Лайма;
- васкулиты;
- ювенильный идиопатический артрит;
- палиндромный ревматизм;
- фибромиалгия;
- эндокринные заболевания;
- артрит, связанный с опухолями;
- вирусные артриты;
- заболевания мягких тканей;
- травма.
При невозможности поставить достоверный диагноз у пациентов с ранним артритом следует оценить факторы риска развития стойкого и/или «эрозивного» артрита, к которым относятся число припухших суставов, острофазовые показатели, РФ, АЦБ. «Позитивность» по РФ и/или АЦБ и уровень антител являются прогностическими факторами персистирующего и эрозивного артрита, что послужило основанием для включения этих показателей в диагностические критерии РА (ACR/EULAR, 2010) [15]. Выявлена независимая связь между обнаружением АЦБ, диагнозом РА и рентгенологическим прогрессированием деструкции суставов при раннем РА. Значение РФ для диагностики РА неоднозначно. «Чувствительность» РФ для диагностики РА умеренная (40–60%), реже – «высокая» (60–80%), а «специфичность» колеблется от 60 до 80% и очень редко достигает 100%. «Чувствительность» АЦБ сходна с таковой для РФ (60–80%), но «специфичность» выше, чем у РФ – 80–100%.
Основная цель назначения БПВП – достижение ремиссии. При этом регулярная оценка активности заболевания, нежелательных реакций и коморбидности обеспечивает предпосылки для выбора оптимальной терапии. Пациенты, имеющие факторы риска персистирования артрита, должны начать получать БПВП как можно раньше (не позднее, чем через 3 месяца с момента появления симптомов), даже если их состояние не полностью соответствует критериям воспалительного ревматического заболевания. Эта рекомендация имеет фундаментальное значение для улучшения прогноза у пациентов с ранними хроническими артритами, включая ранний РА, ранний псориатический артрит, или у больных с факторами риска стойкого и/или эрозивного артрита, который рассматривается как синоним РА. Рекомендация о начале терапии в течение первых 3 мес от момента развития симптоматики соответствует представлению об «окне возможностей». Инициация терапии БПВП в эти сроки ассоциируется с улучшением прогноза, включая частоту ремиссий, эффективность терапии, замедление прогрессирования деструкции суставов, улучшение качества жизни пациентов. При раннем артрите важным компонентом ведения пациентов является соблюдение рекомендаций, касающихся отказа от курения, гигиены зубов и полости рта, контроля массы тела, профилактики и лечения коморбидных заболеваний.
Среди БПВП основным («якорным») препаратом является МТ, который при отсутствии противопоказаний должен становиться компонентом стратегии «первой линии» у пациентов с риском хронизации артрита. Этот принцип проходит «красной нитью» через все рекомендации, касающиеся терапии раннего артрита и раннего РА [16–18]. Центральное место МТ в лечении РА определяется не только высокой эффективностью и удовлетворительной безопасностью, но и снижением под его влиянием риска кардиоваскулярных осложнений (основная причина уменьшения продолжительности жизни пациентов), потребности в протезировании суставов. МТ потенцирует противовоспалительное действие ГИБП за счет различных механизмов, в том числе снижая их иммуногенность, улучшая фармакокинетические параметры, а также благодаря уникальным механизмам собственной противовоспалительной активности, дополняющим «таргетные» эффекты ГИБП. Более чем у половины пациентов с НДА или ранним РА и у трети больных РА монотерапия МТ индуцирует развитие клинической ремиссии, и они не нуждаются в интенсификации терапии. Важный аспект эффективного лечения раннего артрита и РА связан с оптимизацией дозы МТ, которая состоит в ее быстрой эскалации (до 25–30 мг/нед), рациональном применении подкожной формы МТ, которая должна рассматриваться при необходимости назначения высокой дозы (≥15 мг/нед) или плохой переносимости таблетированной формы препарата. Назначение подкожной формы МТ в качестве препарата «первого ряда» у этой категории пациентов имеет преимущества перед применением таблетированной формы как в отношении эффективности (более частое достижение ремиссии и низкой активности болезни), так и безопасности (низкая частота нежелательных реакций) и позволяет снизить потребность в назначении дорогостоящих ГИБП.
 Нестероидные противовоспалительные препараты (НПВП) эффективны в качестве симптоматической терапии, но должны использоваться в минимально эффективных дозах и в течение максимально короткого времени, после оценки желудочно-кишечных, почечных и кардиоваскулярных факторов риска нежелательных явлений [19]. Эта рекомендация соответствует мнению экспертного сообщества, в первую очередь акцентирующего внимание на безопасности использования НПВП в ревматологии.
Нестероидные противовоспалительные препараты (НПВП) эффективны в качестве симптоматической терапии, но должны использоваться в минимально эффективных дозах и в течение максимально короткого времени, после оценки желудочно-кишечных, почечных и кардиоваскулярных факторов риска нежелательных явлений [19]. Эта рекомендация соответствует мнению экспертного сообщества, в первую очередь акцентирующего внимание на безопасности использования НПВП в ревматологии.
Системное применение ГК позволяет снизить интенсивность болей, подавить воспаление суставов и замедлить прогрессирование их деструкции. Поскольку применение ГИБП не решает всех проблем фармакотерапии РА как с точки зрения эффективности, так и безопасности, применение короткого курса ГК, особенно в дебюте артрита. в комбинации с МТ позволяет улучшить результаты лечения этого заболевания [5, 20, 21]. С учетом кумулятивного накопления нежелательных реакций (инфекционные осложнения, кардиоваскулярная патология, увеличение массы тела, диабет, катаракта, остеопороз), ГК следует применять в максимально низких дозах (<10 мг/сут) и в течение не более 6 мес. Внутрисуставное назначение ГК следует использовать для подавления локальных суставных проявлений раннего артрита. Особое внимание следует обратить на недопустимость монотерапии ГК, которая может «маскировать» симптомы и тем самым затруднять дифференциальную диагностику при раннем артрите.
Нефармакологические методы, включающие динамические упражнения и физиотерапию, могут рассматриваться как компонент дополнительной терапии у пациентов с ранним артритом, поскольку они, хотя и не влияют на активность заболевания, улучшают функциональный статус пациентов.
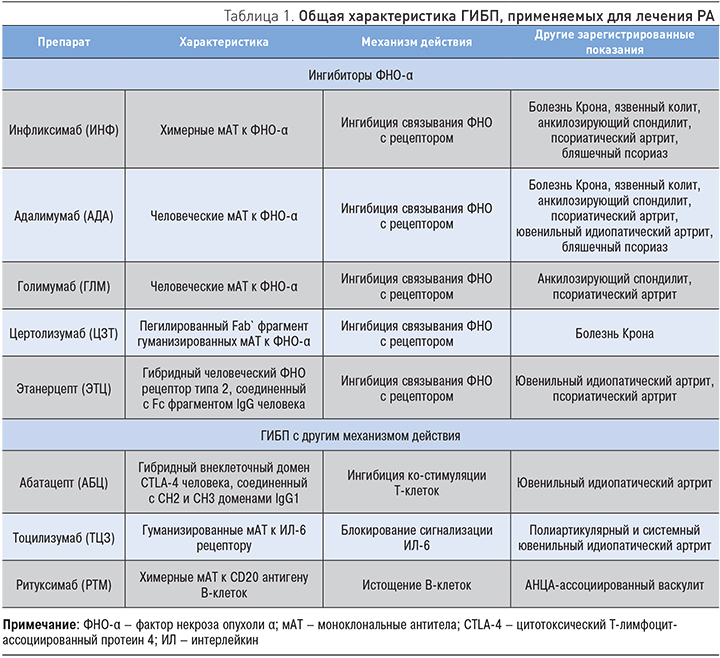
В настоящее время ГИБП (как класс препаратов) рекомендуется применять у пациентов с достоверным диагнозом РА в случае невозможности достигнуть ремиссии (через 6 месяцев) или отсутствия «удовлетворительного» эффекта (через 3 мес) на фоне лечения МТ (включая подкожную его форму) в максимально переносимых дозах (±ГК) или комбинированной терапии, включающей МТ, сульфасалазин и гидроксихлорохин (рис. 1) [5, 8, 11]. Слишком раннее назначение ГИБП неоправданно, поскольку может привести к «перелечиванию» многих пациентов, способствуя тем самым увеличению риска нежелательных реакций и стоимости лечения. Учитывая сходную эффективность и безопасность всех ГИБП, не зависящую от механизма действия, структуры (моноклональные антитела или рекомбинантные белковые молекулы) и лекарственной формы, выбор препарата оставляют на усмотрение врача-ревматолога. Для увеличения эффективности терапии ГИБП целесообразно применять в комбинации с МТ. Только при наличии противопоказаний (или плохой переносимости) МТ возможно проведение монотерапии ГИБП, среди которых «препаратами выбора» являются ТЦЗ и, вероятно, ингибитор JAK-киназы тофацитиниб (ТОФА). Пациентам, у которых не удалось достигнуть ремиссии (или низкой активности) на фоне комбинированной терапии МТ и ГИБП в течение 6 мес, рекомендуется назначить другой ГИБП. Если терапия ГИБП начиналась с ингибиторов ФНО-α, то целесообразно перевести больного не на другой ингибитор ФНО-α, а на препарат с альтернативными механизмами действия – АБЦ, ТЦЗ или РТМ. Наконец, при неэффективности комбинированной терапии БПВП и ГИБП в качестве «третьей линии» лечения следует рассмотреть возможность назначения ингибитора JAK-киназы ТОФА – первого «таргетного» синтетического препарата для перорального приема, который специально разработан для лечения РА и имеет хорошие перспективы при других воспалительных ревматических (псориатический артрит) и неревматических (псориаз, алопеция, витилиго и др.) заболеваний.
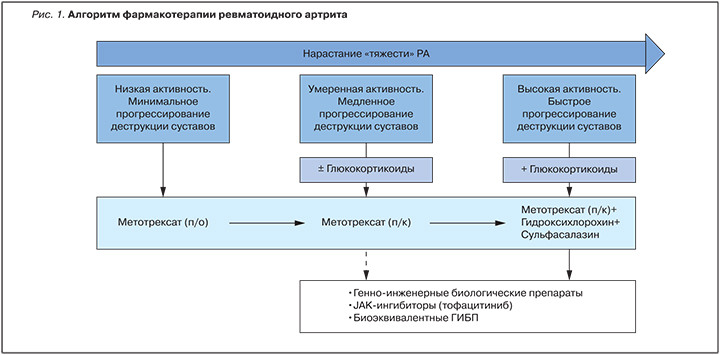
В случае достижения ремиссии (длительность не менее 6 мес на фоне терапии), после отмены ГК или продолжения их приема в дозе <5 мг/сут возможно постепенное тщательно контролируемое снижение («титрование») дозы или отмена ГИБП (рис. 2). Последнее более вероятно у пациентов с ранним РФ/АЦБ-негативным вариантом РА. Для поддержания ремиссии после снижения дозы (или отмены) ГИБП необходима адекватная терапия МТ, включая применение подкожной формы препарата. При развитии обострения заболевания повторное назначение тех же препаратов (или других ГИБП) в стандартной дозе, наряду с оптимизацией терапии МТ, приводит к быстрому подавлению активности воспаления у большинства больных. К сожалению, при развернутом РФ/АЦБ-позитивном варианте РА отмена ГИБП (как и стандартных БПВП) возможна редко, и, как правило, приводит к обострению [22–24].
ПЕРСПЕКТИВЫ
Ретроспективная оценка клинических симптомов у пациентов с ранним РА показала, что до развития артрита у них наблюдаются мигрирующие боли, ощущение жжения, покалывания в суставах (наиболее часто в кистях), сочетающиеся с утренней скованностью [25]. Недавно группа экспертов EULAR разработала клинический алгоритм, позволяющий выделить пациентов с артралгиями, у которых имеется риск развития РА (табл. 2) [26]. В связи с этим очень большой интерес представляют материалы исследования PROMPT (Probable Rheumatoid Arthritis: Methotrexate versus Placebo Treatment) [27], посвященного оценке эффективности лечения МТ у пациентов с НДА в отношении снижения риска прогрессирования в РА. Ретроспективный анализ материалов этого исследования [28], основанный на стратификации пациентов в зависимости от риска прогрессирования раннего НДА в достоверный РА с использованием прогностического «решающего правила» (prediction rule) [29], показал, что у пациентов с НДА из группы высокого риска, получавших МТ, частота развития РА была достоверно ниже, чем в группе плацебо (p=0,011), также у них отмечено достоверное замедление развития РА (p<0,001) и увеличение частоты «безлекарственной» ремиссии (p=0,027). Эти материалы свидетельствуют о том, что раннее назначение МТ и, вероятно, гидроксихлорохина [30] позволяет предотвратить формирование РА в группе высокого риска развития этого заболевания.
В совокупности все эти данные еще раз подтверждают целесообразность «стратегического» подхода к ведению пациентов с РА, основанного на ранней диагностике и тщательно контролируемой терапии, начиная с дебюта болезни, и в целом имеют принципиальное значение для разработки новых подходов к профилактике развития РА в группах риска [31, 32], а, следовательно, и кардинального улучшения прогноза заболевания.



