Феномен Вольфа—Паркинсона—Уайта (WPW) встречается у 0,05—0,4% детей [1—5]. Наибольшая распространенность (0,55%) отмечается у прямых родственников лиц с дополнительными атриовентрикулярными соединениями (ДАВС) [6]. Частота выявления новых случаев феномена WPW в общей популяции составляет 3,96—4,4 на 100 000 человек в год, у мужчин в 2 раза чаще, чем у
женщин [3, 7]. В 23% случаев феномен WPW выявляется в детском возрасте. Наибольшее число новых случаев приходится на 1-й год жизни, как среди мальчиков — 20 на 100 000 человек, так и среди девочек — 6 на 100 000 человек. Второй пик наблюдается в молодом возрасте и приходится у мужчин на 3-е, а у женщин — на 4-е десятилетие жизни [3]. Однако по данным S. Sano и соавт. [4], значительно чаще феномен WPW регистрировался у старшеклассников 15—16 лет — в 0,174% случаев, тогда как у детей младшего и среднего школьного возраста — только в 0,07% случаев. Точное соотношение феномена и синдрома WPW у детей неизвестно. Вопрос о том, почему
у отдельных людей ДАВС проявляются лишь феноменом на электрокардиограмме (ЭКГ), а у других с ними связано возникновение тахикардии, остается нерешенным. Обычно пароксизмальная атриовентрикулярная реципрокная тахикардия (ПАВРТ) с участием ДАВС начинается в возрасте моложе 40 лет [3].
Имеется ограниченное число исследований, которые посвящены изучению естественного клинического течения феномена WPW у детей [5, 8—13]. Особенно возрос интерес к феномену WPW после ряда публикаций итальянской группы исследователей С. Pappone [11, 13], которые показали высокий риск появления ПАВРТ и угрожающих жизни нарушений ритма сердца у детей с феноменом WPW, а также продемонстрировали возможность стратификации риска подобных состояний при
проведении эндокардиального электрофизиологического исследования. До этого доминировало мнение, что феномен WPW у детей имеет благоприятное течение и крайне небольшой риск возникновения опасных для жизни состояний. Однако не раз отмечалось, что внезапная
сердечная смерть (ВСС) может стать первым проявлением синдрома WPW, бывшего до этого бессимптомным [14—16].
Целью нашего исследования явился анализ длительного клинического течения феномена WPW у детей с оценкой частоты возникновения ПАВРТ, опасных для жизни нарушений ритма сердца, ВСС. На основании полученных данных были разработаны практические рекомендации по обследованию, клиническому наблюдению детей с феноменом WPW, выделению группы риска и определению показаний к проведению радиочастотной абляции (РЧя) ДАВС.
Материал и методы
В отделении хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции СПб ГУЗ Городская клиническая больница № 31 с ноября 1993 г. по 2011 г. обследованы 176 детей с манифестирующим типом феномена WPW. Из них 117 (66,5%) мальчиков и 59 (33,5%) девочек. Возраст на момент первого обследования составил 12,5±3,2 года (от 0,1 до 18 лет). Во время первого обследования детям проводили: ЭКГ, суточное мониторирование ЭКГ, пробу с физической
нагрузкой (велоэргометрия или тредмил-тест), чреспищеводное электрофизиологическое исследование сердца (ЧПЭФИ). Диагноз манифестирующего типа синдрома WPW ставили при постоянной регистрации характерных признаков предвозбуждения желудочков на ЭКГ (короткого интервала PQ, волны Δ, расширения комплекса QRS, вторичных изменений сегмента ST и зубца Т) и
в отсутствие спонтанных приступов атриовентрикулярной (АВ) реципрокной тахикардии в анамнезе.
У 156 (88,6%) детей манифестирующий синдром WPW был выявлен на первой в жизни ЭКГ, только
у 20 (11,4%) детей имелись ранее сделанные ЭКГ без волны Δ . Причинами выполнения ЭКГ были в 30,8% случаев — обращение к кардиологу (функциональный систолический шум, жалобы на кардиалгии, сердцебиения), в 18,9% — диспансеризация детей, занимающихся спортом; в 14,9% случаев — диспансеризация и стационарное обследование по поводу сопутствующей патологии, в 13,2% — медицинская комиссия в военкомате, в 8,8% — регистрация ЭКГ перед выполнением хирургических операций, в 8% — медицинский осмотр в школе, в 5,7% — ЭКГ-скрининг. У 32 (18,2%) детей исходно имелись жалобы на эпизоды сердцебиений, у них исключали синдром WPW, данных, подтверждающих ПАВРТ, получено не было. Жалобы на сердцебиения были преимущественно связаны с синусовой тахикардией или эпизодами частой предсердной экстрасистолии.
По данным анамнеза жизни, большинство детей родились от молодых родителей, не имеющих патологии сердечно-сосудистой системы. Возраст матерей на момент рождения ребенка составлял 26,8±5,6 года (17—39 лет). У 52 (29,5%) матерей имелась угроза прерывания беременности на ранних сроках со стационарным лечением у 32 из них. У 2 отцов был синдром WPW.
Динамическое клиническое наблюдение детей с синдромом WPW осуществляли с помощью повторных стационарных обследований, амбулаторных консультаций, анкетирования, опроса по телефону. Из 176 детей из дальнейшего наблюдения выбыли 17 (9,6%) из-за утраты связи с ними и их родителями. Под наблюдением остались 159 детей: 104 (65,4%) мальчика и 55 (34,6%) девочек. При динамическом наблюдении в первую очередь оценивали: сохранение волны Δ на ЭКГ, появление ПАВРТ (переход феномена WPW в синдром WPW), возникновение синкопальных состояний, ВСС.
ЧПЭФИ выполняли преимущественно детям в возрасте старше 7 лет для оценки электрофизиологических параметров нормальной проводящей системы сердца и ДАВС, оценки риска ВСС. Для проведения ЧПЭФИ использовали автоматизированный комплекс AstrocardPolysystem EP/L (Медитек, Москва). В качестве чреспищеводного электрода применяли биполярный электрод
ПЭДСП-2 (Каменецк-Подольский, Украина).
Статистическую обработку данных проводили с помощью пакета программ Statistica 6.0. Результаты выражены как среднее арифметическое ± стандартное отклонение. Для оценки достоверности различий между средними и долями при нормальном распределении использовали t-критерий Стьюдента и критерий χ2 для дискретных переменных. Для вычисления доверительных интервалов
(ДИ) применяли метод Клоппера—Пирсона (рассчитывали 95% ДИ). Анализ вероятности наступления изучаемого исхода проводили по методу Каплан—Мейера. Различия считали статистически значимыми при р<0,05.
Результаты и обсуждение
У детей обследованной группы возраст на момент регистрации первой ЭКГ с феноменом WPW составил
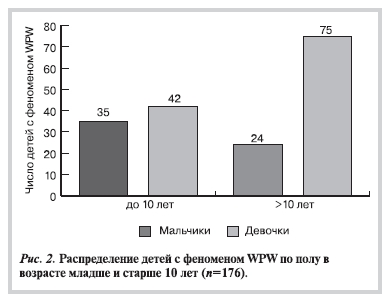
10,8±4,4 года (от 0,1 до 18 лет). У ⅔ (66,5%) детей феномен WPW был выявлен в возрасте от 10 до 18 лет (рис. 1). Чаще феномен WPW регистрировался у мальчиков, причем в возрасте младше 10 лет мальчики составляли 55,4%, а в возрасте старше 10 лет — 75,8% (р=0,003) (рис. 2). У девочек феномен WPW был выявлен в более раннем возрасте (9,6±4,1 года по сравнению с 11,3±4,4 года у мальчиков;
р=0,03) и раньше проводилось первое обследование — в 11,6±3,9 года по сравнению с 14,2±3,2 года у мальчиков (р=0,01).

Имелись и другие половые различия у детей с феноменом WPW. У мальчиков был шире комплекс QRS
c волной Δ (122,2±18,2 мс по сравнению с 112,3±20,7 у девочек; р=0,01), меньше эффективный рефрактерный период (ЭРП) ДАВС (276,5±39,5 мс по сравнению с 290,7±37,9 мс у девочек; р=0,02) и больше частота предсердной стимуляции, при которой наступала блокада проведения по ДАВС (209,6±33,9 имп/мин по сравнению с 195,9±28,3 имп/мин у девочек; р=0,01). Таким образом,
у мальчиков отмечалась большая степень предвозбуждения желудочков и были лучше проводящие свойства ДАВС.
У 7 (3,9%) детей имелись врожденные пороки сердца: у 5 — дефект межпредсердной перегородки, у одного — открытый артериальный проток, у одного — аномалия Эбштейна. У 3 (1,7%) детей имелась гипертрофическая кардиомиопатия. У большинства детей с феноменом WPW по данным эхокардиографии (ЭхоКГ) были выявлены «малые аномалии» сердца: у 115 (64,5%) — дополнительные хорды, у 40 (22,4%) — пролапс митрального клапана. Это согласуется с наблюдениями других исследователей, отмечающих большую распространенность «малых аномалий» у лиц с ДАВС [17].
Всего 176 детям было сделано 222 ЧПЭФИ — в структуре первичного обследования или повторно при динамическом наблюдении (в основном при появлении жалоб на приступы сердцебиений или обмороки). Во время ЧПЭФИ у 14 (8%) детей с феноменом WPW, т.е. без спонтанных приступов тахикардии в анамнезе, была индуцирована ПАВРТ с участием ДАВС, у 24 (13,6%) — фи брилляция
предсердий (ФП). У 7 (3,9%) детей была индуцирована устойчивая (более 30 с) ФП с АВ-проведением по ДАВС со средним интервалом RR менее 250 мс или минимальным интервалом RR менее 220 мс. В данном случае риск ВСС оценивался как высокий; таким детям рекомендовали проведение РЧА ДАВС. При обнаружении «опасных» ДАВС с высоким уровнем проводимости (ЭРП ДАВС 250 мс и менее и/или проведение через ДАВС 240 имп/мин и более) давали рекомендации по ограничению спортивных
нагрузок. Детям с такими параметрами ДАВС, желающим продолжать занятия спортом, рекомендовали проведение РЧА ДАВС с подробным информированием о возможных осложнениях при проведении операции.
Длительность клинического наблюдения 159 детей с феноменом WPW составила 1175 человеко-лет (от 0,5 до 17 лет, в среднем 7,4±4,5 года). За время наблюдения спонтанные приступы АВ-реципрокной тахикардии, подтвержденные данными ЭКГ и/или ЧПЭФИ, появились у 13 (8,2%) детей (при 95% ДИ от 4,4 до 13,6%), у 10 мальчиков и 3 девочек. У детей с возникновением ПАВРТ феномен WPW был выявлен в более раннем возрасте, чем в группе детей без появления ПАВРТ (7,6±4,9 года по сравнению с 11,1±4,2 года; р=0,03). ПАВРТ появилась через 6,19±2,2 года после диагностики феномена WPW в возрасте 13,7±4,8 года. У 2 детей из этой группы в период отсутствия спонтанных приступов тахикардии во время ЧПЭФИ индуцировались ПАВРТ. По данным анализа по методу Каплан—Мейера риск перехода феномена WPW в синдром WPW составляет 15% в течение 10 лет.
У 14 (8,8% при 95% ДИ от 4,9 до 14,3%) детей с феноменом WPW наблюдалось спонтанное исчезновение волны Δ по данным 3 контрольных ЭКГ (средний возраст 16,3±4,6 года). Исходно у них был достоверно больше ЭРП ДАВС, чем у детей с сохранением манифестирующего типа синдрома WPW (310,6±42,5 мс по сравнению с 285,6±48,6 мс; р=0,04). У 12 (7,5% при 95% ДИ от 3,9 до 12,8%) детей наблюдался переход манифестирующего типа синдрома WPW в интермиттирующий тип (средний
возраст 16,8±3,6 года).
Кратковременные обмороки наблюдались у 15 (8,4%) детей с феноменом WPW, большинство из них имели клиническую картину вазовагальных обмороков. У одного 16-летнего подростка из этой группы при проведении ЧПЭФИ во время внутривенной инъекции атропина (при проколе кожи, до введения препарата) наблюдалось резкое снижение частоты сердечной сокращений (ЧСС) с паузой ритма сердца около 7 с, что сопровождалось снижением артериального давления и пресинкопальным
состоянием (рис. 3). У 3 детей (2 мальчика в возрасте 17 лет, девочка в возрасте 15 лет) с феноменом WPW и кратковременными обмороками в анамнезе во время ЧПЭФИ была индуцирована ФП с большой частотой желудочкового ритма (с RR мин. 190 мс; 203 мс и 245 мс соответственно) (рис. 4).
Рисунок 3. Фрагменты ЧПЭФИ мальчика Л., 16 лет с феноменом WPW (25мм/с).
Рисунок 4. Приступ ФП, индуцированный во времени ЧПЭФИ у девочки П., 15 лет с феноменом WPW и обмороками в анамнезе (50 мм/с).
У 2 детей с феноменом WPW в анамнезе имелась клиническая смерть с успешной сердечно-легочной
реанимацией, однако один из них впоследствии умер. У одного 11-летнего мальчика с двумя длительными синкопальными состояниями в анамнезе, с проведением реанимационных мероприятий и постреанимационной энцефалопатией имелось сочетание гипертрофической кардиомиопатии и феномена WPW. Во время ЧПЭФИ на частоте стимуляции 140 имп/мин был индуцирован устойчивый приступ ФП со средним интервалом RR 245 мс, который спонтанно трансформировался в полиморфную желудочковую тахикардию (ЖТ). Синусовый ритм был восстановлен экстренной дефибрилляцией.
Через 1 день в столовой отделения вновь произошла потеря сознания с последующей сердечно-легочной реанимацией и успешной дефибрилляцией. Через несколько часов в палате интенсивной терапии — повторная потеря сознания, на кардимониторе — спонтанно возникшая полиморфная ЖТ с переходом в фибрилляцию желудочков. Ребенку планировалась имплантация кардиовертера-дефибриллятора, однако в 1996 г. это было связано с техническими сложностями. Мальчику была назначена медикаментозная терапия. К сожалению, ребенок умер за несколько дней до планируемой операции после развития очередного синкопального состояния. В данном случае определяющим угрожающим жизни аритмическим синдромом и вероятной причиной ВСС являлась полиморфная ЖТ, однако результаты ЧПЭФИ продемонстрировали механизм возникновения ВСС у лиц с феноменом
WPW.
У второго 13-летнего мальчика во время конкурса бальных танцев произошла внезапная длительная потеря сознания с судорогами, остановкой дыхания, экстренная помощь оказана на месте дежурившим врачом. Скорой помощью был доставлен в реанимационное отделение детской больницы, где на впервые снятой ЭКГ зарегистрирован феномен WPW. Во время обследования в нашем центре выполнено ЧПЭФИ: ЭРП ДАВС 260 мс, проведение через ДАВС блокировалось при частоте стимуляции 220 имп/мин, был индуцирован неустойчивый приступ ФП с минимальным интервалом RR 343 мс, т.е.
электрофизиологических параметров, свидетельствующих о высоком риске ВСС, получено не было. Учитывая анамнез заболевания, мальчику выполнили успешную РЧА заднесептального ДАВС. В последующие 3 года наблюдения мальчик продолжал заниматься танцами, синкопальных состояний не было.
Один (0,6%) ребенок с феноменом WPW без синкопальных состояний в анамнезе и ранее выявленных угрожающих жизни нарушений ритма внезапно умер в возрасте 14 лет. Частота ВСС составила 1 случай в течение 1175 человеко-лет или 0,09% (при 95% ДИ от 0 до 0,47%).
Клинический пример. Мальчик Н., 14 лет. Воспитывался бабушкой, сбор анамнеза жизни был затруднен. С раннего возраста наблюдался неврологом по поводу резидуально-органической патологии центральной нервной системы, были психологические проблемы с обучением в школе.
В 11 лет по поводу нагноившейся гематомы левой щеки госпитализирован в детскую больницу, где на впервые снятой ЭКГ зарегистрирован феномен WPW. Был направлен для обследования в наш центр. По результатам ЭхоКГ выявлена добавочная хорда в полости левого желудочка, размеры камер сердца и сократительная функция сердца в норме. Велоэргометрия выполнена с адекватной по ЧСС реакцией по нормотоническому типу, постоянно регистрировалась волна Δ, нарушений ритма не провоцировано. Клинические и биохимические анализы в норме.
По данным ЧПЭФИ, проведение импульсов через ДАВС блокировалось на частоте стимуляции 200 имп/мин, ЭРП ДАВС 280 мс. Тахикардия не индуцировалась. Однако имелись единичные предсердные экстрасистолы с необычными свойствами АВ-проведения — с очень коротким интервалом PQ и широким комплексом QRS с вероятными признаками предвозбуждения (рис. 5). При этом морфология комплекса QRS отличалась от формы QRS при синусовом ритме. Эти данные позволяли предположить множественные ДАВС. В то же время свойства проведения по ДАВС не отличались высоким уровнем проводимости, опасные для жизни тахиаритмии не провоцировались, т.е. данных, подтверждающих высокий риск ВСС, получено не было. В течение нескольких лет мальчик наблюдался в поликлинике по месту жительства, где ему проводили контрольные ЭКГ. Жалоб на сердцебиение у него не было.
Рисунок 5. ЭКГ мальчика Н., 11 лет, с феноменом WPW (50 мм/с). Предсердная экстрасистола указана стрелкой.
В возрасте 14 лет констатирована ВСС. Известно, что мальчик около 2 ч гулял на улице, играл в футбол. Пришел домой, пожаловался на плохое самочувствие и потерял сознание. Смерть произошла до прибытия скорой помощи.
По данным патологоанатомического исследования поставлен диагноз: кардиомиодистрофия. Острая сердечная недостаточность. Результаты аутопсии: масса сердца 370 г, толщина стенок левого желудочка 1,5 см, правый желудочек 0,5 см. Гистология: белковая дистрофия миокарда, слабовыраженный мелкоочаговый миофиброз, гипертрофия и атрофия части кардиомиоцитов, мелкоочаговый слабовыраженный склероз эндокарда в препарате сосочковой мышцы. Обращают внимание большие размеры сердца, по данным гистологии нельзя исключить перенесенный
латентный миокардит, возможно, без лабораторной активности и явных клинических проявлений.
Этот клинический случай заставляет с большим вниманием отнестись к результатам ряда исследований, демонстрирующих возможную связь ВСС у лиц с феноменом и синдромом WPW c органическими заболеваниями миокарда. Так, C. Basso и соавт. [18] провели анатомо-гистологическое исследование после ВСС у 10 детей и молодых людей с синдромами WPW. У 5 из них были обнаружены признаки изолированного миокардита предсердий. Авторы высказали предположение, что данные очаги могут
являться триггерами ФП. Имеются описания случаев ВСС у детей с сочетанием синдрома WPW и гипертрофической кардиомиопатии, а также при наличии изолированного некомпактного миокарда желудочков [19]. Следует вспомнить спортсменов, у которых часто имеется гипертрофия миокарда и также описаны случаи ВСС при феномене WPW [3].
Этот клинический случай подтверждает, что дети с сочетанием феномена WPW и органических заболеваний миокарда относятся к группе повышенного риска ВСС. Кроме того, отрицательную роль могли сыграть множественные ДАВС.
Все перечисленные факты требуют повышенного внимания к каждому ребенку с феноменом WPW с обязательным выявлением имеющихся, а также возникающих в течение наблюдения органических заболеваний миокарда. Поэтому в перечень контрольных исследований необходимо включать ЭхоКГ не реже 1 раза в год. В группе детей с сочетанием феномена WPW и органических заболеваний
миокарда, а также при множественных ДАВС необходимо более решительно проводить РЧА ДАВС.
Мы придерживаемся следующей тактики обследования и наблюдения детей с феноменом WPW. Всем детям с феноменом WPW проводится клиническое обследование с включением ЭКГ, суточного мониторирования ЭКГ, пробы с физической нагрузкой и ЧПЭФИ — для оценки электрофизиологических свойств ДАВС и выявления опасных для жизни нарушений ритма. Обязательно проводится ЭхоКГ для выявления врожденных пороков сердца и органических заболеваний миокарда. На основании полученных данных выделяется группа детей с высоким риском ВСС.
Критерии высокого риска ВСС у детей с феноменом WPW:
1. Клиническая смерть в анамнезе.
2. Спонтанная/индуцированная устойчивая ФП с проведением импульсов по ДАВС со средним интервалом RR менее 250 мс или минимальным интервалом RR менее 220 мс.
3. Сочетание феномена WPW с врожденным пороком сердца, миокардитом, гипертрофической кардиомиопатией.
4. Высокий уровень проводимости в ДАВС (240 имп/мин и более) и/или короткий ЭРП ДАВС
(250 мс и менее) у спортсменов с феноменом WPW.
5. Множественные ДАВС.
Отнесение ребенка с феноменом WPW в группу риска обусловливает необходимость рассмотреть вопрос о РЧА ДАВС. Однако в каждом случае феномена WPW вопрос решается индивидуально.
Профилактика ВСС у детей с феноменом WPW включает:
1. Проведение ЭКГ-скринингов для выявления феномена WPW в различных возрастных группах детей.
2. Обследование всех детей с феноменом WPW для стратификации риска ВСС.
3. Своевременное радикальное лечение феномена WPW при стратификации высокого риска ВСС.
4. Наблюдение всех детей с феноменом WPW в динамике: ЭКГ 1 раз в 6 мес, суточное мониторирование ЭКГ 1 раз в год, ЭхоКГ 1 раз в год.
Таким образом, профилактика опасных для жизни состояний у детей с феноменом WPW заключается в раннем выявлении феномена и стратификации риска ВСС, от чего зависит дальнейшая тактика наблюдения и лечения ребенка.
Учитывая, что показания к проведению РЧА ДАВС у детей с феноменом WPW четко не определены, проводить по сути профилактическую РЧА следует только в центрах с большим опытом подобных операций для снижения риска развития возможных осложнений.
Выводы
1. Манифестирующий тип синдрома WPW у детей в ⅔ случаев выявляется в возрасте от 10 до 18 лет, чаще у мальчиков.
2. Риск возникновения пароксизмальной атриовентрикулярной реципрокной тахикардии у детей с феноменом WPW составляет 15% в течение 10 лет.
3. Спонтанное исчезновение признаков предвозбуждения желудочков на электрокардиограмме наблюдается у 8,8% детей с феноменом WPW.
4. У детей с феноменом WPW имеется риск возникновения угрожающих жизни состояний и внезапной сердечной смерти.
5. При обследовании детей с феноменом WPW для определения дальнейшей тактики лечения необходима стратификация риска внезапной сердечной смерти. Детям из группы риска рекомендуется проведение радиочастотной абляции дополнительного атриовентрикулярного соединения.



