Смертность при ишемической болезни сердца (ИБС) почти у 50% больных является следствием желудочковых тахиаритмий, возникающих на фоне электрической нестабильности миокарда [1]. Высокая частота аритмической смерти у пациентов, страдающих ИБС, особенно у лиц, перенесших инфаркт миокарда (ИМ), делает крайне актуальной разработку профилактических мер.
Данные эпидемиологических и клинических исследований указывают, что ω-3 полиненасыщенные жирные кислоты (ПНЖК) способны уменьшать риск внезапной сердечной смерти (ВСС). В крупных исследованиях DART (the Diet and Reinfarction Trial) и GISSI Prevenzione (Gruppo Italiano per lo Studio della Sopravvivenza nell`Infarto miocardico) показано, что применение ω-3 ПНЖК — эйкозапентаеновой (ЭПК) и докозагексаеновой (ДГК) — у пациентов, перенесших ИМ, сопровождается снижением общей смертности на 20—29%, а риска ВСС — на 45% [2, 3]. Однако, несмотря на наличие достаточно обширной экспериментальной базы, подтверждающей антиаритмический эффект ω-3 ПНЖК [2, 4—18], точные механизмы действия этих веществ в профилактике ВСС у больных ИБС находятся в стадии изучения. Немногочисленны данные литературы, свидетельствующие о положительном влиянии ω-3 ПНЖК на показатели вариабельности ритма сердца (ВРС) [8, 19], количество желудочковых экстрасистол (ЖЭ) и пароксизмов желудочковой тахикардии (ЖТ) за сутки [12, 20]. Не исследовано влияние данных веществ на новые предикторы ВСС— турбулентность ритма сердца (ТРС) и микровольтную альтернацию зубца Т (mTWA). В отечественной литературе отсутствуют данные о возможности влияния с помощью препаратов ω-3 ПНЖК на такой биомаркер сердечно-сосудистых осложнений — ССО (в том числе ВСС), как ω-3-индекс эритроцитов, представляющий собой сумму процентного содержания ЭПК и ДГК в мембране эритроцитов [21].
Цель исследования — оценить динамику неинвазивных электрофизиологических (желудочковые нарушения ритма сердца, показатели ВРС, ТРС, mTWA) и гуморальных (ω-3-индекс эритроцитов) предикторов ВСС на фоне терапии препаратом ω-3 ПНЖК (омакор) у пациентов с ИБС и желудочковыми аритмиями.
Материал и методы
В исследование были включены 80 пациентов. Критериями включения были: 1) доказанная ИБС (положительные результаты нагрузочных тестов, либо признаки ИБС по результатам коронарографии или мультиспиральной компьютерной томографии коронарных артерий, либо ИМ или хирургическое/рентгенэндоваскулярное вмешательство на коронарных артериях в анамнезе); 2) желудочковые нарушения ритма, зарегистрированные по данным холтеровского мониторирования — ХМ электрокардиограммы — ЭКГ (ЖЭ в количестве 250 и более за сутки и/или неустойчивые пароксизмы ЖТ); 3) постоянная антиаритмическая терапия в течение, по крайней мере, месяца до начала исследования (β-адреноблокаторы и/или амиодарон); 4) информированное согласие пациента на участие в исследовании.
Критериями исключения являлись сахарный диабет; прием препаратов, содержащих ω-3 ПНЖК, в течение 6 мес, предшествующих включению в исследование; острый коронарный синдром менее чем за месяц до включения в исследование; наличие постоянной формы фибрилляции или трепетания предсердий, имплантированного электрокардиостимулятора; сопутствующее онкологическое заболевание; тиреотоксикоз; анемия с уровнем гемоглобина менее 90 г/л.
Пациенты были рандомизированы в основную (n=50) и контрольную (n=30) группы, сопоставимые по основным демографическим и клиническим характеристикам, не считая тенденции к меньшей частоте интервенционных вмешательств в анамнезе у больных контрольной группы (табл. 1). На момент включения в исследование пациенты основной и контрольной групп получали терапию в соответствии с международными рекомендациями по лечению ИБС и желудочковых нарушений ритма (см. табл. 1).
Таблица 1. Исходные характеристики пациентов в основной и контрольной группах
Примечание. ИМ — инфаркт миокарда; ХСН — хроническая сердечная недостаточность.
Всем участникам при включении в исследование, а также через 3 и 6 мес проводили полное клиническое обследование, которое помимо сбора жалоб, анамнеза и физикального обследования включало ХМ ЭКГ с оценкой показателей ВРС — SDNN и pNN50 и показателей ТРС — TO (turbulence onset) и TS (turbulence slope); определением количества ЖЭ, пароксизмов устойчивой и неустойчивой ЖТ, а также mTWA по методике, описанной нами ранее [22]. Использовали модифицированный метод скользящей средней. Оценивали максимальное значение mTWA за сутки, mTWA при частоте сердечных сокращений (ЧСС) 100 уд/мин, mTWA в 5 ч утра. Измерения проводили в двух холтеровских отведениях при факторах актуализации — ФА (количество усредняемых комплексов ЭКГ) 1/8 и 1/32. Анализ суточной записи ЭКГ проводили с помощью программного обеспечения Cardioday Getemed (General Electric Healthcare, США). Кроме того, исходно всем пациентам проводили эхокардиографическое исследование на ультразвуковом аппарате Vivid 7 Dimension (General Electric Healthcare, США).
Наблюдение за пациентами осуществляли в течение 6 мес. На протяжении всего периода наблюдения терапия оставалась неизменной. Пациентам основной группы дополнительно к основной терапии сроком на 6 мес назначали лекарственный препарат ω-3 ПНЖК (омакор, Abbott Healthcare Products) в дозе 1 г/сут: каждая капсула массой 1 г содержит 840 мг этилового эфира ЭПК (46%) и ДГК (38%), общее содержание этиловых эфиров ω-3 кислот >90%.
У случайно отобранных из основной группы 25 пациентов исходно и через 6 мес приема омакора определяли ω-3-индекс эритроцитов. Забор крови осуществляли из локтевой вены натощак не менее чем через 12 ч после последнего приема пищи. Уровень ω-3 ПНЖК в эритроцитах периферической крови оценивали методом газовой хроматографии. Использовали газовый хроматограф 6890/5975 (Agilent, США). Образцы липидов плазмы нагревали с BF3, метанолом и бензолом при температуре 100 °С в течение 45 мин — в условиях, в которых происходит трансметилирование всех жирных кислот. После охлаждения все образцы экстрагировали гексаном и водой (1:2:2). Гексановый слой отбирали и испаряли азотом. Растворенный гексаном сухой остаток, содержащий метиловые эфиры жирных кислот, подвергали анализу на газовом хроматографе с пламенной ионизацией. Содержание жирных кислот идентифицировали по стандартам, а состав рассчитывали как массовый процент от всех жирных кислот. Определяли процентное содержание ЭПК, ДГК и их сумму — ω-3-индекс.
Методы статистического анализа. Оценку полученных результатов проводили с использованием методов описательной статистики. С целью определения соответствия переменной нормальному распределению использовали одновыборочный критерий Колмогорова—Смирнова. Для нормального распределения данные представлены в виде среднего значения ± стандартное отклонение, в иных случаях указана медиана (25-й; 75-й перцентили) или процент от общего числа пациентов. Достоверность различий для нормального распределения оценивали с помощью дисперсионного анализа (ANOVA) и двустороннего t-критерия, в иных случаях сравнение и оценку значимости различий проводили с использованием непараметрических критериев Манна—Уитни и Вилкоксона. Вероятность р<0,05 считали достаточной для вывода о достоверности различий. P более 0,05, но менее 0,1 расценивали как тенденцию к различиям. Обработку результатов осуществляли с помощью программного обеспечения Statistica версии 5.5.
Результаты
По данным ХМ ЭКГ, пациенты основной и контрольной групп исходно были сопоставимы по числу изолированных и парных ЖЭ, числу неустойчивых пароксизмов ЖТ за сутки, как и по распространенности парных ЖЭ и ЖТ в группах. Уже через 3 мес в основной группе отмечено достоверное уменьшение числа ЖЭ, парных ЖЭ, неустойчивых пароксизмов ЖТ, статистически значимо уменьшилось число пациентов с парными ЖЭ и ЖТ. Через 6 мес наблюдения отмечено дальнейшее усиление антиаритмического эффекта ω-3 ПНЖК (табл. 2). Все критерии хорошего антиаритмического эффекта (уменьшение числа ЖЭ на 75% и более, парных ЖЭ на 90% и более, полное устранение неустойчивых пароксизмов ЖТ [23]) через 3 мес терапии выявлены у 16% пациентов, а через 6 мес — у 46%. При этом уменьшение только числа изолированных ЖЭ более чем на 75% через 3 мес терапии отмечалось у 50% пациентов, а через 6 мес — у 90%. В контрольной группе выявлено небольшое, но достоверное увеличение числа ЖЭ, парных ЖЭ, «пробежек» ЖТ (см. табл. 2).
Таблица 2. Результаты ХМ ЭКГ в основной и контрольной группах: динамика желудочковых нарушений ритма за время наблюдения
Примечание. Здесь и в табл. 3: * — достоверность различий по сравнению с исходным показателем; ** — достоверность различий по сравнению с показателем 3 мес; # — достоверность различий между основной и контрольной группами; нд — недостоверное различие; ХМ ЭКГ — холтеровское мониторирование электрокардиограммы; ЖЭ — желудочковая экстрасистолия; ЖТ — желудочковая тахикардия.
Пациенты основной группы исходно характеризовались более низкими значениями SDNN, показатель pNN 50 в основной и контрольной группах различался недостоверно. На фоне терапии ω-3 ПНЖК отмечено постепенное увеличение SDNN в основной группе, тогда как к группе контроля этот показатель несколько снизился. В результате через 6 мес наблюдения среднее SDNN у пациентов, принимавших ω-3 ПНЖК, статистически значимо превысило значение данного показателя в контрольной группе (табл. 3). Через 6 мес показатель pNN50 в основной группе статистически достоверно не изменился. Однако с учетом тенденции к его увеличению (p<0,1), а главное, за счет достоверного снижения в контрольной группе, через 6 мес наблюдения среднее значение pNN50 у пациентов, принимавших ω-3 ПНЖК, достоверно превысило аналогичный показатель у больных, получавших стандартную терапию (см. табл. 3).
Таблица 3. Результаты ХМ ЭКГ в основной и контрольной группах: динамика показателей ВРС и ТРС за время наблюдения
Примечание. ВРС — вариабельность ритма сердца; ТРС — турбулентность ритма сердца; TO — turbulence onset; TS — turbulence slope.
Схожие результаты получены и для ТРС. Исходно в основной группе были достоверно больше пациентов с нарушенным показателем ТО (≥ 0), ниже среднее значение ТО, чаще встречались нарушения турбулентности второго типа (нарушения и ТО, и TS). Распространенность изолированного нарушения TS (<2,5 мс/RR) и его средние значения различались недостоверно (см. табл. 3). Если в контрольной группе за время наблюдения показатели ТРС несколько ухудшились (увеличилось среднее значение ТО и снизилось TS), то у пациентов, принимавших омакор, средние значения ТО и TS изменились прямо противоположно уже за первые 3 мес терапии. Через полгода среднее значение TO было достоверно ниже, а среднее значение TS — выше, чем в группе контроля. Результатом этого явилось то, что за 6 мес в основной группе доля пациентов с нарушением ТО и нарушением ТРС второго типа достоверно уменьшилась. На грани достоверности было уменьшение числа пациентов с нарушенным TS (p=0,055). И хотя у пациентов группы контроля распространенность нарушений ТРС первого и второго типа изменилась статистически незначимо, но за счет положительной динамики в основной группе через 6 мес у пациентов, принимавших омакор, эти нарушения встречались достоверно реже (за исключением частоты нарушения TS), чем в контрольной группе (см. табл. 3).
Исходно основная и контрольная группы статистически значимо различались по 3 из 12 изучаемых показателей mTWA: в контрольной группе достоверно выше были значения mTWA при ЧСС 100 уд/мин при обоих факторах актуализации (табл. 4). Отмечена тенденция к более высоким значениям mTWA в 5 ч утра в контрольной группе при ФА 1/32 во втором холтеровском отведении. За первые 3 мес терапии у пациентов, принимавших омакор, достоверной динамики ни одного из показателей не отмечено. Однако через полгода выявлено статистически значимое повышение mTWA, измеренной в первом мониторном отведении в 5 ч утра при ФА 1/8 и 1/32, а также при ЧСС 100 уд/мин при ФА 1/32 (см. табл. 4). Во втором мониторном отведении аналогичные изменения носили характер тенденции. В то же время в контрольной группе через 6 мес выявлено достоверное уменьшение mTWA при ЧСС 100 уд/мин (ФА 1/8 и 1/32) в первом отведении и в 5 ч утра при ФА 1/8 во втором отведении. В результате через 3 мес основная и контрольная группы достоверно не различались ни по одному из показателей mTWA, а через 6 мес в основной группе лишь значение mTWA, измеренное при ЧСС 100 уд/мин в первом отведении при ФА 1/32, статистически значимо превышало аналогичный показатель в группе контроля.
Таблица 4. Результаты ХМ ЭКГ в основной и контрольной группах: динамика показателей mTWA за время наблюдения
Примечание. *— достоверность различий по сравнению с исходным показателем; ** — достоверность различий по сравнению с показателем 3 мес; в скобках указаны значения p, имеющие характер тенденции; # — достоверность различий между основной и контрольной группами (1/2 отведение); нд — недостоверное отличие. mTWA — микровольтная альтернация зубца Т; ФА — фактор актуализации; ЧСС — частота сердечных сокращений.
У 25 пациентов основной группы исходно и через 6 мес терапии омакором оценен ω-3-индекс эритроцитов, а также отдельно составляющие его доли ЭПК и ДГК. Исходно ω-3-индекс эритроцитов у обследованных пациентов колебался от 1,12 до 6,4%, составляя в среднем 3,74 (2,02; 4,38)% (табл. 5). При этом у 14 (56%) больных ω-3-индекс был ниже 4%, что соответствует высокому риску развития ССО. У остальных пациентов данный показатель свидетельствовал о среднем риске: значения 4—5% отмечены у 8 (32%) больных, а 5—6,4% — у 3 человек. На фоне терапии ω-3 ПНЖК через 6 мес выявлено достоверное повышение ω-3-индекса эритроцитов за счет увеличения доли как ЭПК в среднем на 78 (24—141)%, так и ДГК в среднем на 42 (28—95)% (см. табл. 5). Через 6 мес ω-3-индекс, соответствующий среднему риску развития ССО (4—8%), отмечен у 22 (88%) пациентов (p=0,003). Лишь у 3 (12%) больных показатель оставался несколько ниже 4% (высокий риск) и составил от 3,93 до 3,98%. Хотя ω-3-индекс увеличился у всех без исключения пациентов, индивидуальные колебания степени этого увеличения были весьма различными — от 7,6 до 253,6%, в среднем 50 (33—98)%. Чем ниже был исходный ω-3-индекс, тем большее относительное увеличение данного показателя наблюдалось на фоне терапии ω-3 ПНЖК (rs=–0,928; p<0,001). Следует отметить, что если доля ДГК в мембранах эритроцитов через 6 мес возросла у 100% пациентов, то доля ЭПК — у 92%, так как у 2 (8%) пациентов выявлено снижение доли ЭПК с 1,44 до 1,33% и с 1,92 до 1,41%, несмотря на прием ω-3 ПНЖК.
Таблица 5. Динамика ω-3-индекса, процента ДГК, ЭПК в эритроцитах через 6 мес приема омакора в дозе 1 г/сут (n=25)
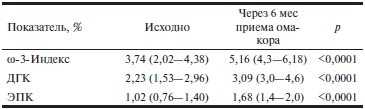
Примечание. ДГК — докозагексаеновая кислота; ЭПК — эйкозапентаеновая кислота.
Обсуждение
В нашем исследовании предпринята попытка оценки влияния препарата ω-3 ПНЖК на некоторые предикторы ВСС. Несмотря на то что использование подобных лекарственных средств включено в Международные рекомендации по профилактике ВСС у пациентов с ИБС [2], данные исследований, непосредственно оценивающих антиаритмический эффект ω-3 ПНЖК, весьма противоречивы [9—12]. Затрудняют непосредственное сопоставление полученных результатов как различие лекарственных форм (лекарственный препарат или пищевая добавка на основе рыбьего жира) и доз данного класса веществ, так и особенности избранных групп пациентов. Мы использовали лекарственный препарат, с одной стороны, эффективность которого как средства профилактики ВСС подтверждена в крупных рандомизированных исследованиях [24, 25], а с другой стороны, обеспечивающий точное соблюдение рекомендованных дозировок ω-3 ПНЖК. В исследование включались пациенты со стабильной ИБС, как без ИМ в анамнезе, так и перенесшие ранее ИМ, но в большинстве случаев имеющие относительно сохранную фракцию выброса левого желудочка. Таким образом, по контингенту больных, способу назначения ω-3 ПНЖК предпринятое нами исследование ближе всего к работам Е.М. Нифонтова и соавт. (стабильная ИБС и желудочковые аритмии, длительность наблюдения 2 мес) [12], Н.Г. Гоголашвили и соавт. (ИМ, перенесенный не позднее чем за 12 мес до включения в исследование, желудочковые аритмии, длительность наблюдения 6 мес) [20]. Полученные нами данные об антиаритмическом эффекте ω-3 ПНЖК в целом соответствуют результатам указанных исследований, также продемонстрировавших уменьшение числа как изолированных, так и парных ЖЭ, числа неустойчивых пароксизмов ЖТ. Мы не ставили своей задачей сравнение антиаритмической эффективности изучаемого препарата и «настоящих» антиаритмиков. В связи с этим все наши пациенты за время наблюдения продолжали прием ранее подобранных доз β-адреноблокаторов и амиодарона, которые, тем не менее, в отобранной группе больных были не полностью эффективны. Нам представлялось важнее оценить дополнительные преимущества добавления ω-3 ПНЖК к стандартной терапии ИБС и нарушений ритма сердца. Таким образом, продемонстрированный в нашем исследовании антиаритмический эффект можно расценивать как действие комбинированной терапии.
Увеличение SDNN и тенденция к повышению pNN50 свидетельствуют о благоприятных сдвигах в вегетативном статусе пациентов, получавших омакор, — снижении симпатических влияний и увеличении парасимпатического тонуса, что может иметь значение с точки зрения профилактики угрожающих жизни аритмий. Наши данные соответствуют результатам ряда отечественных и зарубежных исследований [8, 19, 26], продемонстрировавших сходные изменения ВСР на фоне терапии ПНЖК. Работ, оценивающих влияние ПНЖК на ТРС и mTWA, мы не встретили. В нашем исследовании показано, что терапия омакором благоприятно отразилась на показателях ТРС, снижая распространенность их патологических значений и улучшая абсолютные значения TO и TS.
На первый взгляд кажется парадоксальным достоверное увеличение некоторых показателей mTWA в группе пациентов, принимавших омакор в течение 6 мес, что должно было бы свидетельствовать о повышении аритмической нестабильности миокарда на фоне приема этого препарата. Однако мы не склонны расценивать данный факт столь однозначно. Во-первых, ранее аналогичное свойство увеличивать mTWA мы выявили у амиодарона [22] — препарата, антиаритмическая активность которого не вызывает сомнения, как и доказанная эффективность в профилактике ВСС [2]. В нашем исследовании указанный препарат принимали 40% больных основной группы и 67% пациентов группы контроля, что еще более затрудняет оценку полученных результатов, несмотря на стабильность во время наблюдения ранее подобранной дозы амиодарона. Во-вторых, в конце исследования лишь один из 12 показателей mTWA в основной группе достоверно превышал аналогичный показатель в группе контроля. На наш взгляд, данный феномен нуждается в дополнительном изучении. В настоящее время можно рекомендовать учитывать длительный (более 3 мес) прием омакора при оценке mTWA с помощью ХМ ЭКГ во избежание ложноположительных результатов в стратификации риска ВСС.
Обращает внимание, что антиаритмический эффект омакора, как и изменения показателей ВСР, ТРС и mTWA, усиливались с течением времени, что согласуется с данными других исследователей [12, 13, 19, 20, 26]. Это заставляет предположить, что в основе наблюдаемых изменений, вероятнее всего, лежат эффекты не свободного пула ПНЖК, а их действие в качестве составного компонента биомембран кардиомиоцитов. С целью оценки влияния ω-3 ПНЖК на процентное содержание ω-3 ПНЖК в миокарде мы исследовали динамику ω-3-индекса эритроцитов. Ранее было продемонстрировано, что этот показатель отражает содержание ω-3 ПНЖК в кардиомиоцитах [27, 28] и является модифицируемым фактором риска развития ССО [29]. Значения данного показателя зависят от содержания ЭПК и ДГК в рационе, следовательно, можно предположить популяционные различия ω-3-индекса, зависящие от национальных особенностей питания. Отечественных исследований, проводившихся с использованием данного показателя, мы не встретили. Средние значения или показатели нормы ω-3-индекса в нашей стране неизвестны. В избранной нами группе пациентов с желудочковыми аритмиями и доказанной ИБС не выявлено ни одного случая высокого содержания ω-3 ПНЖК, соответствующего низкому риску развития ССО. Данный факт косвенно подтверждает возможность использования предложенных ранее критериев [27, 29] и в отечественной медицинской практике. На фоне приема ω-3 ПНЖК отмечено достоверное и существенное повышение ω-3-индекса эритроцитов, также как достоверное уменьшение числа больных со значениями показателя, соответствующими высокому риску. Такая динамика свидетельствует о приверженности пациентов лечению и подтверждает аккуратность приема ими препарата. Подобный подход с использованием ω-3-индекса для оценки точности выполнения данным пациентам рекомендаций ранее был использован в работе M. Raitt и соавт. [18]. Однако степень прироста (в среднем 50%) и итоговые значения ω-3-индекса (в среднем около 5% через 6 мес терапии) в нашем исследовании были несколько ниже, чем в работах зарубежных авторов, где защитные концентрации ЭПК и ДГК (ω-3-индекс около 8%) достигались в сроки от 1 до 3 мес [18, 27, 29]. На наш взгляд, это может быть обусловлено как различиями дозировок и лекарственных форм ω-3 ПНЖК в указанных исследованиях, популяционными особенностями, так и особенностями метаболизма ω-3 ПНЖК у пациентов, страдающих ИБС (например, повышением «расхода» ω-3 ПНЖК вследствие активации процессов перекисного окисления липидов). В исследовании H. Rupp и соавт. влияние 1 г ω-3 ПНЖК на ω-3-индекс изучено на здоровых добровольцах [30], а в работе M. Raitt доза ω-3 ПНЖК составляла 1,5 г/сут [18]. На наш взгляд, важно также отметить, что несмотря на прием одной и той же дозы лекарственного препарата, индивидуальные колебания степени прироста ω-3-индекса у наших пациентов были чрезвычайно широкими — от 7,6 до 253,6%. Представляется, что одним из дальнейших направлений исследований должно быть изучение индивидуальных особенностей метаболизма ω-3 ПНЖК у больных, а первым подходом к индивидуализации лечения может быть определение ω-3-индекса эритроцитов перед началом терапии препаратами ω-3 ПНЖК.
Выводы
Прием препарата ω-3 ПНЖК (омакор) в дозе 1 г/сут в течение 6 мес у больных ишемической болезнью сердца усиливает эффект стандартной антиаритмической терапии, уменьшая количество изолированных и парных желудочковых экстрасистол, число пароксизмов неустойчивой желудочковой тахикардии, улучшает показатели турбулетности и вариабельности ритма сердца, увеличивает ω-3-индекс эритроцитов. Необходимо учитывать длительный (более 3 мес) прием омакора при оценке микровольтной альтернации зубца Т во избежание ложноположительных заключений в стратификации риска внезапной сердечной смерти.



