Инфекционный эндокардит (ИЭ) — нередкое угрожающее жизни заболевание сердца, ежегодная заболеваемость которым составляет 3,8 случая на 100 тыс. населения [1]. Современное понимание этиологии этого заболевания включает не только бактерии (грамположительная и грамотрицательная флора), но и дрожжевые и плесневые грибы — кандидозный и аспергилезный эндокардит [1], риккетсии и хламидии [2]. В структуре современного ИЭ велика роль так называемой культуронегативной формы [3].
Известно, что раннее выявление (до 2 мес) заболевания и правильная интерпретация клинических данных служит оптимизации сроков хирургического вмешательства и лучшим ближайшим и отдаленным результатам.
Цель настоящего исследования — оценка значимости комплексной эхокардиографии (ЭхоКГ) в своевременной и полноценной диагностике ИЭ и результатов консервативной и хирургической тактики лечения.
Материал и методы
За период с 1978 по 2013 г. наблюдались 458 пациентов с клапанным ИЭ в возрасте от 12 до 75 лет (средний возраст 49,0±9,3 года, 69,1% мужчин), что составило 13% от всех оперированных больных клапанными пороками сердца. Хроническая сердечная недостаточность (СН) IV функционального класса по классификации Нью-Йоркской ассоциации сердца имелась у 307 (67%) пациентов, III — у 114 (24,9%), II — у 37 (8,1%).
ИЭ возник на фоне исходного ревматического поражения клапанного аппарата сердца в 190 (41,5%) наблюдениях (из них инфекционное поражение протезированных клапанов у 37 пациентов), врожденной аномалии клапанного аппарата (системные дегенеративные заболевания соединительной ткани, двустворчатый аортальный клапан — АК) — в 174 (37,9%), без предшествующей патологии — в 95 (20,6%) случаях.
Активная фаза инфекционного процесса отмечена в 219 (47,8%) наблюдениях, ремиссия — в 239 (52,2%). Внутрисердечное абсцедирование было диагностировано у 23 (5%) больных.
Положительная гемокультура до операции получена у 66% пациентов, наиболее часто возбудителями ИЭ в нашем исследовании были стафилококки различных типов — 72%.
У 34% пациентов имелась культуронегативная форма ИЭ.
Непосредственные причины, приведшие к возникновению ИЭ, были выявлены только у 58% пациентов. При этом главными причинами в общей структуре были простудные заболевания верхних дыхательных путей (26%) и одонтогенный ИЭ (21%).
Обследование больных, поступавших в клинику с подозрением на ИЭ, проводилось по традиционному плану, включавшему клинический, лабораторный и инструментальный методы исследования и исключавшему инвазивные предоперационные исследования.
 Показаниями к хирургическому лечению служили прогрессирующая СН (III—IV стадии по классификации А.Н. Бакулева и Е.А. Дамир), возможность первичного или повторного возникновения эмболического синдрома, перианулярное абсцедирование, отсутствие эффекта от антибиотикотерапии [3]. В активной фазе ИЭ были оперированы 53% пациентов, в стадии ремиссии — 47% .
Показаниями к хирургическому лечению служили прогрессирующая СН (III—IV стадии по классификации А.Н. Бакулева и Е.А. Дамир), возможность первичного или повторного возникновения эмболического синдрома, перианулярное абсцедирование, отсутствие эффекта от антибиотикотерапии [3]. В активной фазе ИЭ были оперированы 53% пациентов, в стадии ремиссии — 47% .
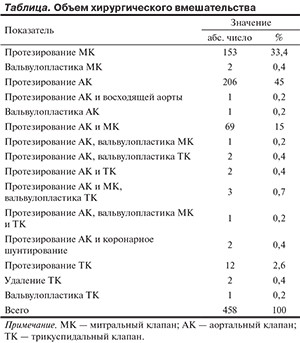
Изолированное поражение АК отмечено у 212 (46,4%) пациентов, митрального клапана (МК) — у 156 (34,2%), трикуспидального клапана (ТК) — у 15 (3,3%). Наиболее тяжелую группу составили пациенты с комбинированным поражением клапанов (2 и более) — МК и АК — 69 (15,2%), АК и ТК — 3 (0,6%), а также МК, АК и ТК — 3 (0,6%). Ранний рецидив ИЭ (в срок до 6 мес) наблюдался в 10,7%, поздний — в 16,1% случаев [3].
Все пациенты были оперированы. Целью операции было не только восстановление нормальной гемодинамики, но и надежная санация очага внутрисердечной инфекции. Объем хирургического вмешательства представлен в таблице.
Комплексная ЭхоКГ включала трансторакальную ЭхоКГ (ТТ-ЭхоКГ), выполненную на приборах SSD-870, 2000, 5500, Sequoja-256, iE 33 с использованием датчиков с частотой 2,4—3,5 МГц, и чреспищеводную ЭхоКГ (ЧП-ЭхоКГ), выполненную на приборах Sonos-1500, 12810M/ XP с применением эндоскопического омнипланового датчика с частотой 5 МГц. Оба вида исследований базировались на одномерной, двухмерной и допплер-ЭхоКГ, включавших импульсноволновую, постоянноволновую, цветовую и тканевую методики. Более высокая частота эндоскопического датчика, отсутствие помех от легких, ребер и жира позволяли получить изображение структур сердца при ЧП-ЭхоКГ более высокого качества, чем при ТТ-ЭхоКГ.
Результаты всех ЭхоКГ верифицировали при непосредственной интраоперационной ревизии с последующим гистологическим исследованием удаленного клапана.
Результаты и обсуждение
Морфологически ИЭ представляет собой воспалительно-деструктивные изменения клапанов и подклапанных структур с формированием вегетаций, воспалительное поражение магистральных сосудов, тромбоэмболические и иммунопатологические изменения в органах и тканях.
Более четверти века усилия ученых мира [4] направлены на неинвазивные (с помощью сначала одномерной, а затем и двухмерной ЭхоКГ) поиски «большого критерия» ИЭ по диагностической схеме Университета Duke в США [5] — так называемых вегетаций (инфицированных тромботических масс) на эндокардиальной поверхности сердца.
При ИЭ чаще всего преобладает изолированное поражение клапанов сердца, что выражается в возникновении полипозно-язвенного эндокардита, легко фрагментирующихся вегетаций, которые могут стать источником эмболии в системе большого и малого круга кровообращения (рис. 1, см. цветную вклейку) или нередко обызвествляются.
В результате естественного течения заболевания или на фоне лечения могут возникнуть язвенные дефекты краевой зоны клапанов (возможны фенестрация и/или фрагментация створок) с формированием различной степени регургитации, а также расплавление и/или отрыв хорд с усилением ранее появившейся регургитации или появлением «новой» регургитации; распространение инфекционного процесса на перивальвулярную область с формированием параанулярного абсцесса (рис. 2, см. цв. вклейку); деструкция эндокарда с распространением процесса на миокард и деструкция стенки при пристеночных вегетациях с формированием фистул или дисфункции папиллярных мышц; наиболее редкое осложнение вегетативного процесса при ИЭ — формирование абсцесса створки клапана [6].
По нашему мнению, обнаружение с помощью ТТ-ЭхоКГ и/или ЧП-ЭхоКГ вегетаций и абсцессов миокарда или клапана можно считать прямыми признаками ИЭ. При этом появление новой или усилившейся регургитации, возникновение фистулы и/или отрыва хорд клапана можно отнести к разряду косвенных признаков ИЭ.
Существует несколько образных определений для изображения вегетаций [7]. Среди полярных сравнений внешнего вида вегетаций следует выделить ламинарные (малоподвижные, «сидячие», более правильной формы) и веррукозные (стебельчатые, более неправильной формы мобильные образования), прикрепляющиеся к створкам клапана, хордам, стенкам камер. В типичном случае в острой фазе заболевания эхогенность вегетаций обычно невысока, они подвижны сообразно с кровотоком. После курса антибиотикотерапии формируются вегетации малоподвижные, повышенной эхогенности (нередко кальцинированные, «леченые» вегетации).
Существует понятие вегетаций малых размеров (диаметром 5 мм и менее) и больших размеров (более 5 мм). В нашей практике вегетации варьировались от 3 мм до 2 см, кальцинированные вегетации были отмечены в 11% наблюдений.
Обычно первоначальное место прикрепления вегетаций располагается по направлению кровотока: для МК и ТК – это предсердная поверхность створок клапана, а для АК и клапана легочной артерии — желудочковая поверхность полулуний клапана. По мере прогрессирования заболевания эта закономерность нередко нарушается.
Чувствительность двухмерной ЭхоКГ в выявлении вегетаций во многом зависит от формы ИЭ, размеров вегетаций, локализации и выбора ультразвукового «окна». Так, в нашем исследовании чувствительность ЭхоКГ при первичном ИЭ была самой высокой и составила 96%.
При вторичном ИЭ нативного клапана к ранее существовавшим признакам приобретенного или врожденного порока сердца присоединялись в динамике проявления поражения другого клапана или усугубление изменений уже пораженного клапана. При этом разглядеть на утолщенных в различной степени и гетерогенных в своей эхогенности клапанных и подклапанных структурах свежие (а еще труднее «леченые») вегетации нередко не представлялось возможным. Этими причинами объяснялась более низкая чувствительность ЭхоКГ в выявлении вегетаций при вторичном ИЭ, которая в наших наблюдениях равнялась 59%. Кроме того, фиброз и кальциноз клапанных структур при ревматическом поражении клапана могут имитировать вегетации, однако имевшаяся более высокая эхогенность и более низкая подвижность отличали их в ряде случаев от вегетаций. При внедрении в практику тканевой допплер-ЭхоКГ появилась возможность точнее идентифицировать вегетации по присущей им разнице скоростей по сравнению с движением соответствующей структуры сердца (см. рис. 1Б). Чувствительность ЭхоКГ в выявлении ИЭ протезированных клапанов крайне низка и составила в наших наблюдениях 2,7%. Как и при невозможности выявления обычных тромботических масс на дисковых протезах, шаровых и кальцифицированных биологических протезах, низкая эффективность выявления вегетаций протезированного клапана объясняется интенсивными эхосигналами от структур манжеты, стоек и запирательного элемента протеза (феномен «вертикализации и горизонтализации эхосигналов») в любой позиции, перекрывающих менее эхогенную информацию о вегетациях на протезе [8].
Появление в 1993 г. в арсенале диагностических средств ЧП-ЭхоКГ позволило значительно улучшить распознавание вегетаций при вторичном эндокардите и даже в случаях их малых размеров. Чувствительность ЧП-ЭхоКГ в выявлении вегетаций при различных формах ИЭ, а также при вегетациях малых размеров превышает представленные выше данные для ТТ-ЭхоКГ и составляет при первичном ИЭ 97,9%, при вторичном ИЭ — 92%, при протезном эндокардите — 90% [9–12].
Мы не отметили связи между величиной, локализацией, формой, мобильностью вегетаций и риском развития эмболических осложнений.
Приступая к ЭхоКГ, необходимо помнить о возможности ложноположительного выявления вегетаций при разрыве створок, отрыве хорды, вибрации утолщенной хорды под воздействием аортальной регургитации, миксоматозной дегенерации створок с изображением их по типу «просовидных» включений, дегенеративно измененных створках биопротеза, гипермобильных, избыточных по длине хордах, асептических вегетациях при эндокардите Либмана—Сакса [13], при антифосфолипидном синдроме [12], тромботической стадии эндокардита Леффлера, объемных образованиях — папиллярных фиброэластомах, исходящих из эндокарда клапана, подклапанных структурах стенки камеры [14].
Важность комплексной ЭхоКГ в выявлении вегетативных повреждений неотделима от оценки нарушений внутрисердечной гемодинамики и осложнений ИЭ с вовлечением других структур.
Распространение инфекционного процесса за пределы клапана может вызвать перивальвулярное или миокардиальное поражение. В нашей практике мы встретились с 29 случаями параанулярных абсцессов. Чувствительность ТТ-ЭхоКГ в выявлении этой патологии составила 27%, ЧП-ЭхоКГ — 96%.
Из этого числа у 4 пациентов имелись абсцессы передней створки МК, которые были зафиксированы при ЧП-ЭхоКГ и выглядели как миксоматозная дегенерация при ТТ-ЭхоКГ (у двух из них абсцесс створки примыкал к фиброзно-митральному контакту и сопровождался парамитральным абсцессом, не выявленным при ЧП-ЭхоКГ). Непременной отличительной особенностью свежих абсцессов являлась эхонегативность образования, примыкающего к клапану, в то время как длительно существующий абсцесс был эхопозитивен вследствие содержащегося в нем гнойного детрита. Большие трудности существовали при выявлении опорожнившегося абсцесса (как правило, операционные находки).
Отрыв хорд МК гемодинамически значимого порядка имелся у 10% больных и сопровождался триадой признаков на ЭхоКГ: нарушение кооптации створок с провисанием краевой зоны поврежденной створки в левое предсердие во время систолы, «цепообразное» движение створки при отрыве нескольких хорд и эксцентричная струя клапанной регургитации противоположной направленности по отношению к поврежденной створке.
Перфорацию створки выявили у 17% пациентов. При этом устье струи регургитации локализовалось в проекции створки. Среди наблюдений ЧП-ЭхоКГ уникальным следует считать перфорацию створки в зоне ее абсцесса и пролабирование в область перфорации хорд (рис. 3, см. цв. вклейку).
Межкамерные фистулы были обнаружены нами при ЭхоКГ в двух случаях при парааортальном абсцессе с сообщением с правым предсердием узкой струей и при перфорации правого синуса Вальсальвы с сообщением с правым желудочком при вторичном ИЭ.
Характеристика гемодинамических нарушений была основана на оценке выраженности клапанной регургитации. В нашей практике она базировалась на полуколичественной оценке на основе цветового допплеровского картирования и соответствовала у всех оперированных пациентов II—III или III степени, а при поражении клапана легочной артерии — II степени.
В настоящее время следует признать, что к числу наиболее недооцененных аспектов в нашей практике относилась оценка функции миокарда при ИЭ. В структуре летальных и нелетальных осложнений основное место занимала острая сердечно-сосудистая недостаточность (58,3 и 79% соответственно), что свидетельствовало о недооценке исходного состояния миокарда [1]. По данным литературы, становится очевидным, что до настоящего времени не установлены четкие критерии недостаточности миокарда при ИЭ.
Важной особенностью ИЭ является вовлечение миокарда в патологический процесс. При макроскопическом изучении препаратов находят некротическое поражение миокарда разной величины и протяженности в 3—9% случаев, фиброзные изменения в 4—64%, папиллярные некрозы в 58%. В сосудах миокарда обнаруживают эндо- и периваскулиты, дистрофию эндотелиальных клеток капилляров. В крупных коронарных артериях нередко находят эмболы, формирующие микотические аневризмы.
Расширяющей кругозор клинициста является классификация М.А. Гуревич и соавт. (2001) различных форм поражения миокарда при ИЭ, составленная на основе световой и электронной микроскопии [2]: очаговый (ограниченный) миокардит; диффузный (распространенный) миокардит; продуктивный эндоваскулит с очагами некроза и кардиосклероза в миокарде; эмболический инфаркт миокарда; постинфарктный кардиосклероз; очаговая или диффузная миокардиодистрофия; микроциркуляторные изменения в миокарде.
Поэтому неудивительным является обнаружение у отдельной группы пациентов зон гипо- и нормокинезии при выраженной регургитации, вариации фракции изгнания от 50 до 56% (т.е. не чрезмерных, характерных для выраженной объемной перегрузки левого желудочка сердца).
Консервативное и хирургическое лечение инфекционного эндокардита. Первоначальный выбор эмпирического лечения антибиотиками зависит от нескольких положений: получал ли пациент предварительную антибактериальную терапию; развития инфекции на нативном или протезированном клапане (и в какие сроки после операции — ранний или поздний протезный ИЭ); знания местной эпидемиологической обстановки, особенно резистентности к антибиотикам и специфичных подлинных культуронегативных возбудителей. Схемы антибактериальной терапии подробно отражены в рекомендациях Европейского общества кардиологов (2009) [15].
Эффективность курса антибактериальной терапии оценивают в течение 7—10 дней, когда эмпирически или, согласно результатам посевов и чувствительности микрофлоры, удается добиться эффекта в борьбе с инфекцией. Если после смены 2—3 комбинаций антибактериальных препаратов или по прошествии 7—10 дней не наблюдается положительной динамики, ставят вопрос о необходимости хирургической санации [2, 3, 15, 16].
Показаниями к хирургическому лечению больных активным клапанным ИЭ левых отделов сердца, согласно рекомендациям Европейского общества кардиологов (2009) [15], служат СН, неконтролируемая инфекция и предотвращение эмболических осложнений ИЭ.
Основными показаниями к операции у больных ИЭ нативных клапанов, как и у пациентов с протезным ИЭ, являются [2, 3, 15—18]:
1) СН; 2) неконтролируемая инфекция; 3) предупреждение эмболии (или ее рецидива); 4) внутрисердечное (перианнулярное) абсцедирование.
Неотложным (в течение ближайших 24 ч) хирургическим вмешательствам подлежат пациенты с СН с тяжелой дисфункцией протеза (несостоятельностью или обструкцией), вызывающей рефрактерный отек легких или кардиогенный шок; с СН и с фистулой в камеру сердца или перикард, вызывающей рефрактерный отек легких или кардиогенный шок.
Срочному (в течение нескольких дней) хирургическому вмешательству подлежат пациенты с тяжелой дисфункцией протеза и персистирующей СН; с локальной неконтролируемой инфекцией (абсцесс, ложная аневризма, фистула, большие вегетации); с неконтролируемой инфекцией, если возбудителями инфекции являются грибы или мультирезистентные микроорганизмы; с неконтролируемой инфекцией с персистирующей лихорадкой и положительными гемокультурами более 7—10 дней; с неконтролируемой инфекцией, вызванной стафилококками или грамотрицательными бактериями (большинство случаев раннего ИЭ протезов клапанов сердца); с повторными эмболиями, несмотря на соответствующую антибиотикотерапию; с большими вегетациями (более 10 мм) и другими предикторами осложненного течения (СН, персистирующая инфекция, абсцесс); с выявленными очень большими вегетациями (15 мм).
Плановому (после 1—2 нед антибактериальной терапии) хирургическому лечению подлежат пациенты с аортальным или митральным ИЭ с тяжелой регургитацией с СН или без СН.
СН — наиболее частое показание к операции при клапанном ИЭ и наблюдается у 60% больных [3]. Причинами СН при клапанном ИЭ являются деструкция, разрыв створок клапана, вызывающие острую регургитацию, внутрисердечная фистула, реже — клапанная обструкция из-за прикрытия отверстия клапана большой вегетацией.
Неконтролируемая инфекция служит вторым по частоте показанием к операции при клапанном ИЭ, включает персистирующую инфекцию, инфекцию с резистентными к антибиотикам микроорганизмами и локальную неконтролируемую инфекцию.
Персистирующая инфекция (более 7—10 дней) сопровождается сохранением лихорадки и может быть связана с несколькими факторами: недостаточной антимикробной терапией, устойчивостью микроорганизмов, инфицированием внутривенных систем, локальной неконтролируемой инфекцией, эмболическими осложнениями или внесердечной инфекцией, побочными действиями антибиотиков. При сохранении лихорадки считается необходимым произвести замену внутривенных систем, повторные лабораторные исследования, исследование гемокультуры, ЭхоКГ и необходимые исследования для поиска внутри- или внесердечной инфекции [15].
Наиболее частой причиной возникновения неконтролируемой инфекции являются периклапанные осложнения — абсцессы, ложные аневризмы и фистулы [2, 16].
Параклапанный абсцесс наиболее часто встречается после протезирования АК (56—100%) и ИЭ нативного клапана аорты (10—40%) [17, 18].
Ложные аневризмы и фистулы — тяжелые осложнения ИЭ.
Послеоперационная летальность остается высокой — 41%, а возбудителем в 46% случаев является Staphylococcus aureus [17, 18].
Другие осложнения встречаются реже и включают дефект межжелудочковой перегородки, атриовентрикулярную блокаду III степени и острый коронарный синдром.
При персистирующей инфекции, когда только антибактериальной терапии недостаточно и исключены внесердечные причины лихорадки, а лихорадка и положительные гемокультуры сохраняются, необходимо хирургическое лечение.
К признакам локально-неконтролируемой инфекции относят увеличение размеров вегетации, формирование абсцессов, ложных аневризм и образование фистулы. При этих состояниях, как правило, сохраняется и персистирующая лихорадка.
Важным фактором в лечении больных ИЭ является эрадикация первичного очага экстракардиальной инфекции. Согласно рекомендациям Европейского общества кардиологов (2009) [15], если операция не является экстренной, вероятный первичный очаг экстракардиальной инфекции должен быть ликвидирован до хирургического вмешательства на сердце.
В нашем исследовании общая летальность составила 8,1%. В группе пациентов, оперированных в активной стадии ИЭ, летальность составила 10,5%, в стадии ремиссии — 7,1%. В зависимости от локализации инфекционного процесса летальность составила при поражении АК 7,5%, МК — 9,6%, МК и АК — 10,1%, ТК — 6,6%.
Отдаленные результаты хирургического лечения больных клапанным ИЭ были прослежены у 350 из них, что составляет 76,4% от всех выписанных пациентов. Сроки наблюдения составили от 1 мес до 26 лет (в среднем 8,9±4,5 года).
Актуарная выживаемость к концу первого года составила 89,8±4,7%, через 5 лет после операции — 78,6±4,7%, через 10 лет — 66,2±3,9%.
Ранний рецидив ИЭ (в сроки до 6 мес после операции) выявлен у 38 (10,8%) больных, поздний — у 56 (16%).
По поводу раннего рецидива реоперирован 31 пациент, 7 лечились консервативно. Летальность среди реоперированных составила 9,6% (умерли 3 пациента). Из 56 больных с поздним рецидивом ИЭ повторно оперированы 45, летальность составила 6,6% (умерли 3 пациента). Консервативную терапию получали 11 пациентов, из которых 4 умерли.
Нарастающая СН является основной причиной летального исхода в отдаленном периоде наблюдения (у 54,4% пациентов). Причиной СН может служить не только ревматическое поражение миокарда с постепенным снижением его насосной функции, но и токсическое поражение сердечной мышцы (токсический миокардит) при ИЭ как в исходе, так и в случае его рецидива.
В группе пациентов, у которых наблюдались нелетальные осложнения, также преобладает СН (у 21,9% больных), обусловливающая необходимость комплексной кардиальной терапии.
Наименьшая выживаемость в отдаленном периоде наблюдения отмечена в группе пациентов с инфекционным поражением МК и АК: через 5 лет после операции выжили 66,3%, а через 10 лет — 52,7%. Это, несомненно, обусловлено наличием двух протезов клапанов и соответственно исходной тяжестью состояния пациентов, большим риском рецидивирования ИЭ и большей вероятностью развития характерных для механических протезов осложнений (дисфункция протеза, тромбоз, тромбоэмболический синдром и т.д.).
Стабильные результаты оказались в группах с изолированным поражением МК или АК: при локализации ИЭ на МК 5-летняя выживаемость больных составила 85,3%, 10-летняя — 77,1%; при поражении АК через 5 и 10 лет после операции выживаемость составила 86 и 83,4% соответственно.
При ИЭ ТК 5-летняя выживаемость составила 74,3%, 10-летняя — 69,4%.
Как свидетельствует сравнительное изучение функциональных результатов хирургического лечения ИЭ, наилучшими они оказались при вмешательствах по поводу первичной его формы. В группе пациентов с первичным ИЭ к 1-му году после операции выжили 94,5%, к 5-му году — 87%, к 10-му — 85,5% больных. В группе пациентов с вторичным ИЭ через 1, 5 и 10 лет наблюдения выживаемость составила 86,3%, 77,4 и 70,6% соответственно.
Вероятность рецидива ИЭ у пациентов, оперированных в ремиссии инфекционного процесса, минимальна и через 1 год после операции составила 7%. В то же время частота рецидива ИЭ в группе больных, оперированных в активной стадии ИЭ, через 1 год после вмешательства составила 17,2%. Через 5 лет наблюдения в группе пациентов, оперированных в стадии ремиссии, рецидивы ИЭ отсутствовали у 77,2%, а в группе, оперированных в активной стадии ИЭ, — у 71,4%. Количество рецидивов у больных, оперированных в активной стадии инфекционного процесса и в стадии ремиссии, через 5 лет после операции уменьшилось, и различия между этими двумя группами стали недостоверными.
Противопоказания к хирургическому лечению активного клапанного ИЭ в настоящее время четко не определены.
Относительным противопоказанием служит перенесенная эмболия артерий головного мозга, так как искусственное кровообращение существенно увеличивает риск геморрагической трансформации эмболического инсульта с последующим нарастанием неврологических нарушений.
Риск послеоперационного неврологического ухудшения обычно низкий после бессимптомной церебральной эмболии или преходящих ишемических атак и, если показания сохраняются, то хирургическое лечение рекомендуется неотложно [15, 16].
Операция на сердце после ишемического инсульта не противопоказана, если неврологический статус не ухудшается. Данные относительно оптимального интервала времени между инсультом и кардиохирургическим вмешательством противоречивы из-за отсутствия контролируемых исследований.
Если кровоизлияние в мозг было исключено с помощью компьютерной томографии головного мозга и неврологические повреждения невыраженные, то операция показана при наличии СН, неконтролируемых инфекциях, абсцессах.
При сохраняющемся высоком риске эмболии операцию не следует откладывать, она может проводиться с относительно низким неврологическим риском (3—6%) и хорошей вероятностью полного неврологического выздоровления [16].
В случаях с внутричерепным кровоизлиянием неврологический прогноз хуже, а операция должна быть отложена, по крайней мере, на 1 мес. Если необходима срочная кардиохирургическая операция, то тесное сотрудничество с нейрохирургами является обязательным.
Больные ИЭ клапанов сердца нуждаются в индивидуальном подходе для определения стратегии лечения, с соблюдением в то же время тех стандартов и рекомендаций, которые в настоящее время разработаны экспертами на основании широкого клинического опыта с учетом современных методов диагностики и возможностей антибиотикотерапии.
Важно придерживаться тех показаний и сроков хирургического лечения, выполнение которых позволяет надеяться на благоприятный прогноз при лечении пациентов с этой тяжелой патологией.
Выводы
- Эхокардиография и чреспищеводная эхокардиография являются диагностическими процедурами выбора в выявлении клапанных вегетаций и параанулярных абсцессов как прямых признаков инфекционного эндокардита и таких косвенных признаков, как клапанная регургитация, отрыв хорд, фистула и несостоятельность миокарда.
- Чувствительность чреспищеводной эхокардиографии значительно превышает чувствительность эхокардиографии в диагностике параанулярных клапанных абсцессов, вегетаций при вторичном инфекционном эндокардите нативных и протезированных клапанов сердца, а также вегетаций малых размеров.
- Комплексная эхокардиография значительно облегчает процесс формирования правильного диагноза, особенно у пациентов с культуронегативной формой и атипичной формой течения инфекционного эндокардита.
- Комплексная эхокардиография эффективна в принятии клинического решения о необходимости и выборе времени хирургического вмешательства.
- В отсутствие абсолютных показаний к хирургическому вмешательству консервативная (антибактериальная) терапия должна проводиться в сроки до 7—10 дней, при отсутствии эффекта необходимо рассматривать вопрос о хирургической санации очага внутрисердечной инфекции.
- Основными целями хирургического вмешательства при инфекционном эндокардите клапанов сердца являются полное удаление/санация инфицированных тканей и восстановление или замена поврежденных клапанов сердца.
- Хирургическое лечение в активной фазе инфекционного эндокардита показано пациентам с факторами высокого риска, когда возможность излечения антибиотиками маловероятна, а также больным, состояние органов и систем которых дает основание рассчитывать на выздоровление.



