Фибрилляция предсердий (ФП) — самый распространенный вид нарушений ритма сердца, который встречается у 0,4—1% населения [1]. Наличие у пациентов ФП ассоциируется с двукратным увеличением смертности, в значительной степени обусловленной развитием инсульта [2, 3].
Проблема лечения ФП в первую очередь связана с низкой эффективностью антиаритмической терапии [4], поэтому с середины 80-х годов прошлого века активно развиваются катетерные методы лечения. В настоящий момент действующими редакциями рекомендаций по лечению ФП являются Европейские рекомендации, версии 2012 г. [5], рекомендации Российского кардиологического общества, также же версии 2012 г. [6], и самые новые — рекомендации Всероссийского научного общества аритмологов по проведению электрофизиологических исследований, абляции и имплантируемым устройствам, версии 2013 г. [7].
Согласно данным, приведенным в этих документах, к настоящему моменту лишь одно преимущество радиочастотной абляции (РЧА) перед другими методами лечения ФП четко доказано — устранение симптоматических эпизодов аритмии [8, 9].
Однако в ряде исследований с использованием имплантируемых мониторов электрокардиограммы показано, что у очень многих пациентов с хорошим клиническим эффектом от вмешательства имеются эпизоды бессимптомной аритмии [10, 11], при этом устойчивые, т.е. представляющие угрозу тромбоэмболических осложнений, — более чем у 1/4 всех пациентов без клинических проявлений патологии. По данным некоторых исследований, частота так называемых немых ишемических инсультов значительно варьирует при различных техниках абляции и составляет от 4 до 37% [12]. Хотя их клиническое значение остается неясным, эти риски необходимо учитывать при назначении послеоперационной терапии.
Наиболее известный «фигурант» в профилактике постабляционных тромбоэмболий — хорошо зарекомендовавший себя препарат варфарин. Его главное преимущество — большое количество накопленных за несколько десятилетий использования данных относительно его эффективности в предотвращении тромбоэмболий, и в первую очередь, ишемических инсультов у больных с ФП, в том числе после РЧА [13—16].
В то же время показатели безопасности у варфарина в течение предшествующих десятилетий его применения оставляли желать лучшего из-за сложностей подбора адекватной индивидуальной дозировки [17]. Даже с внедрением в клиническую практику фармакогенетического тестирования ситуация в масштабах общества существенно не улучшилась. Поэтому внимание исследователей и практикующих врачей обращено в сторону новых пероральных антикоагулянтов, при применении которых не требуются лабораторный контроль и индивидуальная коррекция дозы, в частности, ингибитора тромбина дабигатрана. Однако результаты исследования RE-LY не имеют прямого отношения к категории пациентов, подвергающихся катетерной абляции. Если мы прицельно взглянем именно на эту категорию больных, проведенные к настоящему моменту исследования по оценке эффективности и безопасности перипроцедуральной гипокоагуляции дабигатраном характеризовались отсутствием единства плана и схем его назначения, рандомизации, а также небольшим числом наблюдений [18—21]. Поэтому в российских рекомендациях эти препараты упоминаются как возможная альтернатива варфарину, но при этом указывается, что данные о пользе такой замены пока противоречивы, и поэтому в рекомендательной части оставлен только варфарин.
Цель исследования — оценить эффективность и безопасность применения дабигатрана в сравнении с варфарином после выполнения катетерной РЧА при ФП.
Материал и методы
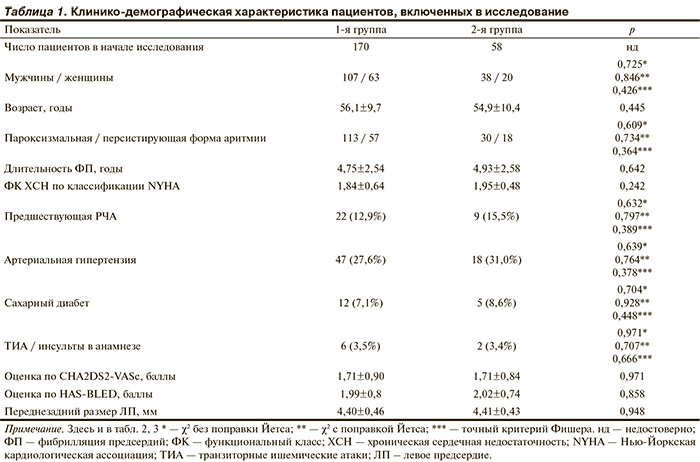
В одноцентровое ретроспективное исследование включены 228 пациентов, наблюдавшихся в Аритмологическом центре ФГБУ НИИ КПССЗ СО РАМН за период с января 2012 г. по февраль 2014 г. Клинико-демографическая характеристика пациентов представлена в табл. 1.
Критериями включения в исследование явились катетерная РЧА при ФП в объеме антральной изоляции, в том числе дополненная любым методом модификации субстрата (РЧА вегетативных ганглионарных сплетений, линейные РЧА или расширенная антральная РЧА) [22], отсутствие противопоказаний к приему дабигатрана и варфарина. Из исследования исключали субъектов с клиренсом креатинина менее 30 мл/мин, а также тех, у кого при чреспищеводной эхокардиографии за сутки до РЧА выявлялся внутрисердечный тромбоз.
Исходно пациенты были представлены двумя группами: 170 пациентам (1-я группа) назначали варфарин в индивидуально подобранной дозе до достижения целевого уровня международного нормализованного отношения (МНО) 2,0—3,0, а 58 пациентам (2-я группа) — дабигатран в дозе 150 мг 2 раза в сутки.
Прием обоих препаратов начинался не позднее чем за 30 дней до вмешательства и продолжался не менее чем 90 дней после РЧА. В обеих группах применяли прерывистую схему гипокоагуляции с терапией «моста» эноксапарином. При этом варфарин отменяли за 24 ч до процедуры, дабигатран — за 12 ч, а возобновляли прием обоих препаратов через 24 ч после РЧА.
Интраоперационно гипокоагуляцию поддерживали с помощью непрерывной инфузии нефракционированного гепарина до достижения активированного времени свертывания (АВС) 300—350 с.
Во всех случаях выполняли антральную изоляцию легочных вен, которую у больных персистирующей ФП дополняли тем или иным методом модификации субстрата (табл. 2).
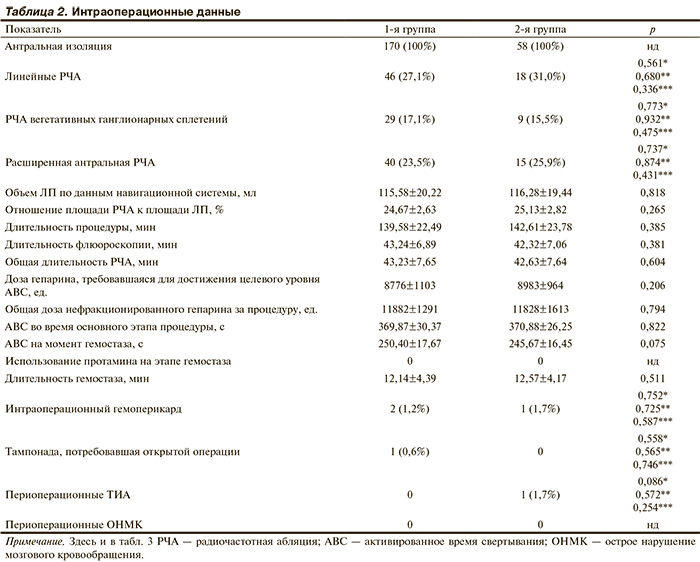
Интраоперационно оценивали следующие показатели: длительность процедуры, флюороскопии и РЧА, АВС в течение основного этапа процедуры и на момент гемо-стаза, доза гепарина, требовавшаяся для достижения целевого АВС, продолжительность компрессии сосудов до достижения гемостаза, количество геморрагических и тромбоэмболических осложнений.
В ближайшем и отдаленном послеоперационном периоде оценивали количество тромбоэмболических и геморрагических осложнений, а также частоту достижения целевого МНО у пациентов, принимающих варфарин (табл. 3).
Статистическую обработку данных проводили в программе Statistica v. 6.0 с использованием критериев Стьюдента t, χ2 с поправкой Йетса и точного критерия Фишера р. Нормальность числовых значений определяли по критерию Колмогорова—Смирнова.
Результаты
Согласно представленным в табл. 1 данным, обследованные субъекты имели длительный аритмический анамнез. В обеих группах приблизительно у 1/3 пациентов имелась персистирующая форма аритмии. Однако при этом наблюдались в среднем небольшие размеры ЛП и низкие оценки по шкалам CHA2DS2-VASc и HAS-BLED.
Во всех случаях антральной изоляции и линейных воздействий в ЛП электрофизиологически подтвержден двунаправленный блок проведения через линии радиочастотных повреждений. Приблизительно у 2/3 пациентов антральная изоляция дополнялась тем или иным методом модификации субстрата (см. табл. 2). При пароксизмальной ФП в основном это было связано с интраоперационной индукцией устойчивой аритмии, что интерпретировалось как необходимость для расширения объема вмешательства. Группы не различались между собой по проведению процедуры, ее объему, продолжительности, времени флюороскопии.
В обеих группах понадобилась приблизительно одинаковая доза гепарина для достижения целевого АВС. При этом эффективный гемостаз во всех случаях осуществлялся путем компрессии мест катетеризации сосудов, и ни в одном случае не потребовалась инактивация гепарина протамином. Всего в группе варфарина зарегистрировано 2 случая гемоперикарда, один из которых обусловил необходимость ревизии и ушивания перфорационного отверстия в области основания ушка левого предсердия вследствие кровотечения, не прекращающегося на фоне консервативных мероприятий. Во втором случае, а также при единственном гемоперикарде в группе дабигатрана достаточно было чрескожного дренирования и частичной инактивации гепарина.
В группе варфарина не отмечено периоперационных цереброваскулярных осложнений, в группе дабигатрана — один случай транзиторной ишемической атаки в вертебробазилярном бассейне, симптоматика которой разрешилась в течение 3 ч, а при нейровизуализации не обнаружено очагового поражения головного мозга. Летальных случаев не было. Все перечисленные наблюдения по частоте развития статистически значимо не различались между группами.
Состояние всех пациентов прослежено в течение 1 года с момента выполнения РЧА. В эти сроки произошло частичное перемещение субъектов между группами, в большинстве случаев связанное с желанием пациентов (см. рисунок). У 57 (25%) обследованных с оценкой по шкале CHA2DS2-VASc 2 балла в сроки от 3 до 12 мес антикоагулянты были отменены ввиду отсутствия ФП по данным опроса и серийного 7-суточного мониторирования электрокардиограммы. Таким образом, к концу периода наблюдения в группе варфарина осталось 74 пациента.
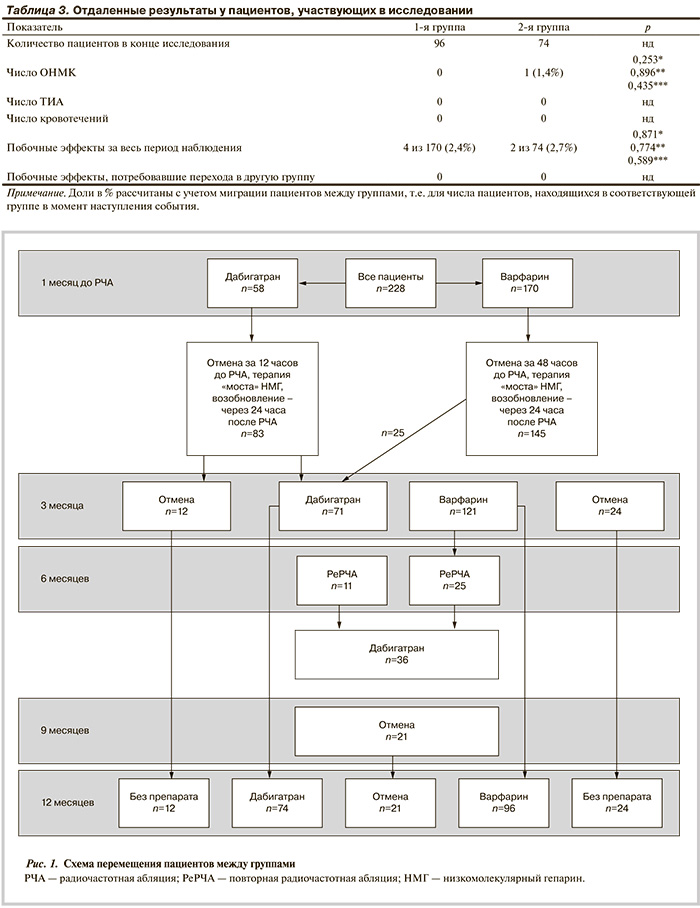
В указанные сроки острое нарушение мозгового кровообращения (ОНМК) наблюдалось в единственном случае в группе дабигатрана. Однако, как выяснилось при изучении анамнеза, пациент самостоятельно уменьшил дозу препарата с 150 мг 2 раза в сутки до 110 мг 2 раза в сутки. Тромбоэмболических осложнений не было в обеих группах. В группе варфарина все пациенты достигли целевого МНО. Побочные эффекты в виде легкой диспепсии, не потребовавшей отмены препарата, наблюдались в группе дабигатрана в 2,7% случаев, в группе варфарина — в 2,4%. Все перечисленные осложнения по частоте развития также статистически значимо не различались между группами.
Обсуждение
В настоящей работе продемонстрировано, что использование дабигатрана в качестве антикоагулянта, назначаемого после катетерной РЧА при ФП, является эффективной и безопасной альтернативой традиционно применяемому для этих целей варфарину. Учитывая отсутствие сложностей при подборе дозы дабигатрана, его использование у больных данной категории оказывается легкой и не требующей тщательного контроля задачей.
Нужно заметить, что к настоящему времени опубликовано достаточно большое количество исследований, посвященных данному вопросу [19, 23—32]. Большинство из них, как и наше, были ретроспективными или нерандомизированными, в основном проводились на группах больных, более малочисленных, чем представленные в настоящей работе. В ряде случаев отсутствовала группа контроля, либо группы различались по клинико-демо-графическим характеристикам. Тем не менее авторы всех этих работ пришли к выводам, аналогичным нашим, несмотря на то что структура этих исследований и примененные схемы назначения дабигатрана были очень вариабельными.
Полученные в настоящем исследовании данные по безопасности и эффективности в обеих группах оказались сопоставимыми с опубликованными в указанных ранее работах, хотя мы использовали более агрессивный протокол интраоперационной гипокоагуляции и несколько модифицированную схему прерывистого назначения варфарина.
Настоящее исследование было ретроспективным, что связано с отсутствием в действующих отечественных рекомендациях выраженного в явной форме разрешения к использованию дабигатрана вместо варфарина у больных данной категории. В то же время выполнение аналогичного проспективного сравнения также было бы ограничено невозможностью «слепой» рандомизации в условиях легкой доступности для пациента информации о том, какой именно препарат он принимает.
Поэтому, резюмируя изложенное, в настоящее время при выполнении катетерных РЧА следует рассматривать возможность использования для антикоагулянтной терапии дабигатрана с учетом предпочтений пациента.
Вывод
Дабигатран может рассматриваться как альтернатива варфарину для гипокоагуляции у пациентов, перенесших катетерную радиочастотную абляцию при фибрилляции предсердий.



