В настоящее время климатические воздействия, в частности волны аномально высоких или низких температур, рассматриваются как один из важных факторов, оказывающих негативное влияние на здоровье населения. Наибольший вклад в увеличение общей смертности во время температурных волн вносит смертность от сердечно-сосудистых заболеваний (ССЗ) [1—3]. Летняя жара, даже не выходящая за границы климатической нормы, ассоциируется с увеличением числа сердечно-сосудистых осложнений (ССО) и ухудшением качества жизни у больных ССЗ [4]. В частности, пребывание в условиях повышенной температуры окружающей среды может провоцировать увеличение образования активных форм кислорода (АФК), продуктов свободнорадикального окисления (СРО) и развитие окислительного стресса (ОКС) в организме, что ассоциируется с худшей адаптацией к жаре. Роль ОКС в процессах нормальной и патологической адаптации к высоким температурам позволяет выдвинуть гипотезу об использовании в качестве адаптогенов препаратов с антиоксидантными свойствами. Одним из них является мельдоний (милдронат, «Фармстандарт») Данные экспериментальных и клинических исследований свидетельствуют о том, что мельдоний снижает уровень продуктов перекисного окисления липидов (ПОЛ) в крови и тканях за счет активации защитных антиоксидантных ферментов [5]. Адапогенные свойства препарата объясняются также его способностью восстанавливать равновесие между доставкой и по-требностью клеток в кислороде, устранять накопление токсичных продуктов обмена в клетках, защищая их от повреждения, что актуально в условиях повышенной нагрузки, а также общим тонизирующим воздействием на организм. Эти свойства позволяют предположить целесообразность добавления милдроната к базовой терапии ССЗ в период волн жары.
Цель настоящей работы: оценить влияние мельдония на ОКС, состояние гемодинамики и качество жизни больных ССЗ в условиях экстремальных климатических воздействий (летней жары).
Материал и методы
В исследование были включены 56 больных ССЗ в возрасте 38—75 лет, постоянно проживающих в Москве и Московской области. Больные находились на подобранной гипотензивной, антиангинальной, гиполипидемической терапии (табл. 1), которая оставалась неизменной на протяжении периода исследования. В исследование не включали больных острым инфарктом миокарда (ОИМ) или острым нарушением мозгового кровообращение (ОНМК), перенесенными менее 6 мес назад, острым коронарным синдромом, злокачественными новообразованиями, эндокринными заболеваниями в стадии декомпенсации, почечной недостаточностью (содержание креатинина в сыворотке крови >133 мкмоль/л у мужчин и >124 мкмоль/л у женщин), печеночной недостаточностью, хронической сердечной недостаточностью III—IV функционального класса. Больные методом таблиц были рандомизированы в 2 группы: группа активного ведения (М), в которой помимо стандартной терапии назначали милдронат 250 мг по 1 капсуле 2 раза в сутки перед едой в течение 3 летних месяцев, и контрольная группа (К), в которой больные получали только стандартную терапию. Группы были сопоставимы по основным клинико-демографическим характеристикам (см. табл. 1).

Всем больным проводили комплексное обследование, включающее осмотр, сбор анамнеза, офисное измерение артериального давления (АД). Больным также предлагали для заполнения визуальную аналоговую шкалу (ВАШ) для оценки качества жизни и специальный опросник для пациентов, подвергшихся влиянию жары. Как конечные точки рассматривались ОИМ, ОНМК, госпитализации, вызовы скорой медицинской помощи («03»), гипертонические кризы, внеплановые визиты к врачу. Кроме того, нами рассматривалась комбинированная конечная точка (ККТ) — количество нежелательных явлений в период жары (ККТж) и после ее окончания (ККТп) за аналогичный период времени.
ККТ=(ОИМ+ОНМК+госпитализации+внеплановые визиты к врачу+гипертонические кризы+вызовы «03»).
Для оценки уровня ОКС определяли содержание окисленных липопротеидов низкой плотности (окЛНП) в плазме крови, используя иммуноферментный набор MercodiaOxidized LDL ELISA. Содержание продуктов, реагирующих с 2-тиобарбитуровой кислотой (преимущественно малоновый диальдегид — МДА) определяли в плазме крови, используя диагностические тест-наборы фирмы «АГАТ». Активность супероксиддисмутазы (СОД) в эритроцитах определяли, используя диагностические тест-наборы RANSOD. На основании результатов анализов рассчитывали отношение МДА/СОД, характеризующее «окислительный потенциал» крови (для расчетов использовали показатели содержания МДА в нмолях/л и активности СОД в ед/г гемоглобина).
Дизайн исследования. 0 визит (исходный). Май 2012 г. Отбор пациентов и их рандомизация в одну из 2 групп: приема мельдония (милдроната, «Фармстандарт», Россия) и группу контроля. С 01.06.12 — начало приема препарата.
Первый визит был запланирован в случае наступления жары (максимальная температура более 29 °С). Такая температура рассматривается как «пороговая» для жителей зоны умеренного климата [6]. За период с 9 июля по 9 августа 2012 г. температура, равная и превышающая «пороговую», наблюдалась в течение 8 дней (http://meteoinfo.ru). В этот период (период жары) осуществляли активный вызов участников исследования и их повторное обследование. Следует отметить, что многие участники исследования в летний период покидали пределы региона, главным образом, выезжая в зону жаркого климата (тропики и субтропики).
Таким образом, среднее время пребывания в условиях жары составило в среднем 9,3 дня в группе М и 13,9 дня в группе К, что превысило число жарких дней в Московском регионе (см. табл. 1). Различия по длительности пребывания в условиях жары больных группы активного ведения и группы контроля были статистически незначимы.
Второй визит. Заключительное обследование в сентябре – октябре 2012 г.

Статистический анализ проводили с помощью пакета программ Statistica 8.0. При анализе достоверности различий средних величин между группами при условии нормального распределения рассчитывали значения t-критерия Стьюдента для независимых выборок в предположении равенства дисперсий и в таблицах приведено p-значение для соответствующей t-статистики. Сравнение значений с распределением признаков, отличным от нормального, проводили с помощью критерия Мак—Уитни. Различия считали статистически достоверными при p<0,05. Для анализа корреляции использовали метод Спирмена. Сравнение распределения качественных признаков проводили с использованием точного критерия Фишера. Непрерывные переменные, имеющие нормальное распределение или умеренно отклоняющиеся от нормального, представляли как М±σ, где М — среднее и σ — стандартное отклонение. Непрерывные переменные, распределение которых отличалось от нормального, представляли в виде медианы (Mе) с указанием 25-го и 75-го процентилей. Для оценки динамики показателей проводили однофакторный анализ в контрольной и основной группах.
Результаты
Ни во время жары, ни после ее окончания у больных, участвующих в нашем исследовании, не зарегистрировано ни одного тяжелого ССО, такого как ОИМ, ОНМК. У 1 пациента милдронат был отменен из-за побочных эффектов: тошноты, миалгии, артралгии. Других побочных явлений в ходе наблюдения не отмечалось.
Изучаемые показатели, характеризующие ОКС, представлены в табл. 2.
 В обеих группах в период жары повышается уровень МДА: достоверно в группе М (Δ 0,4 нмоль/мг белка; р=0,02) и на уровне тенденции – в группе К (Δ 0,4 нмоль/мг белка; р=0,098), что свидетельствует об активации карбонильного стресса в ответ на стрессогенное воздействие высокой температуры. Причем в группе К после окончания жары его уровень несколько снижается, приближаясь к исходному, тогда как в группе М даже несколько повышается — Δ 0,7 нмоль/мг белка (-0,2; 0,1; р=0,02 по сравнению с исходным). Динамика СОД в период жары была разнонаправленной: в группе М уровень этого фермента повышался, тогда как в группе К, напротив, снижался, но изменения были статистически недостоверными в обеих группах. Тем не менее в группе контроля в период жары отмечалось статистически значимое увеличение отношения МДА/CОД, характеризующего окислительный потенциал крови, тогда как у больных, принимавших милдронат, эти изменения были статистически незначимыми (см. рисунок).
В обеих группах в период жары повышается уровень МДА: достоверно в группе М (Δ 0,4 нмоль/мг белка; р=0,02) и на уровне тенденции – в группе К (Δ 0,4 нмоль/мг белка; р=0,098), что свидетельствует об активации карбонильного стресса в ответ на стрессогенное воздействие высокой температуры. Причем в группе К после окончания жары его уровень несколько снижается, приближаясь к исходному, тогда как в группе М даже несколько повышается — Δ 0,7 нмоль/мг белка (-0,2; 0,1; р=0,02 по сравнению с исходным). Динамика СОД в период жары была разнонаправленной: в группе М уровень этого фермента повышался, тогда как в группе К, напротив, снижался, но изменения были статистически недостоверными в обеих группах. Тем не менее в группе контроля в период жары отмечалось статистически значимое увеличение отношения МДА/CОД, характеризующего окислительный потенциал крови, тогда как у больных, принимавших милдронат, эти изменения были статистически незначимыми (см. рисунок).
Концентрация окЛНП в период жары в обеих группах достоверно не отличалась от исходной. На 2-м визите в группе М уровень окЛНП снизился относительно как исходного (Δ -8,4; р=0,04), так и уровня в периода жары (р<0,01). В группе контроля уровень окЛНП на 2-м визите не отличался от исходного, однако был достоверно ниже определяемого в период жары. Уровень окЛНП на 1-м (r=0,39; p=0,03) и еще в большей степени на 2-м визите (r=0,51; p=0,008) достоверно коррелирует с числом дней, проведенных больным в зоне жары.
Влияние мельдония на гемодинамические показатели. В табл. 3. представлены гемодинамические показатели в группах сравнения.
У пациентов, получавших мельдоний, отмечалось снижение САД (Δ=12,7 мм рт.ст.; р=0,02) и уменьшение ЧСС (Δ=4,3 уд/мин; р=0,004) в жару. В сентябре 2012 г. (2-й визит) уровень АД несколько повысился, однако сохранилась тенденция к снижению САД (р=0,08) и ЧСС (р=0,06) по сравнению с исходными. У пациентов группы К динамика АД и ЧСС была статистически незначимой. Различия в степени снижения САД на пике жары в группах М и К носят достоверный характер (р<0,05).
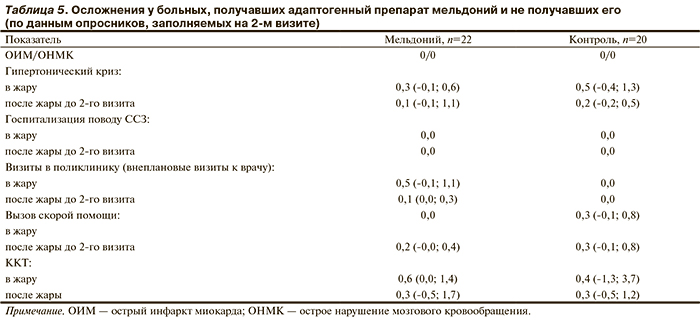
Влияние мельдония на качество жизни больных. Сравниваемые группы не различались по количеству осложнений, как в период жары, так и по ее окончанию (табл. 4). Однако прием мельдония ассоциировался с улучшением качества жизни, что отразилось в увеличении оценки по ВАШ (Δ+9,4 балла; р=0,04). В группе К такой динамики не прослеживалось (табл. 4).
Выявлена умеренная обратная корреляция между количеством осложнений в жару и уровнем активности СОД на пике жары (r=-0,390; p=0,04).
Обсуждение
Жара летом 2012 г. не была аномальной ни по продолжительности, ни по интенсивности. Кроме того, больные обеих групп находились на подобранной эффективной терапии и под контролем врачей. Это во многом нивелировало влияние климатических факторов и обеспечивало относительно хорошую переносимость жары пациентами контрольной группы. Тем не менее выявлены некоторые негативные тенденции, свидетельствующие о недостаточно эффективной работе механизмов тепловой адаптации у больных ССЗ. По нашим данным [7], летняя жара провоцирует развитие ОКС у 2/3 больных ССЗ, что выражается в увеличении содержания как первичных, так и (в большей степени) вторичных продуктов ПОЛ в отсутствие изменений активности фермента, утилизирующего активные формы кислорода (СОД). При этом у пациентов, «чувствительных» к ОКС, отмечена бóльшая частота развития ССО, включая гипертонические кризы, по сравнению с пациентами, у которых отношение МДА/СОД на пике жары, напротив, снижалось. Состояние ОКС фактически отражает соотношение между процессами генерации АФК, проявлением их токсического действия (прооксидантная система — ПОС) и активностью антиоксидантной система (АОС) тканей. Соотношение активности АОС и количества продуктов пероксидации может меняться в зависимости от состояния организма, влияния различных факторов среды. В здоровом организме поддерживается сбалансированное соотношение [8]. Стрессорная реакция в норме может и должна сопровождаться кратковременным подъемом АФК. Это обусловлено реакцией адаптации организма к экстремальным условиям, в которых АФК играют роль вторичных мессенджеров, участвуя в передаче сигнальной трансдукции, в экспрессии ряда генов [8]. В результате обеспечивается своевременная мобилизация антиоксидантной защиты, которая обеспечивает снижение уровня реакционно способных соединений, препятствуя тем самым проявлению их токсического действия. Токсическое действие АФК проявляется при состояниях ОКС, который сопровождается резкой интенсификацией свободно-радикальных процессов и снижением активности антиоксидантной защиты и является одним из патогенетических звеньев многих заболеваний, в том числе ССЗ, воспалительных, а также старения организма [9, 10].

В настоящем исследовании мы подтвердили сдвиг баланса ПОС—АОС в сторону активации прооксидантов во время нахождения в условиях жары, являющейся стрессорным агентом. В обеих группах отмечалось повышение уровней МДА и окЛНП во время жары. Мало того, концентрация окЛНП прямо коррелировала с длительностью пребывания под воздействием высоких температур.
Эти закономерности подтверждают роль жары в формировании ОКС у больных ССЗ.
На фоне терапии мельдонием, несмотря на активацию ПОС, отмечалось отсутствие роста МДА/СОД, отмеченного в группе К. Кроме того, к концу исследования в группе М снижался уровень окЛНП (Δ -8,4; р=0,04), как и относительно уровня в период жары (р<0,01). В группе контроля уровень окЛНП на 2-м визите не отличался от исходного, хотя и был достоверно ниже, чем в период жары. Эти данные подтверждают способность милдроната активировать АОС, что подтверждается ростом активности СОД на пике жары, хотя и статистически незначимым. Ранее экспериментальные исследования показали способность мельдония эффективно предотвращать активацию процессов ПОЛ при ОИМ и адреналиновой миокардиодистрофии. [11]. В клинических исследованиях также отмечалось повышение антиоксидантной защиты, коррелирующей с положительной динамикой клинических проявлений у больных, перенесших ОИМ, при добавлении мельдония к стандартной терапии [12]. У пожилых пациентов с ИБС, принимавших мельдоний, отмечалось снижение уровня продуктов ПОЛ в окЛНП на 33% и повышение устойчивости ЛНП к окислению. При этом в крови больных фиксировали повышение концентрации метаболитов NO в среднем в 1,4 раза [13]. Положительное влияние мельдония на липидный состав крови и функцию эндотелия подтверждено и в ряде других работ [5, 14].
Активность СОД на пике жары отрицательно коррелировала с суммарным числом осложнений в этот период. По всей видимости, это связано со способностью свободных радикалов вызывать развитие дисфункции эндотелия [15]. Дисфункция эндотелия, свойственная больным ССЗ, является одной из причин их худшей адаптации к высоким температурам, которая препятствует адекватной периферической вазодилатации, необходимой для эффективной терморегуляции. Подтверждением нормализации функции эндотелия на фоне приема мельдония в нашем исследовании стала динамика АД, приближающаяся к реакции на жару здоровых добровольцев [16]. У пациентов, получавших мельдоний, отмечалось снижение САД (Δ -12,7 мм рт.ст.; р=0,02) и уменьшение ЧСС (Δ -4,3 уд/мин; р=0,004) в жару, что соответствует адаптивным реакциям здорового человека. В сентябре 2012 г. (2-й визит) уровень АД несколько повысился, однако сохранилась тенденция к снижению САД и ЧСС по сравнению с исходными, что, бесспорно, является положительным моментом у больных АГ, которые составили 86,4% всей группы. У пациентов, входящих в группу К, достоверная динамика АД и ЧСС не прослеживалась, что в данном контексте свидетельствует о несовершенстве адаптации больных ССЗ к жаркому климату. Помимо антиоксидантных свойств мельдония его влияние на суточные колебания АД объясняется способностью, стимулируя рецепторы ацетилхолина, вызывать индукцию эндотелиальной NO-синтазы. В результате увеличивается синтез оксида азота (NO). Доказано, например, что использование мельдония в сочетании с традиционной гипотензивной терапией ингибиторами ангиотензинпревращающего фермента способствует нормализации функции эндотелия, более эффективной коррекции суточных колебаний АД [17]. Мельдоний способствует уменьшению периферического сопротивления сосудов, уменьшает вазоспазм, вызванный адреналином и ангиотензином, тормозит агрегацию тромбоцитов [18, 19]. В то же время улучшение энергетического баланса клеток эндотелия может повышать как экспрессию NO-синтазы, так и увеличивать чувствительность барорецепторов и других регуляторных систем, усиливая вазодилатацию. Применение мельдония у больных АГ оказывает позитивное воздействие на центральные механизмы регуляции вегетативной нервной системы [19], что в частности объясняет уменьшение ЧСС в группе М. Кроме того, существуют данные, свидетельствующие о том, что непрерывная и курсовая терапия мельдонием оказывает выраженные антиастеническое и антидепрессивное действия у пожилых пациентов с АГ и когнитивными нарушениями, т.е. наиболее подверженных влиянию климатических факторов [20]. Мельдоний рекомендован при повышенном умственном напряжении, работе в экстремальных ситуациях, а также для повышения уровня адаптации и скорости восстановительных процессов на фоне аэробных нагрузок у лиц с низким уровнем соматического здоровья [21].
Нормализация АД, оптимизация процессов адаптации и хорошая переносимость лечения закономерно ведут к улучшению качества жизни больных, принимавших мельдоний в летний период, что отразилось на увеличении оценки по ВАШ.
Таким образом, мельдоний может быть рекомендован для использования на фоне базовой терапии в качестве адаптогена у больных ССЗ во время волн жары.
Выводы
- Мельдоний (милдронат) оказывает антиоксидантное действие.
- Мельдоний потенцирует действие гипотензивной терапии в период летней жары.
- Мельдоний может быть использован как адаптоген в период летней жары у больных с умеренным и высоким риском развития сердечно-сосудистых осложнений.



