Оксид азота, или нитроксид, — чрезвычайно распространенное в организме соединение, которое играет важную роль в регуляции многих внутриклеточных процессов. Донорами нитроксида служат многие нитросодержащие соединения, наиболее известное из которых — нитроглицерин. В последние годы особое внимание уделено изучению действия динитрозильных комплексов железа. В отличие от других доноров нитроксида, эти комплексы оказывают длительное гипотензивное действие [1] и потенциально могут быть использованы при гипертонических кризах или для лечения стойкой артериальной гипертонии.
 В связи с этим в ФГБУ «Российский кардиологический научно-производственный комплекс» Минздрава РФ создана лекарственная форма динитрозильных комплексов железа с лигандом глутатионом, получившая название «оксаком».
В связи с этим в ФГБУ «Российский кардиологический научно-производственный комплекс» Минздрава РФ создана лекарственная форма динитрозильных комплексов железа с лигандом глутатионом, получившая название «оксаком».
Проведенное испытание действия оксакома на 14 здоровых добровольцах [2] показало его высокую эффективность — артериальное давление (АД) быстро снижалось на 15—20% и медленно восстанавливалось до исходного уровня за 8—10 ч. У отдельных добровольцев исследована функция сердца при помощи эхокардиографии. Выяснилось, что размеры левого желудочка в диастолу и систолу уменьшались, т.е. деятельность сердца протекала в условиях сниженного притока. Минутный объем, однако, оставался нормальным, что позволяет предполагать компенсаторное усиление сократимости миокарда и/или облегчение выброса при сниженном сопротивлении.
В то же время действие препарата на миокард оставалось неизученным. В связи с тем что при введении оксакома в кровоток крыс и кроликов сильно возрастает содержание как свободного, так и депонированного нитроксида в органах, особенно в сердце [3, 4], можно предполагать, что он может модулировать сократительную функцию сердца. Ранее установлено, что нитроксид оказывает разнонаправленное инотропное действие на миокард — он может как повышать, так и снижать его сократимость [5, 6] в зависимости от условий опыта. В связи с этим одной из задач данной работы являлось исследование действия оксакома на сократимость и расслабимость миокарда в условиях in vivo, когда периферическое сопротивление снижается. Другой задачей работы было изучение действия оксакома на сократимость и расслабимость миокарда при хронической сердечной недостаточности.
Материал и методы
Опыты выполняли на наркотизированных кетамином (100 мг/кг) самцах крыс Вистар массой 400—450 г. У животных непрерывно регистрировали электрокардиограмму во II стандартном отведении. Катетеризировали яремную вену, бедренную артерию и сонную артерию, через которую катетер проводили в левый желудочек (ЛЖ). Среднее АД измеряли в бедренной артерии с помощью электроманометра, давление в ЛЖ — при помощи тензометрического усилителя. Все сигналы подавали на «Biograph-4». Рассчитывали традиционные показатели сократимости — максимальную скорость развития давления (dP/dtmax) и индекс сократимости [7] (dP/dtmax/P, где Р — давление в момент достижения максимума dP/dt). Для характеристики процесса расслабления определяли максимальную скорость снижения давления (–dP/dtmax), индекс расслабления, который рассчитывали по аналогии с расчетом индекса сократимости, а также константу скорости расслабления ЛЖ в изоволюмической фазе (константа изоволюмического расслабления) [8] по методу, предложенному в работе [9] и основанному на расчете текущего значения первой производной по времени от сигнала давления.

Все сигналы оцифровывали с частотой 1 кГц с помощью аналого-цифрового преобразователя и записывали на жесткий диск компьютера. Для записи и обработки физиологических сигналов были разработаны собственные программы. Величины всех параметров рассчитывали на основе анализа записей первичных сигналов, подвергнутых предварительной процедуре пульс-синхронного усреднения, которая обеспечивает автоматический расчет «усредненных форм» сигналов по 40 кардиоциклам каждые 5 с [10, 11].
Оксаком вводили в яремную вену в дозах 10, 20 или 40 мг/кг крысам контрольной группы и получавшим за 4 нед до опыта двукратную дозу изопротеренола 120 мг/кг.
Результаты
Болюсное введение оксакома оказывало немедленный эффект на гемодинамику — уже на 1-й минуте АД заметно снижалось, а частота сердечных сокращений (ЧСС), напротив, возрастала (рис. 1).
 Систолическое и диастолическое давление в ЛЖ имело тенденцию к снижению, но +dP/dtmax, как и его производная — индекс сократимости — заметно возрастали. Константа изоволюмического расслабления отчетливо снижалась. Максимальные изменения показателей функции сердца наблюдали через 30—40 с (рис. 2). Показатели сократимости повышались приблизительно на 30%, а показатель расслабимости снижался на такую же величину. Введение повышенных доз оксакома — 20 и 40 мг/кг — оказало принципиально такое же действие, лишь увеличилась степень изменения параметров. Так, при введении дозы 40 мг/кг АД снизилось на 40%, индекс сократимости возрастал в 1,5 раза, а константа расслабления снизилась в 2 раза.
Систолическое и диастолическое давление в ЛЖ имело тенденцию к снижению, но +dP/dtmax, как и его производная — индекс сократимости — заметно возрастали. Константа изоволюмического расслабления отчетливо снижалась. Максимальные изменения показателей функции сердца наблюдали через 30—40 с (рис. 2). Показатели сократимости повышались приблизительно на 30%, а показатель расслабимости снижался на такую же величину. Введение повышенных доз оксакома — 20 и 40 мг/кг — оказало принципиально такое же действие, лишь увеличилась степень изменения параметров. Так, при введении дозы 40 мг/кг АД снизилось на 40%, индекс сократимости возрастал в 1,5 раза, а константа расслабления снизилась в 2 раза.
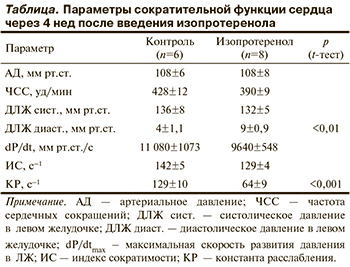
Двукратное введение изопротеренола в зависимости от дозы вызывало диффузные микронекрозы миокарда с поражением всех слоев, изменения гемодинамики и свойств миокарда [10]. В данной серии опытов в исходном состоянии перед введением оксакома изменения гемодинамики были незначительными, параметры сократимости имели тенденцию к снижению, но конечное диастолическое давление в ЛЖ было в 2 раза выше, а константа расслабления вдвое ниже (см. таблицу). Это сочетание в совокупности с мало измененными показателями сократимости и гемодинамики указывает на наличие диастолической сердечной недостаточности.
Рис. 3 иллюстрирует изменение основных параметров функции сердца при введении оксакома во всей группе этих животных. Давление в артерии и ЛЖ, ЧСС, а также индекс сократимости изменялись, как и у животных контрольной группы (см. рис. 1), лишь константа изоволюмического расслабления продемонстрировала обратную динамику, т.е. не снижалась, а возрастала. Средние величины АД и ЧCС изменялись реципрокно (рис. 4), как и в контрольной группе. Начальные изменения были зарегистрированы уже через 5 с, пик изменений обоих параметров наблюдали через 60 с. Возвращение к исходному уровню происходило медленно — через 25 мин. Индекс сократимости и константа изоволюмического расслабления изменялись аналогичным образом, динамика роста обоих показателей практически совпадала, а максимальные изменения наблюдали через 60 с (рис. 5). Прирост константы изоволюмического расслабления в опытах на пораженных изопротеренолом сердцах был весьма заметным — в 1,5 раза. При этом наблюдалось отчетливое снижение конечного диастолического давления в ЛЖ с 9±0,9 до 3±0,4 мм рт.ст. через 1 мин. Его возвращение к исходному уровню было очень медленным, так что через 25 мин его уровень составлял 6±0,8 мм рт.ст.
Обсуждение
Основные факты, установленные в данной работе, следующие: в контрольных опытах известный гипотензивный эффект оксакома сопровождался учащением сокращений, повышением сократимости и снижением расслабимости миокарда; аналогичный эффект оксакома наблюдали и в опытах на сердцах с диастолической сердечной недостаточностью, за исключением того, что расслабимость миокарда не снижалась, а повышалась.

Ранее при проведении эхокардиографии у добровольцев после введения оксакома было установлено, что под влиянием оксакома насосная функция сердца (минутный объем, ударный объем, фракция выброса) оставалась неизменной, но наполнение ЛЖ уменьшалось, о чем свидетельствовала сниженная величина диастолического объема ЛЖ. Это соответствует эффекту других нитратов [12]. Уменьшение притока к сердцу происходит за счет хорошо известного расслабляющего действия оксида азота на тонус артерий и вен. В этих условиях компенсация выброса может осуществляться за счет не только сниженного сопротивления, но и компенсаторного учащения и усиления сокращений ЛЖ. Можно было бы предполагать, что эти изменения обусловлены симпатической стимуляцией сердца. Однако блокада β-адренорецепторов не повлияла на учащение сокращений при введении оксакома [13], кроме того, для действия катехоламинов характерно повышение и сократимости, и расслабимости миокарда. В наших же опытах сократимость повышалась, а расслабимость снижалась. Эти данные позволяют предполагать наличие прямого действия нитроксида на кардиомиоциты. Выполненные ранее исследования показали, что введение оксакома сопровождалось значительным повышением содержания нитроксида в органах, причем в сердце этот прирост был примерно 14-кратный [3].
Известно, что естественными источниками нитроксида в сердце являются NO-синтазы — эндотелиальная (NOS3), локализованная не только в эндотелиоцитах, но и на мембране кардиомиоцитов, а также нейрональная (NOS1), находящаяся в клетках. Они оказывают разное действие. Активация NOS3, нитрозилируя медленные кальциевые каналы, ингибирует вход Са2+ в кардиомиоциты и тем самым оказывает отрицательное инотропное действие [14]. Стимуляция же нейрональной NO-синтазы (NOS1), находящейся вблизи саркоплазматической сети, связана с окислением сульфгидрильных участков на молекуле рианодинового рецептора RyR2 [15]. Это способствует выходу Са2+ из саркоплазматической сети, что оказывает положительное инотропное действие. Донор нитроксида — S-нитрозоглутатион — также дозозависимо активировал канал RyR2 и увеличивал выход Са2+ [16]. Естественно предполагать, что действие проникающего в клетки экзогенного нитроксида будет подобно активации обеих NO-синтаз. Повышение сократимости миокарда под влиянием оксакома как в контроле, так и при патологии позволяет предполагать, что внутриклеточное действие нитроксида преобладало. Таким образом, оксаком наряду с гипотензивным оказывает кардиотропное действие.

Сложным для объяснения является снижение расслабимости миокарда в контроле, но повышение в сердцах, пораженных изопротеренолом. Известно, что ингибирование NOS1 или отсутствие гена этой синтазы сочетается с сильным замедлением расслабления изолированных кардиомиоцитов [17]. Это позволяет полагать, что в нормальных условиях активность NOS1 способствует расслаблению через стимуляцию транспорта Са2+ в саркоплазматическую сеть, осуществляемую посредством S-нитрозилирования кальциевой АТФазы SERCA2 [18, 19]. Однако избыточное накопление нитроксида в клетках при введении оксакома может извратить эту реакцию [20, 21], а также активировать протеинкиназу G, замедляющую поглощение Са2+ [22].
На сердцах, пораженных изопротеренолом, оксаком оказывал противоположное действие на расслабимость. Аналогичным образом действие NO изменялось и при другой патологии — гипертонии, вызванной ангиотензином II [19], а также при блокаде NO-синтаз или стенозе аорты у здоровых крыс [23]. В этой работе сердечный пептид интермедин оказывал отрицательный инотропный эффект, а при блокаде NO-синтаз его действие было противоположным, при этом ускорялось и расслабление миокарда. Эти данные показывают, что действие нитроксида на миокард зависит от состояния NO-синтаз. Известно, что активность NO-синтаз снижена при разных видах патологии сердца [20, 24, 25], а недостаточное S-нитрозилирование рианодинового рецептора приводило к накоплению Са2+ в миоплазме — кальциевой перегрузке [18], возможно, из-за сниженной функции кальциевой АТФазы эндоплазматической сети [20]. В этих условиях экзогенный нитроксид может восстановить нужный уровень S-нитрозилирования, что сопровождается ускорением расслабления и облегчением наполнения ЛЖ [5, 6]. В нашей работе наблюдалось значительное снижение диастолического давления в ЛЖ в группе сердечной недостаточности. В этом эффекте видную роль может играть S-нитрозилирование белков, в частности, тайтина, от которого зависит упругость миокарда [20, 26].
В работе [27], выполненной на сердцах здоровых молодых добровольцев, предварительное введение ингибитора NO-синтаз значительно увеличивало конечный систолический объем ЛЖ и уменьшало ударный объем. На этом фоне донор нитроксида S-нитрозоглутатион восстанавливал эти параметры и даже немного повышал ударный объем. Следует отметить, что доза S-нитрозоглутатиона была столь мала, что не вызвала снижения АД, и следовательно, наблюдаемые эффекты были целиком обусловлены действием нитроксида на миокард.
Таким образом, можно полагать, что в наших опытах измененная реакция расслабимости миокарда при введении оксакома при недостаточности сердца связана со снижением активности NO-синтаз миокарда. Одновременное повышение сократимости и расслабимости миокарда, не связанное с симпатической стимуляцией, делает оксаком перспективным препаратом для терапии хронической сердечной недостаточности.



