Компьютерная томография (КТ) — высокоинформативный метод диагностики в кардиологии [1], а КТ-ангиография (КТА) входит в алгоритм обследования пациентов с низким и средним риском развития ишемической болезни сердца (ИБС) [2, 3]. Возможности современной КТА позволяют получать изображения коронарных артерий (КА) хорошего качества благодаря одномоментному сканированию всей области сердца, что обеспечивает высокую точность метода по сравнению с инвазивной коронарографией (КГ) [4]. Степень сужения просвета КА обычно используется для постановки диагноза и определения тактики лечения больных ИБС. Однако КТА не ограничивается оценкой просвета КА, поскольку дает дополнительную информацию о морфологии и объеме атеросклеротической бляшки (АСБ), а также степени ремоделирования артерии [5]. В клинической практике для оценки состояния АСБ широко используется внутрисосудистое ультразвуковое исследование (ВСУЗИ), которое позволяет оценить состояние просвета и стенки КА с помощью визуального и количественного анализа изображений поперечного сечения сосуда [6—8]. Хотя ВСУЗИ является референтным методом оценки состава и объема коронарной АСБ в клинических исследованиях [9, 10], тем не менее это дорогостоящая инвазивная процедура, которая проводится в современных научных кардиологических центрах и редко выполняется в обычной клинической практике. Поэтому возможность неинвазивной оценки состояния АСБ методом КТА и, прежде всего, выявление нестабильных АСБ в КА является перспективным направлением кардиодиагностики [11—16].
 Целью данного исследования являются определение информативности КТА в оценке состояния АСБ и выявление признаков нестабильности бляшки по сравнению с данными ВСУЗИ.
Целью данного исследования являются определение информативности КТА в оценке состояния АСБ и выявление признаков нестабильности бляшки по сравнению с данными ВСУЗИ.
Материалы и методы
Дизайн исследования. На первом этапе в исследование были включены 52 пациента с клинической картиной острого коронарного синдрома (ОКС) без подъема сегмента ST. Всем пациентам была выполнена экстренная КТА КА в первые сутки госпитализации. У 32 (61,5%) из 52 пациентов по данным КТА были выявлены АСБ в КА. Этой группе пациентов было выполнено ВСУЗИ. Каждому из 32 пациентов ВСУЗИ было выполнено в 1, 2 или 3 КА. Всего с помощью ВСУЗИ исследовано 50 АСБ в 45 КА, из них 39 АСБ оценивались методом ВСУЗИ с программой спектрального анализа. Данные ВСУЗИ в «серой шкале» и ВСУЗИ с функцией спектрального анализа сравнивались с результатами КТА.
Характеристика исследуемой группы больных. В сравнительное исследование включены 32 пациента (27 мужчин, 5 женщин), из которых у 22 диагностирована нестабильная стенокардия, у 10 — инфаркт миокарда без подъема сегмента ST. Средний возраст больных составил 58±11,4 года. Клиническая характеристика пациентов представлена в таблице.
ВСУЗИ с функцией спектрального анализа. ВСУЗИ КА с функцией спектрального анализа с целью уточнения морфологии АСБ КА и признаков нестабильности в них проводили на аппарате Boston Scientific IVUS Console с использованием внутрисосудистого ультразвукового датчика Atlantis 40 МГц.
С помощью проводника в пораженную КА диаметром не менее 2,5 мм и остаточным просветом не менее 1,5 мм вводили вышеуказанный датчик и выполняли обратную тракцию в автоматическом режиме со скоростью 0,5 или 1 мм/с. Протяженность одной тракции составляла не менее 40 мм, максимальная длина 90 мм. Длина датчика позволяла охватить зону интереса в проксимальных отделах КА протяженностью 90 мм. В дальнейшем выполняли спектральный анализ полученных изображений с определением структуры АСБ в режиме IMAP.
КТА КА. КТА выполняли на компьютерном томографе Aquilion 64 с электрокардиографической синхронизацией при задержке дыхания пациента. До исследования в локтевую вену устанавливали пластиковый внутривенный катетер калибром 1—1,3 мм и накладывали электроды электрокардиографа для регистрации основных отведений. Исследование проводили в положении пациента лежа на спине при движении стола от головы к ногам от уровня дуги аорты до диафрагмы.
Протокол КТ сердца включал выполнение топограммы, нативную и артериальную фазы исследования: 1-я фаза (нативная) выполнялась до введения контрастного препарата; 2-я фаза (артериальная) — в спиральном режиме томографии, который обеспечивает одновременное получение 64 срезов толщиной 0,5 мм за 400 мс (время полного оборота трубки) при непрерывном движении стола с пациентом. Ток и напряжение на трубке составляли соответственно 400 мА и 120 кВ. Контрастный препарат (оптирей-350 или омнипак-350) в дозе 100—150 мл (1,5 мл на 1 кг массы тела) вводили внутривенно со скоростью 5 мл/с автоматическим шприцем.
Для оценки АСБ выполняли трехмерные и мультипланарные реконструкции изображений КА, затем в ее просвете отмечали зону локализации АСБ, на уровне которой автоматически получали серию изображений в поперечной плоскости толщиной 1 мм (рис. 1, см. цв. вклейку).
 Анализ данных КТА и ВСУЗИ
Анализ данных КТА и ВСУЗИ
Визуальная оценка состояния АСБ включала определение микрокальцинатов в структуре бляшки, наличие изъязвлений и надрывов интимы.
Количественный анализ состояния АСБ по данным КТА и ВСУЗИ включал определение следующих параметров: 1 — процент площади артерии, занимаемой АСБ, или бремя бляшки; 2 — протяженность бляшки (см); 3 — индекс ремоделирования (ИР) артерии на уровне бляшки. Расчет перечисленных параметров проводился полуавтоматически с использованием единых стандартных методов расчета для КТА и ВСУЗИ.
Бремя бляшки (%) рассчитывали по формуле: (1–Smin/ Sсосуда)×100%, где Smin — минимальная площадь просвета, Sсосуда — площадь сосуда на уровне бляшки.
ИР рассчитывали по формуле: ИР=Д1/Д2, где ИР — индекс ремоделирования, Д1 — диаметр КА на уровне бляшки, Д2 — диаметр КА на уровне референтного сегмента. Референтный участок — участок с наибольшим просветом в том же сегменте артерии (до 10 мм от АСБ). ИР ≤0,95 соответствует отрицательному ремоделированию, ИР≥1,05 — положительному. Положительное ремоделирование характерно для нестабильной АСБ [17, 18].
Помимо перечисленных параметров, по данным КТА оценивалась так называемая зона низкой плотности (low-density zone) в структуре АСБ. «Зона низкой плотности» визуально определялась как наиболее темный участок, который обводился курсором и оценивался количественно в единицах Хаунсфилда (Hounsfield units, HU). «Зона низкой плотности» менее 30 HU является косвенным компьютерно-томографическим признаком наличия в АСБ большого липидного ядра [19].
При ВСУЗИ с функцией спектрального анализа состав АСБ распознается за счет радиочастотных характеристик отраженного ультразвукового сигнала от стенки артерии. Основным компонентам бляшки, к которым относятся фиброзный, фиброзно-липидный, некротический и кальцинированный, автоматически присваивается соответствующий цветовой код. В зависимости от преобладания того или иного компонента выделяют 5 типов бляшек: 1 — патологическое утолщение интимы; 2 — фиброзная АСБ; 3 — фиброзно-кальцинированная АСБ; 4 — фиброатерома; 5 — тонкокапсульная фиброатерома (ФАТК) [20].
Наиболее уязвимой или нестабильной бляшкой считается ФАТК. КТА и ВСУЗИ с функцией спектрального анализа не обладают достаточной разрешающей способностью для определения толщины фиброзной капсулы. Однако данные ВСУЗИ с функцией спектрального анализа позволяют косвенно судить о наличии тонкой капсулы в отсутствие визуализации фиброзной ткани, отделяющей просвет сосуда от некротического компонента на протяжении не менее 30 градусов, и большом содержании некротического ядра (более 10%) по отношению к общему объему бляшки.
Статистическая обработка данных. Статистический анализ выполняли с использованием программы Microsoft Excel и пакетов статистических программ MedCalc Software. Количественные переменные описывали числом больных, средним арифметическим значением с использованием стандартного отклонения. Качественные переменные описывали абсолютными и относительными частотами (процентами). Определение пограничных значений минимальной плотности АСБ проводили с построением ROC-кривых и расчетом площади под кривой. Анализ сопоставимости результатов КТА и ВСУЗИ выполняли с помощью расчета коэффициента корреляции Спирмена и построением диаграммы рассеяния по Бланду—Альтману.
 Результаты
Результаты
В сравнительный анализ данных КТА и ВСУЗИ включены 50 АСБ, из них 26 бляшек определялись в симптом-связанных артериях.
Стенозы ≥50% по данным ВСУЗИ определялись в 43 сегментах КА, из них совпадения с данными КТА регистрировались в 42 сегментах — чувствительность составила 97,67%; стенозы <50% определялись по данным ВСУЗИ в 7 сегментах, из них совпадения с данными КТА регистрировались в 5 сегментах — специфичность составила 71,4%.
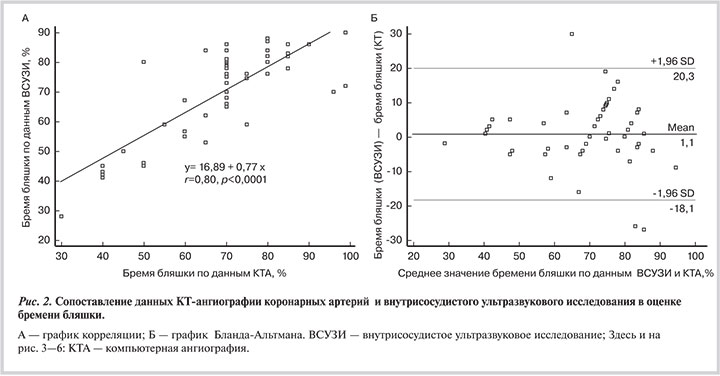
Корреляционный анализ показал высокую сопоставимость бремени бляшки по данным КТА и ВСУЗИ (r=0,80; p<0,0001 при 95% доверительном интервале — ДИ от 0,67 до 0,88) (рис. 2, А). Средняя ошибка при измерении бремени бляшки, измеренного на уровне одного и того же сегмента методами КТА и ВСУЗИ, составила 1,1 % (рис. 2, Б). Значения бремени бляшки по данным КТА и ВСУЗИ статистически значимо не различались: 69,0±15,7 и 70,2±2,0% соответственно (при 95% ДИ от 5,08 до 7,18; p=0,73).
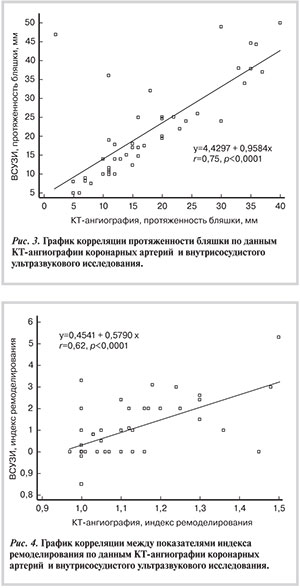
По данным КТА отмечалась незначительная переоценка протяженности бляшки по сравнению с ВСУЗИ: соответственно 2,3±1,2 и 1,8±0,9 см (при 95% ДИ от 1,5 до 9,4; p=0,16), однако эти различия не достигли статистической значимости. Корреляционный анализ показал высокую сопоставимость протяженности бляшки по данным КТА и ВСУЗИ (r=0,75; p<0,0001; при 95% ДИ от 0,60 до 0,85) (рис. 3).
Оценить ремоделирование КА на уровне бляшки в 5 (10%) случаях не представлялось возможным вследствие устьевых или бифуркационных поражений. Средние значения ИР на уровне бляшки по данным КТА и ВСУЗИ составили 1,11±0,13 и 1,10±0,13 соответственно (при 95% ДИ от 0,07 до 0,04; p=0,62), а корреляционный анализ показал хорошую сопоставимость методов в определении ИР (r=0,62; p<0,0001 при 95% ДИ от 0,40 до 0,77) (рис. 4).
Микрокальцинаты по данным ВСУЗИ определялись в 22 из 50 бляшек, из них совпадения с данными КТА регистрировались лишь в 13 (59,1%) бляшках. По данным ВСУЗИ выявлены 10 (20%) бляшек с надрывом интимы, из них только в 2 бляшках определялись КТ-признаки диссекции.
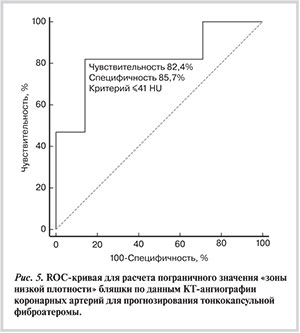
Среди бляшек, которые были оценены методом ВСУЗИ с функцией спектрального анализа (n=39), в 14 при проведении КТА определить наличие или отсутствие «зоны низкой плотности» было невозможно из-за выраженного кальциноза или малого размера бляшки. Таким образом, количественная оценка плотности бляшки была проведена в 24 случаях. В 17 (70,8%) из 24 бляшек по данным ВСУЗИ выявлены признаки ФАТК. Пороговое значение «зоны низкой плотности» бляшки, характерное для ФАТК, составило ≤41 HU (чувствительность 82%; специфичность 86%; площадь под кривой 0,824 при 95% ДИ от 0,615 до 0,947; p<0,0005) (рис. 5).
На рис. 6 (см. цв. вклейку) представлены изображения инвазивной КГ с ВСУЗИ с функцией спектрального анализа бляшки и КТА с функцией «цветового кодирования» бляшки.
Обсуждение
КТА является наиболее изученным методом неинвазивной оценки состояния АСБ в КА. За последние 5 лет проведено большое количество научных исследований, доказывающих высокую информативность КТА в определении состава и морфологических особенностей АСБ [21—24]. Однако в отечественной литературе опубликованы единичные работы, посвященные этой проблеме [25, 26]. В представленной работе впервые в нашей стране проведен сравнительный анализ состояния коронарных бляшек по данным КТА и ВСУЗИ у больных с ОКС, который показал высокую сопоставимость методов для определения бремени бляшки (r=0,80; p<0,0001) и ИР (r=0,62; p<0,0001). Среднее значение ИР по группе составило 1,1 по данным обоих методов. Таким образом, у большинства пациентов с ОКС определялось положительное ремоделирование артерии на уровне АСБ, что является косвенным признаком ее нестабильности [27]. Наши результаты согласуются с данными M.J. Boogers и соавт. [28], которые выявили выраженную корреляцию показателей КТА и ВСУЗИ при оценке значений минимального просвета сосуда (r=0,75; p<0,001), степени сужения просвета (r=0,79; p<0,001), бремени бляшки (r=0,70; p<0,001) и ИР (r=0,56; p<0,001).
Наличие микрокальцинатов в структуре АСБ рассматривается рядом авторов как признак ее уязвимости [29]. В нашем исследовании в 40,9% бляшек данные КТА не совпадали с данными ВСУЗИ, что в большинстве случаев можно объяснить различными критериями оценки микрокальцинатов и завышением площади кальциноза из-за артефактов по данным обоих методов.
Наиболее значимым КТ-критерием нестабильности АСБ, косвенно указывающим на большое липидное ядро в ее структуре, считается наличие «зоны низкой плотности». В проспективном исследовании S. Motoyama и соавт. [30] выявление этого показателя наряду с положительным ремоделированием артерии указывало на высокую вероятность развития ОКС. В нашей работе с помощью ROC-анализа мы определили, что наличие в АСБ участка плотностью ≤41 HU является достоверным КТ-критерием ФАТК.
Заключение
Компьютерная томографическая ангиография является неинвазивным методом быстрой оценки состояния атеросклеротических бляшек в коронарных артериях.
Полученные при компьютерной томографии характеристики атеросклеротических бляшек хорошо коррелируют с показателями внутрисосудистого ультразвукового исследования, в том числе при оценке одного из наиболее важных признаков нестабильности атеросклеротической бляшки — положительного ремоделирования артерии на уровне бляшки.
Наличие в бляшке участка плотностью ≤41 HU с высокой вероятностью указывает на тонкокапсульную фиброатерому.
Для оценки клинической значимости полученных при компьютерной томографии признаков нестабильности бляшки необходимы дальнейшие проспективные исследования по изучению роли компьютерной томографической ангиографии в выявлении предикторов развития острого коронарного синдрома.



