Непосредственной причиной развития инфаркта миокарда (ИМ) в большинстве случаев является внутрикоронарный тромбоз, формирующийся на поверхности нестабильной атеросклеротической бляшки (АСБ) [1, 2]. Визуализация нестабильных АСБ в коронарных артериях (КА) представляет новое перспективное диагностическое направление.
Внутрисосудистое ультразвуковое исследование (ВСУЗИ) позволяет провести точный анализ структуры изучаемого сегмента артерии. С помощью ВСУЗИ не только получают изображение просвета артерии, но и оценивают структуру сосудистой стенки. При анализе в «серой шкале» производится формирование двухмерного изображения в реальном времени. ВСУЗИ позволяет выявить низкую эхогенность, позитивное ремоделирование и кальциевые включения. Возможности ВСУЗИ существенно расширяются с помощью проведения спектрального анализа полученных данных, при котором 4 основным компонентам АСБ присваивается соответствующая цветовая кодировка: фиброзный — зеленый, фиброзно-липидный — зелено-желтый, участки некроза — красный, зоны кальциноза — белый цвет. Такой анализ называется «виртуальной гистологией» (ВГ). С помощью этой технологии разграничивают различные компоненты АСБ в зависимости от морфологических особенностей: липидный, фиброзный и кальцинированный. ВСУЗИ с ВГ (ВСУЗИ-ВГ) позволяет обнаружить наиболее опасный тип АСБ — фиброатерому с тонкой покрышкой (ФАТК). Характерными особенностями ФАТК является наличие крупного липидно-некротического компонента и критическое истончение фиброзной капсулы АСБ (менее 65 мкм).
В связи с ограниченной пространственной разрешающей способностью (80—120 мкм) с помощью ВСУЗИ нельзя точно определить толщину фиброзной капсулы. Однако возможно косвенно судить о наличии тонкой капсулы по отсутствию визуализации фиброзной ткани, отделяющей просвет сосуда от некротической части АСБ. На основании ряда работ, включающих патогистологические исследования у пациентов, умерших внезапно или от ИМ, установлено, что ФАТК является самым распространенным субстратом коронарного тромбоза. У больных с острым коронарным синдромом (ОКС) признаки нестабильности АСБ довольно часто обнаруживаются не только в инфаркт-связанной артерии, но и в других КА, что соответствует концепции «нестабильного больного», т.е. процессы дестабилизации распространяются за пределы симптом-связанного поражения. Таким образом, процессы нестабильности не ограничиваются инфаркт-связанной артерией [3—6].
В нескольких исследованиях показано, что у больных ОКС в симптом-связанных артериях АСБ имели большое содержание некротического компонента и чаще обнаруживались ФАТК по сравнению с таковыми у больных стабильной стенокардией (СС) [7, 8].
Цель настоящего исследования: сравнение инфаркт-несвязанных поражений КА у больных ОИМ с симптом-связанными и симптом-несвязанными поражениями у больных СС с помощью ВСУЗИ-ВГ.
Материал и методы
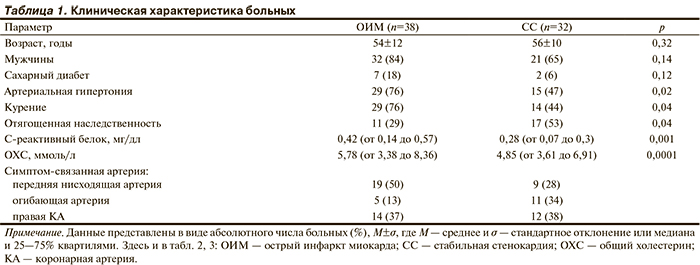
В исследование включены 70 больных: 38 с ОИМ с подъемом ST — основная группа, и 32 больных СС — группа сравнения. Клиническая характеристика больных представлена в табл. 1. Средний возраст больных ОИМ составил 54±12 лет (84% мужчины, 16% женщины), СС – 56±10 лет (65% мужчины, 35% женщины). У больных ОИМ отмечался более высокий уровень общего холестерина — ОХС (5,78 и 4,85 ммоль/л; p=0,001), С-реактивного белка — СРБ (0,42 и 0,28 мг/дл; p=0,01). Всем больным в период пребывания в стационаре проводили коронарографию (КГ). Больные из основной группы поступали в блок интенсивного наблюдения, где осуществлялись первичная диагностическая оценка и включение в исследование. Больным ИМ проводили реперфузионную терапию. Тромболитическая терапия (ТЛТ) выполнялась на этапе скорой медицинской помощи (догоспитальная ТЛТ). Эндоваскулярную реваскуляризацию использовали как самостоятельный метод реперфузионного лечения — первичное чрескожное вмешательство (ЧКВ) или после проведенной ТЛТ. В период пребывания в стационаре после проведения эндоваскулярного лечения инфаркт-связанного поражения у больных ОИМ и симптом-связанного у больных СС проводили оценку структуры АСБ во всех основных КА методом ВСУЗИ-ВГ. Выполнение ВСУЗИ во время первичного ЧКВ может приводить к увеличению продолжительности процедуры и неоправданному увеличению риска развития осложнений. Поэтому ВСУЗИ выполняли после стабилизации состояния в среднем на 6-е сутки. Такой протокол исключал возможность изучения инфаркт-связанных поражений. Больные получали стандартную медикаментозную терапию, включающую ацетилсалициловую кислоту, клопидогрел/тикагрелор, β-адреноблокаторы, статины, ингибиторы ангиотензинпревращающего фермента/антагонисты рецепторов ангиотензина II, а также другие препараты по показаниям.
В исследование не включали больных с тяжелыми сопутствующими заболеваниями: хроническая почечная (креатинин >200 мкмоль/л) или печеночная (аланинаминотрансфераза >200 ед/л) недостаточность, злокачественные новообразования, с наличием противопоказаний к проведению инвазивных обследований.
КГ выполняли лучевым или бедренным доступом на аппарате Allura Xper FD-10 с применением катетера диметром 6F. Автоматический количественный анализ ангиограмм проводили на цифровой системе Xcelera.

ВСУЗИ проводили после эндоваскулярного лечения инфаркт-связанного поражения у больных ОИМ за период пребывания в стационаре, у больных СС в плановом порядке. Исследовали проксимальные, средние сегменты (6—8 см) передней нисходящей, огибающей и правой КА. ВСУЗИ-ВГ выполняли на аппарате Volcano s5. Регистрацию данных ВСУЗИ осуществляли при непрерывной обратной тракции протягивающим устройством со скоростью 0,5 мм/с электронного секторного УЗ-сканера Eagle Eye Gold (частотой 20 МГц) с функцией ВГ. Спектральный анализ по времени совпадал с началом зубца R на электрокардиограмме. Исследуемый стеноз в каждом сегменте артерии идентифицировали при ВСУЗИ и визуализируемых при КГ анатомических ориентирах. Границы АСБ определяли по наиболее неизмененным участкам артерии проксимальнее и дистальнее зоны интереса, ориентируясь на данные КГ. Затем осуществляли анализ АСБ на всем протяжении, с ручной коррекцией границ интима—просвет и медиа—адвентиция каждого кадра УЗ-изображения на всем протяжении выбранного сегмента. При количественной оценке изображений в «серой шкале» определяли следующие параметры:
- общий объем АСБ (ООБ, мм3);
- собственная площадь артерии (СПА, мм2). Рассчитывали по границе медиа—адвентиция (наружная эластическая мембрана);
- минимальная площадь просвета артерии (мин. ППА, мм2) — зона с наименьшим просветом артерии в месте сужения просвета сосуда; определяли при просмотре продольного и поперечного изображений ВСУЗИ. Измерение минимальной ППА проводили по границе внутренней эластической мембраны — просвет артерии;
- процент площади артерии, занимаемый АСБ (ППА АСБ), рассчитывали как (СПА-ППА/СПА)·100%;
- индекс ремоделирования (ИР) — соотношение СПА/Рефер. СПА. В качества референтного участка принимали зону с наибольшим внутренним просветом в пределах одного сегмента артерии не далее чем на 10 мм проксимальнее стеноза, без отхождения крупных ветвей второго порядка. Наличие отрицательного ремоделирования артерии считали при ИР≤0,95, положительное ремоделирование — при ИР≥1,05. Промежуточные значения расценивали как отсутствие ремоделирования. Позитивное ремоделирование характерно для нестабильной АСБ [9, 10].
Согласно ВСУЗИ с ВГ, 4 основные компонента АСБ имеют следующую цветовую кодировку: зеленый (фиброзный), светло-зеленый (состоящий из фиброзной и жировой ткани), красный (некротический компонент) и белый (кальций) [11]. На основании ВСУЗИ с ВГ АСБ в зависимости от морфологических особенностей классифицировали следующим образом [12]:
- патологическое утолщение интимы: АСБ занимает более 40% от площади поперечного сечения артерии. АСБ может содержать все компоненты, но в основном фиброзно-липидный. Некротический компонент и кальциноз составляют менее 10% от общего объема АСБ;
- фиброзная бляшка: АСБ занимает более 40% от площади поперечного сечения артерии. Некротический компонент и кальций составляют менее 10% от общего объема АСБ, фиброзно-липидный компонент менее 15%;
- фиброзно-кальцинированная бляшка: АСБ занимает более 40% от площади поперечного сечения артерии, в основном состоит из фиброзного компонента с содержанием кальция более 10% и объемом некротического ядра менее 10% от общего объема АСБ;
- фиброатерома (ФА) — АСБ с содержанием некротического ядра более 10% от общего объема АСБ, покрыта толстой, визуализируемой фиброзной капсулой;
- кальцинированная фиброатерома (КАФА) — АСБ с содержанием некротического ядра более 10% от общего объема АСБ, покрыта толстой, визуализируемой фиброзной капсулой; содержание кальция более 10% от общего объема АСБ;
- ФАТК. АСБ занимает более 40% от площади поперечного сечения артерии. ВСУЗИ за счет ограниченной пространственной разрешающей способности (80—120 мкм) не позволяет точно определять толщину фиброзной капсулы. Однако можно косвенно судить о наличии тонкой капсулы по отсутствию визуализации фиброзной ткани, отделяющей просвет сосуда от некротической части на протяжении не менее 30°; большому некротическому ядру (более 10%); содержанию кальция менее 10% от общего объема АСБ (рис. 1, см. цветную вклейку);
- кальцинированная ФАТК (КАФАТК): ФАТК с содержанием кальция более 10% от общего объема АСБ.
На основании данных виртуальной гистологии рассчитывали индекс уязвимости (ИУ) — соотношение объемов некротической части к объему кальция [13].
Статистический анализ. Статистический анализ проводили с помощью программы Statistica for Windows 7.

При анализе достоверности различий средних величин между группами при условии нормального распределения рассчитывали значения t-критерия Стьюдента для независимых выборок в предположении равенства дисперсий. Сравнение значений с распределением признаков, отличным от нормального, выполняли с помощью критерия Манна—Уитни. Различия считали статистически значимыми при p<0,05. Для анализа корреляций использовали непараметрический метод с использованием ранговой корреляции Спирмена. Сравнение распределения качественных признаков проводили с использованием критерия Фишера. Непрерывные переменные, имеющие нормальное распределение, представляли как М±σ, где М — среднее и σ — стандартное отклонение. Непрерывные переменные, распределение которых отличалось от нормального, представляли медианой и 25—75% квартилями. Для выявления связи между отдельными показателями проводили корреляционный анализ по Пирсону.
Результаты
У больных ОИМ проанализирована с помощью ВСУЗИ-ВГ 91 КА: 35 инфаркт-связанных, 56 инфаркт-несвязанных. У больных СС выполнили ВСУЗИ-ВГ 32 симптом-связанных артерий, 6 симптом-несвязанных. Выявлено 130 АСБ: 70 у больных ОИМ и 60 у больных СС. При анализе данных ВСУЗИ-ВГ проводили сравнение АСБ по следующим направлениям: 1) инфаркт-несвязанные АСБ у больных ОИМ и все АСБ у больных СС; 2) инфаркт-несвязанные АСБ у больных ОИМ и симптом-связанные АСБ у больных СС; 3) инфаркт-несвязанные АСБ у больных ОИМ и симптом-несвязанные АСБ у больных СС.
Сравнение показателей в «серой шкале» ВСУЗИ. Следующие показатели ВСУЗИ в «серой шкале» у больных ОИМ были значимо выше, чем у больных СС (табл. 2): ППА АСБ, ООБ, положительное ремоделирование в зоне АСБ, СПА в области АСБ, мин. ППА в группе с ОИМ была достоверна меньше.
 Инфаркт-несвязанные АСБ у больных ОИМ характеризовались достоверно большим общим объемом АСБ, ППА АСБ, СПА, ИР и меньшей МПП при сравнении со всеми АСБ у больных СС. При сопоставлении только инфаркт-несвязанных поражений у больных ОИМ и симптом-несвязанных со СС АСБ у больных ОИМ отличались большим общим объемом АСБ, ППА АСБ, СПА, ИР. Следует отметить, что даже по сравнению с симптом-связанными АСБ инфаркт-несвязанные АСБ у больных ОИМ имели больший ППА АСБ, СПА, более высокое ИР.
Инфаркт-несвязанные АСБ у больных ОИМ характеризовались достоверно большим общим объемом АСБ, ППА АСБ, СПА, ИР и меньшей МПП при сравнении со всеми АСБ у больных СС. При сопоставлении только инфаркт-несвязанных поражений у больных ОИМ и симптом-несвязанных со СС АСБ у больных ОИМ отличались большим общим объемом АСБ, ППА АСБ, СПА, ИР. Следует отметить, что даже по сравнению с симптом-связанными АСБ инфаркт-несвязанные АСБ у больных ОИМ имели больший ППА АСБ, СПА, более высокое ИР.
Сравнение показателей ВСУЗИ-ВГ. При сравнении инфаркт-несвязанных АСБ в группе ОИМ и всех АСБ в группе СС получены следующие результаты:
- объем фиброзно-липидного компонента 11,22 (25—75% квартили от 9 до 13,4) и 10,8 (25—75% квартили от 8,9 до 12,7) мм3 (p=0,02); объем кальция 9,27 (25—75% квартили от 3,48 до 15,05) и 8,9 (25%-75% квартили от 5,52 до 12,4) мм3 (p=0,02), по данным ВСУЗИ-ВГ, были больше у больных ОИМ;
- АСБ в группе ОИМ отличались меньшим объемом фиброзного компонента — 41,2 (25—75% квартили от 4,45 до 58) и 50,8 (25—75% квартили от 19,7 до 71,2) мм3 (p=0,002) и процентным содержанием фиброзного компонента — 50,85% (25—75% квартили от 41,45 до 60,25%) и 41,21% (25—75% квартили от 26,68 до 55,75%) по сравнению с таковыми у больных СС (p=0,002);
- индекс уязвимости был выше в группе ОИМ — 4,7 (25—75% квартили от 3 до 6,05) и 4 (25—75% квартили от 3,36 до 4,7; p=0,47).
При сравнении инфаркт-несвязанных поражений у больных ОИМ и симптом-несвязанных поражений у больных СС достоверных различий по процентному отношению компонентов АСБ не выявлено. Сравнение объемных показателей компонентов АСБ представлено в табл. 3.
При сравнении инфаркт-несвязанных поражений у больных ОИМ и симптом-связанных у больных СС симптом-связанные в группе СС характеризовались бо'льшим объемом некротического компонента — 42,82 (25—75% квартили от 2,94 до 82,71) и 21 (25—75% квартили от 12,92 до 29) мм3 (p=0,017) и фиброзного компонента — 61,66 (25—75% квартили от 48,81 до 74,50) и 41,2 (25—75% квартили от 4,45 до 58) мм3 (p=0,0001).
Сравнение показателей ВСУЗИ-ВГ: фенотипы АСБ. Частота распределения различных типов АСБ в группе ОИМ представлена на рис. 2.
Частота ФАТК среди больных ОИМ составила 57%, среди больных СС 25% (p=0,01), т.е. почти у каждого второго больного ИМ и четвертого больного СС выявлялись ФАТК (рис. 3). У больных СС симптом-связанные поражения представляли собой ФАТК в 31% случаев, симптом-несвязанные — в 17%.
Больные ОИМ и СС были разделены на подгруппы в зависимости от наличия или отсутствия хотя бы одной ФАТК. Группа ОИМ с ФАТК отличалась большим ППА АСБ (67,7 и 44%; p=0,001), общим объемом АСБ (220 и 89 мм3; p=0,11), положительным ремоделированием в зоне АСБ (1,12 и 0,88; p=0,001). В этой подгруппе чаще наблюдались артериальная гипертония (78,4 и 21,6%; p=0,58), сахарный диабет (21,6 и 15,15%; p=0,48), гиперлипидемия (78,4 и 68,4%; p=0,23).
ФАТК в симптом-связанных и симптом-несвязанных артериях. У больных ОИМ значительно чаще ФАТК выявлялись в инфаркт-несвязанных артериях — 89% случаев, у больных СС — в симптом-несвязанных в 26,7% (p=0,016). Эти различия, вероятно, обусловлены распространением нестабильных АСБ за пределы инфаркт-связанной артерии. В симптом-связанных (инфаркт-несвязанных у больных ОИМ) артериях ФАТК определялись у 73,3% больных СС и у 11% больных ОИМ (p=0,01).
Распределение ФАТК по КА. Были обнаружены достоверные различия по распределению ФАТК между КА (p=0,003). ФАТК чаще выявляли в огибающей артерии (ОА) — 22 (37,9%), затем в правой КА (ПКА) — 15 (25,8%), в передней нисходящей артерии (ПНА) — 12 (20,7%) и в стволе левой КА (ЛКА) — 9 (15,5%). При оценке распределения ФАТК у больных СС частота их выявления была достоверно выше в ПНА, чем в ОА и ПКА (11 (64,7%), — 2 (11,76%) и 4 (23,52%) соответственно (р=0,01), в стволе ЛКА ФАТК выявлено не было. Различия между группами были недостоверными (p=0,44). Результаты представлены на рис. 4.
Локализация ФАТК в КА. АСБ чаще обнаруживали в проксимальном (56,9%) и среднем (18,97%) отделах КА в инфаркт-несвязанных и симптом-несвязанных артериях (p=0,016). Протяженные АСБ, располагающиеся в 2 сегментах артерии и более, отличались большим ООБ (p=0,001), объемом некротического компонента (p=0,001), объемом кальция (p=0,001).
 При исследовании связи между типом АСБ и степенью сужения артерии АСБ были разделены на 2 группы. В 1-ю группу вошли АСБ, которые, по данным количественного анализа, суживали просвет артерии от 20 до 49% (55 АСБ), ко 2-й группе были отнесены АСБ, суживающие просвет артерии от 50 до 90% (75 бляшек). Выявлено, что ФА являлась основным типом АСБ (63,6% в 1-й группе и 36% во 2-й; p=0,018), но при незначимой АСБ достоверно чаще, независимо от степени сужения артерии. ФАТК и КАФАТК чаще встречались при гемодинамически значимых стенозах (25,3 и 12,7%, 22,7 и 9% соответственно).
При исследовании связи между типом АСБ и степенью сужения артерии АСБ были разделены на 2 группы. В 1-ю группу вошли АСБ, которые, по данным количественного анализа, суживали просвет артерии от 20 до 49% (55 АСБ), ко 2-й группе были отнесены АСБ, суживающие просвет артерии от 50 до 90% (75 бляшек). Выявлено, что ФА являлась основным типом АСБ (63,6% в 1-й группе и 36% во 2-й; p=0,018), но при незначимой АСБ достоверно чаще, независимо от степени сужения артерии. ФАТК и КАФАТК чаще встречались при гемодинамически значимых стенозах (25,3 и 12,7%, 22,7 и 9% соответственно).
ROC-анализ. Для ИР точкой разделения, характерной для больных ОИМ, обладающей наибольшей чувствительностью (60,9) и специфичностью (86,7), являлось значение 1,072, прогностическая ценность положительного результата 90,5% (рис. 5). 100% специфичностью оказался ИР, равный 1,276 и более. Для ППА АСБ точкой разделения, обладающей наибольшей чувствительностью (95,7) и специфичностью (88,3), было значение 52%, прогностическая ценность положительного результата 90,4%. ППА АСБ, равный 70% и более, обладал 100% специфичностью для больных ОИМ. Для остальных показателей точки разделения не обладали высокой чувствительностью и специфичностью.
Проведен анализ корреляции между уровнем биомаркеров (C-реактивного белка – СРБ, мозгового натрийуретического пептида – МНП) и основными морфометрическими показателями АСБ по данным ВСУЗИ. Не было выявлено корреляции между уровнем СРБ и содержанием некротической части (r=0,06). Обнаружена слабая положительная корреляция — между СРБ и ППА АСБ (r=0,19; p<0,05). Не было выявлено значимой связи между уровнем биомаркеров и объемом АСБ, МПП, ИУ, ИР, ИЭ, наличием ФАТК.
Выявлена положительная корреляция между ППА АСБ и уровнем ОХС (r=0,34; p<0,05), сахарным диабетом (r=0,23; p<0,05), гиперлипидемией (r=0,41; p<0,05), АГ (r=0,22; p<0,05).
Факторы, увеличивающие риск образования ФАТК. Используя многофакторный анализ, мы определили независимые факторы, увеличивающие риск образования ФАТК: ОИМ, гиперлипидемия, большой ППА АСБ, артериальная гипертония (табл. 4).
Таким образом, были выявлены следующие достоверные различия по данным ВСУЗИ коронарных артерий между больными ОИМ и СС:
- у больных ОИМ значительно чаще выявлялись ФАТК (57 и 25%; p=0,01), даже по сравнению с симптом-связанными поражениями у больных СС (57 и 31%; p=0,04);
- АСБ у больных ОИМ отличались значимо большим объемом АСБ, ООБ и меньшим значением мин. ППА;
- у больных ОИМ обнаружено более выраженное положительное ремоделирование в зоне АСБ (большое значение ИР);
- по данным ВСУЗИ-ВГ, содержание некротического компонента было выше у больных ОИМ, а фиброзного – у больных СС;
- ФАТК у больных ОИМ чаще встречались в ОА (с учетом стентирования инфаркт-связанной артерии), у больных СС – в ПНА. Достаточно часто ФАТК у больных ОИМ обнаруживались в стволе ЛКА (15,5%);
- нестабильные типы АСБ ассоциировались со степенью стеноза;
- была определена слабая положительная корреляция — СРБ и ППА АСБ. Выявлена положительная корреляция между ППА АСБ и уровнем ОХС, сахарным диабетом, гиперлипидемией, АГ;
- не было выявлено достоверной корреляции между уровнем биомаркеров и объемом АСБ, МПП, ИУ, ИР, ИЭ, наличием ФАТК.
Во многих случаях с помощью ВСУЗИ выявляют выраженное атеросклеротическое поражение артерий с признаками нестабильности в отсутствие клинически значимых стенозов. На рис. 6 (см. цветную вклейку) представлены результаты КГ и ВСУЗИ фрагмента ПНА. При минимальных ангио-графических изменениях по данным ВСУЗИ определяется объемная АСБ с положительным ремоделированием сосуда, большим липидно-некротическим ядром. Таким образом, ВСУЗИ дает существенную дополнительную информацию о характере и тяжести поражения КА.
Обсуждение
В нашем исследовании показано, что у больных ОИМ (исключая инфаркт-связанные поражения) признаки нестабильности в КА определялись чаще, чем у больных СС. Поражения сосудов при ИМ отличались бо'льшим процентом площади артерии, занимаемой АСБ, общим объемом АСБ и меньшей минимальной площадью просвета артерии, более выраженным положительным ремоделированием в зоне АСБ. АСБ при ИМ характеризовались более высоким содержанием некротического компонента и меньшим содержанием фиброзного компонента. Нестабильный тип АСБ ассоциировался со степенью стеноза.
В ряде исследований с использованием ВСУЗИ-ВГ было показано, что у больных ОКС симптом-связанные поражения чаще были представлены ФАТК и содержали больший процент некротического компонента по сравнению с таковым у больных СС [8, 14, 15]. В работах, в которых в качестве метода визуализации использовали оптическую когерентную томографию, у больных ОКС идентифицировали ФАТК в 64,7% случаев и в 14,9% в группе СС [16].
В аналогичной работе Т. Kubo и соавт. [17] частота ФАТК у больных ОКС и СС составила 38,5 и 6,3% соответственно. I. Jang и соавт. [18] сообщили, что ФАТК у больных ОКС с подъемом ST (72%) и ОКС без подъема ST (50%) обнаруживали чаще, чем в группе СС (20%) в симптом-связанных артериях. В нашем исследовании у больных ОИМ ФАТК чаще идентифицировали в инфаркт-несвязанных артериях — 89% случаев, у больных СС — в 26,7% (p=0,016). В симптом-связанных артериях наблюдалась обратная тенденция у больных СС в 73,3 и 11% случаев у больных ОИМ (p=0,01), что, вероятно, обусловлено выполнением ВСУЗИ после эндоваскулярного лечения инфаркт-связанного поражения. При оценке распределения ФАТК у больных ОИМ частота их выявления была достоверно выше в ОА, затем в ПКА и ПНА. Это было обусловлено более частым стентированием ПНА (инфаркт-связанной артерии).
В исследовании PROSPECT у 46,7% больных ОКС встречались ФАТК в симптом-несвязанных артериях [19]. В нашем исследовании ФАТК являлись симптом-несвязанными поражениями в 57% случаев. Т. Kunimasa и соавт. [20] проводили мультиспиральную компьютерную томографию КА больным ОКС и СС. В симптом-несвязанных артериях у больных ОКС чаще выявлялись АСБ с низкой плотностью (<30 HU), что свидетельствовало о наличии некротического ядра. В нашей работе было показано, что ФАТК чаще встречаются как в инфаркт-связанных, так и в инфаркт-несвязанных артериях у больных с ОИМ. Таким образом, ФАТК у больных с ОИМ выявляются во всех артериях, т.е. процессы дестабилизации АСБ не ограничиваются инфаркт-связанной артерией, а затрагивают все коронарное русло.

Связь между распространенностью ФАТК и уровнем CРБ была показана в нескольких исследованиях [21, 22]. А. Burke и соавт. [23] сообщили, что у больных с ФАТК более высокий уровень СРБ. В нашей работе у больных ОИМ был достоверно выше уровень СРБ. Однако корреляции между повышенным уровнем СРБ и наличием ФАТК или высоким показателем некротического компонента выявлено не было.
В исследовании Liverpool IVUS-V-HEART [24] изучали симптом-связанные АСБ у больных ОКС (n=70) и СС (n=35). При помощи ВСУЗИ-ВГ определили 4 показателя, которые являлись отличительной особенностью симптом-связанного поражения при ОКС: индекс уязвимости, мин. ППА менее 4 мм2, индекс ремоделирования более 1,05 и ФАТК. На основании этих особенностей была построен показатель Liverpool Active Plaque Score для определения нестабильных АСБ. По нашим данным, у больных ОИМ по сравнению с больными СС были выявлены достоверные различия по тем же показателям, за исключением индекса нестабильности. Необходимы дальнейшие более крупные исследования для формирования четкого представления о том, какие признаки нестабильности и их сочетания обладают наибольшей предсказательной способностью.
Остается открытым вопрос о необходимости активного лечения, в частности инвазивного, АСБ, имеющих признаки нестабильности на основании ВСУЗИ и ОКТ, которые, по данным КГ, гемодинамически незначимы. В исследовании REVERSAL [25] было показало, что с помощью аторвастатина в дозе 80 мг наступает стабилизация АСБ в КА. В исследовании ELAN больным ОКС проводили ВСУЗИ, с момента госпитализации назначали розувастатин и с помощью повторного ультразвукового исследования, выполненного через 6 мес, оценивали состояние КА [26]. Оказалось, что в большинстве случаев доля липидного компонента в АСБ уменьшилась. В 2012 г. были опубликованы результаты пилотного исследования SECRITT по изучению самораскрывающихся стентов с ультратонким каркасом [27]. Были включены 23 больных с ФАТК, выявленных методом ВСУЗИ и ОКТ (поражения гемодинамически незначимые по ангиографии и значениям функционального резерва кровотока). У 13 больных было выполнено стентирование ФАТК саморасширяющимися нитиноловыми стентами VSHIELD, 10 проводилась стандартная консервативная терапия. Через 6 мес наблюдения в группе VSHIELD стеноз был неизменным при определении фракционного резерва кровотока. Толщина покрышки в начале исследования составляла 48±12 мкм, в конце увеличилась до 201±168 мкм. Через полгода наблюдения не было смертей от сердечно-сосудистых заболеваний ни в одной из групп. Исследование показало, что лечение нестабильных АСБ саморасширяющимися устройствами VSHIELD представляется безопасным и приводит к восстановлению нормальной толщины фиброзной капсулы. Дальнейшие долгосрочные, проспективные исследования необходимы для оценки эффективности инвазивного лечения нестабильных АСБ.
В заключение важно отметить, что визуализация АСБ в КА представляет собой важное и перспективное направление. Вот лишь некоторые возможности, открывающиеся с помощью выявления нестабильных АСБ:
- Выявление группы высокого риска среди клинически стабильных больных ишемической болезнью сердца и лиц с факторами риска, и проведение у этой категории больных интенсивных профилактических и лечебных мероприятий.
- Уточнение показаний к лекарственной терапии и проведению инвазивных методов лечения.
- Контроль эффективности проводимой терапии с возможной коррекцией доз препаратов и продолжительности лечения.
Заключение
Инфаркт-несвязанные поражения коронарных артерий у больных острым инфарктом миокарда имели больше признаков нестабильности по сравнению с поражениями у больных стабильной стенокардией: бо'льшая площадь просвета артерии, занимаемая атеросклеротической бляшкой, бо'льший общий объем атеросклеротической бляшки, чаще обнаруживалось положительное ремоделирование, фиброатерома с тонкой покрышкой. Независимыми факторами, увеличивающими риск образования фиброатеромы с тонкой покрышкой, являлись острый инфаркт миокарда, гиперлипидемия, большой объем атеросклеротической бляшки, артериальная гипертония.



