Острый коронарный синдром (ОКС) — ведущая причина смертности и инвалидности населения экономически развитых стран. Непосредственной причиной развития ОКС в большинстве случаев служит внутрикоронарный тромбоз, формирующийся на поверхности нестабильной атеросклеротической бляшки (АСБ). Термин «нестабильная АСБ» внедрен J. Muller и соавт. в 1989 г. [1]. Авторы предложили концепцию о не ограничивающих кровоток стенозах, которые в результате внезапного разрыва или эрозии АСБ и острого коронарного тромбоза приводят к развитию инфаркта миокарда (ИМ).
К настоящему времени сформировалось четкое представление о морфологических и функциональных особенностях, отличающих нестабильную АСБ от стабильной. К основным признакам нестабильной АСБ относят следующие (рис. 1, см. цв. вклейку): активное воспаление (инфильтрация фиброзной покрышки и адвентиции клетками воспаления, в основном макрофагами, активированными T-клетками и тучными клетками); крупное, богатое липидами ядро (>40% от объема АСБ); тонкая (<65 мкм) фиброзная покрышка; эрозии интимы АСБ; надрыв покрышки АСБ; поверхностно расположенные узелки кальция; кровоизлияние в АСБ.
Выделяют 2 основных типа нестабильных АСБ: фиброатерома с тонкой покрышкой (ФАТК) и эрозированная АСБ [3]. ФАТК — тип АСБ, отличающийся повышенным риском разрыва. Характерными особенностями ФАТК являются наличие крупных липидно-некротических очагов в сочетании с критическим истончением фиброзной покрышки АСБ. На основании ряда работ, включающих патогистологические исследования, у пациентов, умерших от ИМ, установлено, что ФАТК является самым распространенным субстратом коронарного тромбоза. ФАТК часто обнаруживают у больных без симптомов и в непричастной к симптомам артерии у больных, которым проводится вмешательство на другом сосуде. Несколько реже (приблизительно в 30% случаев) при проведении аутопсий выявляют эрозированные АСБ. Для последних характерно образование тромбоза на поверхности покрышки, отсутствие эндотелиальной выстилки при сохранении толщины последней.
Визуализация нестабильных АСБ в коронарных артериях (КА) представляет собой очень важное диагностическое направление. Вот лишь некоторые возможности, открывающиеся с помощью выявления нестабильных АСБ:
- Выявление группы высокого риска среди клинически стабильных больных с ишемической болезнью сердца (ИБС) и лиц с факторами риска, и проведение у этой категории больных интенсивных профилактических и лечебных мероприятий.
- Определение и уточнение показаний к лекарственной терапии и применению инвазивных методов лечения.
- Контроль эффективности проводимой терапии с возможной коррекцией доз препаратов и продолжительности лечения.
До настоящего времени не существует общепринятых методик для выявления нестабильных АСБ. Это диагностическое направление в основном остается в рамках научных исследований. Все методы можно разделить на 2 группы — инвазивные и неинвазивные. Основное преимущество инвазивных методик — большая разрешающая способность, возможность четкой визуализации и определения размеров всех компонентов АСБ. С помощью инвазивных методов можно выявить большую часть характерных для нестабильных АСБ морфологических признаков. Ограничения инвазивных методов — сложность обследования, необходимость госпитализации, осложнения процедуры, относительно высокая стоимость. Преимущества неинвазивных методов — доступность, возможность широкого использования на амбулаторном уровне, вплоть до обследования при диспансеризации. В этой части обзора представлены основные инвазивные инструментальные методики, с помощью которых обнаруживают нестабильные АСБ. Инвазивные методики в настоящее время используются главным образом как дополнительные при проведении коронарографии (КГ).
Внутрисосудистое ультразвуковое исследование (ВСУЗИ). Позволяет провести точный анализ структуры изучаемого сегмента артерии. С помощью ВСУЗИ получают изображение не только просвета артерии, но и оценивают структуру сосудистой стенки [4], что дает возможность провести детальный качественный анализ АСБ, выявить признаки ее структурной нестабильности, наличие пристеночных тромботических масс, диссекции. ВСУЗИ может давать диагностическую информацию, недоступную при выполнении ангиографии. С использованием серой шкалы производится формирование двухмерного изображения в реальном времени. ВСУЗИ может выявить низкую эхогенность, позитивное ремоделирование и кальциевые включения. Такие характеристики АСБ чаще наблюдаются у пациентов с ОКС, чем при стабильной ИБС [5, 6]. При помощи видеоденситометрического анализа серой шкалы можно оценить некоторые компоненты АСБ, однако этот метод не позволяет с точностью определить все ее структуры. Это связано с особенностями серой шкалы, разрешающая способность которой 300 мкм. Вследствие этого она не является оптимальным способом для точной оценки состава АСБ.
К ограничениям ВСУЗИ относятся невозможность визуализации интимы, изучения сосудов с диаметром просвета меньше 1,5 мм, низкая чувствительность при выявлении тромбов, инвазивность.
При количественной оценке изображений в серой шкале определяются следующие параметры: площадь просвета, общая площадь сосуда, процент стеноза от площади, максимальный и минимальный диаметры просвета, индекс симметричности просвета, максимальная и минимальная толщина АСБ, индекс эксцентричности АСБ, максимальный и минимальный диаметры сосуда, процент стеноза от диаметра.
Для уточнения структуры АСБ в качестве ультразвукового стандарта принимается эхоплотность адвентиции. Существует следующая качественная эхографическая классификация АСБ: 1) гомогенные АСБ (>80% площади такой АСБ составляют компоненты одинаковой эхоплотности), которые разделяют на «мягкие» АСБ, «твердые» АСБ, кальцинированные АСБ; 2) гетерогенные АСБ, которые состоят из различных компонентов (компоненты одной эхоплотности занимают не >80% площади АСБ).
J. Kotani и соавт. [7] провели ВСУЗИ 78 КА у 38 пациентов с острым ИМ. Было установлено, что нестабильные АСБ имели 3 отличительные особенности по данным ВСУЗИ: положительное ремоделирование, пристеночный тромбоз и большой объем АСБ. M. Yamagishi и соавт. [8] использовали ВСУЗИ для определения связи между морфологическими особенностями АСБ и последующими коронарными событиями. У 114 больных по данным КГ выявлены гемодинамически незначимые стенозы до 50%. У 12 (11%) больных в дальнейшем развился ИМ. У этих пациентов по данным ВСУЗИ по сравнению с группой без коронарных событий АСБ характеризовались большим липидным ядром.
Возможности ВСУЗИ существенно расширяются с помощью цифровой обработки изображения, при которой участки с различной плотностью окрашиваются в разные цвета. Такой анализ получил название «виртуальная гистология» (ВГ). Этот подход позволяет разграничить различные гистологические структуры АСБ: липидную, фиброзную и кальцинированную. Разрешающая способность метода 110—150 мкм [9, 10]. С помощью ВГ всем компонентам АСБ присваивается цветная кодировка: зеленый (фиброзная ткань), светло-зеленый (состоящий из фиброзной и жировой ткани), красный (некротическое ядро) и белый (кальций). При сравнении значений ВСУЗИ-ВГ с гистологическими данными КА установлено, что чувствительность метода для определения кальцификации составляет 100%, фиброза — 94%, липидного пула — 84% [11]. На основании ВСУЗИ с ВГ АСБ в зависимости от морфологических особенностей классифицируются следующим образом (рис. 2, см. цв. вклейку):
- Патологическое утолщение интимы: АСБ занимает >40% площади поперечного сечения артерии. АСБ может содержать все компоненты, но в основном фиброзно-жировой. Некротическое ядро и кальциноз составляют <10% общего объема АСБ.
- Фиброзная АСБ: АСБ занимает >40% площади поперечного сечения артерии, некротическое ядро и кальций составляют <10% общего объема АСБ, фиброзно-липидный компонент <15%.
- Фиброзно-кальцинированная АСБ: АСБ занимает >40% площади поперечного сечения артерии, в основном состоит из фиброзной ткани с содержанием кальция >10% и объемом некротического ядра <10% общего объема АСБ.
- Фиброатерома — АСБ с содержанием некротического ядра >10% общего объема АСБ, покрыто толстой, хорошо визуализируемой фиброзной капсулой.
- Фиброатерома с тонкой покрыщкой. АСБ занимает >40% площади поперечного сечения артерии. ВСУЗИ за счет своей пространственной разрешающей способности (80—120 мкм) не позволяет точно определять толщину фиброзной капсулы. Однако возможно косвенно судить о наличии тонкой капсулы, толщина которой менее разрешающей способности ВСУЗИ, по отсутствию фиброзной ткани, отделяющей просвет сосуда от некротической части на протяжении не <30°; большому некротическому ядру (>10%); содержание кальция <10% общего объема АСБ.
- Кальцинированная фиброатерома с тонкой капсулой: ФАТК с содержанием кальция >10% общего объема АСБ.
Эта классификация в значительной степени отражает последовательные стадии развития атеросклеротического поражения.
С помощью ВСУЗИ-ВГ можно обнаружить наиболее опасный тип АСБ — ФАТК. В 2008 г. M. Hong и соавт. [13] сообщили о частоте и распределении ФАТК, выявленных у пациентов с ОКС (105 больных) и стабильной стенокардией (107 больных) при ВСУЗИ-ВГ исследовании 3 основных КА. Было показано, что на одного пациента с ОКС приходилось 2,5±1,5 ФАТК и 1,7±1,1 ФАТК у больных со стабильной стенокардией (р<0,001), 83% ФАТК были расположены в пределах 40 мм от ствола левой КА.
В исследовании CULPLAC [14] 189 больным с ОКС выполнили ВСУЗИ-ВГ. Выявлено 293 поражений, ФАТК являлся наиболее частым фенотипом АСБ (55,1% симптом-связанных, 36,6% симптом-несвязанных поражений; p=0,007). ФАТК были разделены на 4 типа: I — ФАТК с содержанием кальция <5%; II — объем кальция >5%; III — с многочисленными зонами некроза; IV — некротическое ядро >20% общего объема бляшки, кальций >5%, индекс ремоделирования >1,05, и объем АСБ >50%. Поражения, ответственные за ОКС, наиболее часто являлись ФАТК подтипа IV.
В многоцентровое исследование PROSPECT были включены около 700 больных с ОКС [15]. Всем больным проводили ВСУЗИ-ВГ исходно, через 1 и 6 мес, 1, 2 и 3 года и при развитии неблагоприятных исходов. Все больные на момент включения подверглись стентированию симптом-связанной артерии. За период наблюдения у 20% больных развились коронарные события, из которых более половины не были связаны со стентированной симптом-связанной артерией. В случае выявления АСБ с тонкой фиброзной покрышкой относительный риск неблагоприятных исходов, связанных с нелеченой ранее артерией, увеличивался в 3,8 раза. Если АСБ с тонкой фиброзной покрышкой сочеталась с объемом АСБ >70% площади поперечного сечения артерии, риск увеличивался почти в 11 раз. Вместе с тем выраженное сужение площади просвета (минимальная площадь просвета <4 мм2 для основных ветвей левой и правой КА, для ствола левой КА <6 мм2), которое можно было обнаружить как с помощью коронарной ангиографии, так и методом ВСУЗИ, почти не отражалось на прогнозе. Следовательно, большинство исходно нелеченых с помощью стентирования бляшек, которые впоследствии привели к коронарным событиям, по данным КГ, были незначительными, но имели признаки нестабильности на ВСУЗИ-ВГ. Аналогичные результаты получены в ряде других исследований [16].
В исследовании VIVA [17] 177 больным со стабильной стенокардией и ОКС (тропонин-позитивные) выполнялось ВСУЗИ-ВГ 3 основных КА до и после стентирования симптом-связанной артерии. Средний период наблюдения составил 625 дней. Развилось 19 коронарных событий (смерть, ИМ и незапланированная реваскуляризация). Было изучено 1096 бляшек. У 13 поражений, приведших к коронарным событиям (изначально не симптом-связанные), имелись определяемые при ВСУЗИ признаки ФАТК, АСБ объемом >70% и минимальной площадью просвета <4 мм2. ВСУЗИ-ВГ с большой точностью идентифицировало поражения, которые в последующем могут привести к развитию сердечно-сосудистых осложнений (ССО).
В 2014 г. опубликованы результаты исследования ATEROMA, целью которого было определение прогностического значения нестабильных АСБ по данным ВСУЗИ у больных с ИБС [18]. Изучались АСБ в симптом-несвязанных артериях у больных с ОКС (n=318) и стабильной ИБС (n=263). Первичной конечной точкой были кардиальная смерть, развитие ОКС и незапланированная реваскуляризация. Частота возникновения ССО в течение 1 года составила 7,8%. Наличие ФАТК и объем АСБ >70% были независимыми предикторами развития ССО. ФАТК с объемом АСБ >70% были ассоциированы с ССО как до, так и после 6 мес наблюдения (p<0,001). ФАТК с меньшим объемом АСБ — только после 6 мес.
В исследовании HORIZONS-AMI 63 больным с ИМ с подъемом сегмента ST было проведено ВСУЗИ. Выявлено 99 симптом-несвязанных поражений, не подвергавшихся чрескожным коронарным вмешательствам (ЧКВ). Через 13 мес выполнено повторное ВСУЗИ. Частота выявляемых ФАТК увеличилась с 41 до 54%, частота фиброатером с толстой покрышкой снизилась с 41 до 34%. Минимальная площадь просвета артерии в месте ФАТК уменьшилась с 8,1 мм2 в начале исследования до 7,8 мм2 при последующем наблюдении (р<0,05). Наиболее частым вариантом симптом-несвязанных поражений у больных ИМ с подъемом сегмента ST была ФАТК. В течение 13-месячного периода наблюдения отмечалось уменьшение минимальной площади просвета и увеличение некротического ядра в АСБ.
ВСУЗИ во многих случаях позволяет выявить разрыв АСБ, при этом результаты совпадают с данными аутопсии.
G. Rodriguez-Granillo и соавт. [19] определяли структуру АСБ с помощью ВСУЗИ-ВГ у 40 пациентов с ОКС. У 50% больных выявлен разрыв АСБ, которые отличались большой площадью поперечного сечения и выраженным положительным ремоделированием. В другом исследовании АСБ с разрывом, приводящие к развитию ОКС, имели больший объем и меньший просвет артерии по сравнению с АСБ, которые не приводили к клиническим событиям [20]. В исследовании М. Hong и соавт. 235 больным (122 с ИМ, 113 со стабильной стенокардией) выполнялось ВСУЗИ. Разрыв АСБ в симптом-связанном сосуде выявлялся у 66% больных с ИМ и 27% со стабильной ИБС, в симптом-несвязанных артериях — у 17 и 5% соответственно [21]. G. Rioufol и соавт. [22] выполнили ВСУЗИ 24 пациентам с острым ИМ (ОИМ), было выявлено 50 бляшек с разрывом, у 17 (79%) больных имелись АСБ с разрывом покрышки в 2 артериях и у 3 (12,5%) — разрывы во всех 3 артериях.
В другом исследовании провели ВСУЗИ инфаркт-связанных артерий у 102 пациентов. Множественные нестабильные АСБ с разрывом покрышки отмечали у 10% больных, причем у 9 (8,8%) пациентов имелись по 2 такие АСБ в одной артерии, а у 1 пациента — 4 АСБ [23]. В подобном исследовании [24] показано, что у 15% больных с ОКС имелись множественные нестабильные АСБ, из них у 66,7% — 2 нестабильные АСБ в 1 артерии, у 18% больных — в 3 артериях. Таким образом, нестабильные АСБ определялись как в симптом-связанных, так и в симптом-несвязанных артериях, а это указывает на то, что процессы нестабильности не ограничиваются симптом-связанной артерией.
Преимущественное расположение АСБ определяется особенностями локальной гемодинамики. Локализация формирования АСБ обусловлена местным напряжением сдвига, сопротивлением, возникающим между током крови и эндотелием сосудистой стенки. В участках с низким сопротивлением сдвига чаще формируются АСБ, высокое сопротивление сдвига увеличивает риск разрыва АСБ [25]. Данный феномен может объяснить преимущественную локализацию ФАТК [26—28].
ВСУЗИ было использовано для изучения местного напряжение сдвига, создаваемого кровотоком в КА. Для оценки данного показателя используются трехмерные реконструкции сосудов и определенные с помощью специального программного обеспечения показатели гидродинамики. На основании ангиографии и ВСУЗИ создаются трехмерные реконструкции сосудов с оценкой местного напряжения сдвига, которые позволяют идентифицировать нестабильные АСБ.
В 2012 г. опубликованы результаты проспективного исследования PREDICTION [29]. 374 больным с ОКС после ЧКВ выполнялось ВСУЗИ 3 основных КА и повторное ВСУЗИ через 6—10 мес. Проводилась трехмерная реконструкция структуры артерий с помощью ангиографии, ВСУЗИ с оценкой местного напряжения сдвига. Неблагоприятные события в течение 1 года наблюдения встречались редко: 1 (0,2%) больной умер, у 4 (0,8%) возник ОКС (не связан с рестенозом), 15 (3%) больных были госпитализированы со стенокардией. Постепенно прогрессирующие поражения имелись в участках с низким напряжением сдвига. Большой объем АСБ и низкое местное напряжение сдвига являлись независимыми предикторами прогрессирующих поражений, приведших к развитию стенокардии, по поводу которой проводилось ЧКВ.
ВСУЗИ-эластография — одна из разновидностей ВСУЗИ. Метод основан на том, что ткани различной плотности имеют разную эластичность и по-разному деформируются в ответ на механическое раздражение (пульсовая волна). Такое расширение возможностей ВСУЗИ позволяет использовать методику не только для получения изображения структур стенки, но и как способ оценки механических свойств сосуда. Показано, что различные по структуре АСБ имеют разные скорости деформации, и это может быть записано в виде эластограмм [30, 31]. Нестабильные АСБ отличаются высокой скоростью деформации в области фиброзной покрышки по сравнению с областями с низкой скоростью деформации в соседних областях. Основываясь на том, что степень деформации соответствует плотности ткани, определяют «мягкие» АСБ с повышенным содержанием липидов. J. Schaar и соавт. [32] сравнивали результаты ВСУЗИ-эластографии с гистологическим исследованием. Анализировались поперечные срезы артерий у больных с ОКС, полученные в течение 24 ч после вскрытия. По данным гистологического исследования, нестабильная АСБ определялась как АСБ с объемом некротического ядра >40%, тонкой фиброзной покрышкой (<250 мкм), с умеренной и выраженной инфильтрацией макрофагами. Нестабильные АСБ в основном находились в области сосудистой стенки с самой высокой степенью деформации на поверхности.
В исследовании PROSPECT 114 больным с ОКС были выполнены ВСУЗИ-ВГ и эластография. Из 488 АСБ 111 оказались ФАТК, 213 — кальцинированные фиброатеромы с толстой покрышкой, 164 — некальцинированные фиброатеромы с толстой покрышкой. Результаты были сопоставлены с результатами эластографии. У 16 больных в течение 3,4 года развились неблагоприятные исходы (сердечная смерть, остановка сердца, ИМ, нестабильная стенокардия). У данной группы фиброатеромы отличались большей площадью АСБ — 10,0 мм2 (8,4—11,6 мм2) и 8,2 мм2 (7,7—8,8 мм2; p=0,03). По данным эластографии, степень деформации между различными подтипами фиброатером в двух группах не различалась. Эластография не предоставила дополнительной диагностической информации для идентификации фиброатером с высоким риском разрыва и прогнозирования ССО при длительном наблюдении.
Другое перспективное направление использования ВСУЗИ — оценка эффективности терапии, направленной на стабилизацию АСБ. В исследовании ELAN больным с ОКС с момента госпитализации назначали розувастатин. Выполняли ВСУЗИ исходно и через 6 мес [34]. Оказалось, что в большинстве случаев доля липидного компонента в АСБ уменьшилась.
Технология ВСУЗИ активно развивается и совершенствуется. Появилось ВСУЗИ высокого разрешения — high definition (HD) IVUS, при котором используют датчики частотой 60 МГц, что вместе с большой скоростью протяжки датчика позволяет приблизиться к разрешающей способности оптической когерентной томографии, сохраняя преимущества ультразвука в отношении визуализации сосудистой стенки.
Вместе с тем следует отметить, что выявленные с помощью ВСУЗИ изменения в КА не всегда позволяют прогнозировать течение болезни. Это убедительно показано в клиническом примере, опубликованном в журнале Circulation в 2013 г. [35]. Период наблюдения составил 74 мес, за время которого больному выполнено 6 ВСУЗИ. У 56-летнего мужчины с ОКС в симптом-несвязанной передней нисходящей артерии было выявлено 5 АСБ: 3 нестабильные (2 ФАТК, 1 АСБ с надрывом покрышки), 2 стабильные, по данным серой шкалы ВСУЗИ. Через 10 мес появилась стенокардия. По результатам ангиографии и ВСУЗИ показаний к проведению эндоваскулярного лечения не было. Проводилась консервативная терапия. На 22-й месяц наблюдения в связи с прогрессированием стенокардии до III функционального класса стабильная АСБ с минимальной площадью просвета 1,8 мм2 была стентирована. Спустя год (33-й месяц наблюдения) возобновилась стенокардия. Выполнено стентирование сосуда в области стабильной АСБ с минимальной площадью просвета 1,9 мм2. Через 3 и 4 года (69-й и 74-й месяцы наблюдения) отмечены эпизоды нестабильной стенокардии, не требующие эндоваскулярного вмешательства. Рестенозов за весь период наблюдения не возникало. В данном клиническом случае клинически проявляющиеся стенозы были обусловлены прогрессированием стабильных АСБ, в то время как нестабильные АСБ оставались морфологически без изменений или стабилизировались и не приводили к ишемическим осложнениям.
Оптическая когерентная томография. Внутрисосудистая оптическая когерентная томография (ОКТ) сначала использовалась в офтальмологии, а в последние годы все активней применяется в кардиологии. Способ получения изображения при ОКТ близок к ультразвуковому, но для визуализации используются не звуковые, а инфракрасные волны. Внутрисосудистая ОКТ КА впервые выполнена D. Huang и соавт. в 1991 г. [36]. Разрешающая способность светового датчика (интерферометра) в 10 раз выше ультразвукового. ОКТ позволяет визуализировать с высокой точностью стенку КА и компоненты атеросклеротической АСБ: фиброзную капсулу, липидную часть, прилегающую к фиброзной покрышке, кальциноз. При помощи ОКТ можно определить степень инфильтрации фиброзной покрышки клетками воспаления, пристеночный тромбоз, неоинтиму, неоваскуляризацию.
Толщина интимы обычно составляет 3—4 мкм. Интима представлена на ОКТ ярким сигналом внутренней эластической мембраны. Медиа представлена темным и гомогенным сигналом, адвентиция — сигналом высокой интенсивности. Фиброзные АСБ визуализируются яркими и гомогенными. Богатые липидным компонентом АСБ представлены сигналом низкой интенсивности с нечеткими границами. Кальцинированные АСБ выглядят как сигнал низкой интенсивности с резко очерченными границами.
Ограничением ОКТ является низкая проникающая способность в глубину артериальной стенки (на 2—3 мм), поэтому объем АСБ не всегда может быть определен. Другое ограничение метода обусловлено необходимостью замещения крови во время исследования контрастным препаратом, что связано с некоторым увеличением риска развития осложнений процедуры и ее продолжительности.
В исследовании M. Kawasaki и соавт. [37] изучалось 128 измененных фрагментов КА и проведен корреляционный анализ между изображениями, полученными при помощи ОКТ, ВСУЗИ и при гистологическом исследовании. КА анализировали при аутопсии в течение не более 8 ч после смерти. Чувствительность ОКТ для определения кальциноза, фиброза, липидного пула и гиперплазии интимы при сопоставлении с данными гистологического исследования составила 100, 98, 95 и 86% соответственно, специфичность ОКТ — 100, 94, 98 и 100% соответственно. Чувствительность ВСУЗИ для определения кальциноза, фиброза и липидного компонента составила 100, 93 и 67%, а специфичность — 99, 61 и 95% соответственно.
Толщина фиброзной покрышки АСБ считается важнейшим фактором ее стабильности. У нестабильных АСБ толщина покрышки уменьшена и составляет <65 мкм [38]. В отличие от ВСУЗИ, пространственная разрешающая способность которого находится в диапазоне 80—120 мкм, ОКТ имеет разрешающую способность 10—15 мкм, поэтому позволяет точно определять толщину фиброзной капсулы [39] (рис. 4, см. цв. вклейку).
Глубинные структуры АСБ и особенности ремоделирования сосуда лучше определяются с помощью ВСУЗИ с ВГ, так как проникающая способность ультразвука выше. В связи с этим для получения полной информации о структуре АСБ многие эксперты считают оправданным использование обоих методов: ОКТ — для визуализации поверхностных структур,
ВСУЗИ-ВГ — для оценки соотношения структур в пределах всего объема АСБ и определения характера ремоделирования артерии. Так, I. Jang и соавт. [40] использовали ОКТ и ВЗУСИ для визуализации АСБ. Они получили изображения 42 АСБ в КА. Преимуществом ОКТ явилась способность обнаруживать гиперплазию интимы и истончение фиброзной покрышки АСБ (<65 мкм).
Одним из важных преимуществ ОКТ является возможность четкой визуализации повреждений интимы и покрышки АСБ: диссекции, разрыва, эрозии покрышки [41—43] (рис. 5, см. цв. вклейку). Диссекция чаще возникает на границе АСБ и неизмененной артерии в связи с различной эластичностью ткани. Диагностика диссекции основана на визуализации тонких подвижных краев надорванной интимы (медии) в просвете артерии. Разрыв определяется как дефект покрышки АСБ с образованием полости в АСБ, в этой зоне липидный пул контактирует с просветом сосуда. Эрозия выглядит как потеря непрерывности покрышки, без образования полости. У 30 больных с ОИМ (время от начала симптомов составило 3,8±1,0 ч) были проведены ОКТ, ВСУЗИ и ангиоскопия. Исследованию подвергалась инфаркт-связанная АСБ. Разрыв АСБ по данным ОКТ обнаруживается в 73% наблюдений, при ангиоскопии в 47% (p=0,035) и в 40% при ВСУЗИ (p=0,009). С помощью ОКТ значительно чаще выявляли эрозию покрышки АСБ (23%), чем при ангиоскопии (3%), методом ВСУЗИ эрозии АСБ не выявлялись. Внутрикоронарный тромбоз был обнаружен во всех случаях при ОКТ и ангиоскопии и в 33% по данным ВСУЗИ. Только при помощи ОКТ было возможно оценить толщину фиброзной покрышки, которая составила 49±21 мкм. Таким образом, метод ОКТ дает возможность хорошо определять внутрисосудистые тромбы, оценивать толщину покрышки АСБ [44].
Пристеночные тромбы визуализируются как массы, выступающие в просвет сосуда. На основании морфологических особенностей тромбы разделяют на «красные», содержащие большое количество эритроцитов, и «белые», которые в основном состоят из лейкоцитов и тромбоцитов. «Красные» тромбы идентифицируются как структура в полости артерии с сигналом высокой интенсивности, дающая тень, за которой сигнал полностью экранирован. «Белые» тромбы отображаются как образования с интенсивным сигналом, которые проецируются на стенку сосуда и ослабляют сигнал к этой области, но в меньшей мере, чем красные (рис. 6, см. цв. вклейку). Для КА характерно образование «белых» тромбов. I. Jang и соавт. показали [45], что частота обнаружения тромботических масс с использованием ВСУЗИ значительно ниже, чем с помощью ОКТ, у пациентов с ОИМ. Тем не менее отличить тромбы от других тканей, аномально появляющихся в просвете сосуда, не всегда возможно. Остаточное количество крови в коронарном сосуде как результат недостаточной ее замены прозрачным раствором может имитировать тромбы.
При помощи ОКТ можно в определенной степени судить об инфильтрации фиброзной покрышки клетками воспаления [46]. Высокая плотность макрофагов может оказаться очень важным фактором для определения риска разрыва ФАТК. Исследования, выполненные в 00-х годах XXI века, показали, что ОКТ способна идентифицировать макрофаги как пятна с высокой интенсивностью сигнала [47]. При помощи ОКТ можно выявить лишь достаточно большие скопления клеток воспаления, >30 мкм в диаметре. G. Tearney и соавт. [48] провели сравнительное исследование ОКТ и иммуногистохимического анализа материалов после аутопсии, определяющего содержание макрофагов в АСБ. Изучено 26 сегментов аорты и КА. ОКТ этих участков показала высокую корреляцию с плотностью содержания макрофагов в области фиброзной покрышки (r=0,84; p<0,0001). K. Kato и соавт. показали [49], что инфильтрация АСБ макрофагами у больных с ОКС присуща не только симптом-связанным, но и симптом-несвязанным поражениям. В области разрыва АСБ плотность макрофагов была значимо выше, чем в участках без разрыва. Большая плотность макрофагов обнаружена у пациентов с нестабильной стенокардией в различных участках артерий, как в фиброзных, так и в богатых липидами АСБ [50, 51].
В исследовании О. Raffel и соавт. у больных с ОКС высокую плотность макрофагов чаще обнаруживали в ФАТК [52].
Метод ОКТ дает возможность идентифицировать неоваскуляризацию (vasa vasorum) как микроканалы в АСБ (рис. 7, см. цв. вклейку). Увеличение неоваскуляризации в АСБ служит одним из признаков нестабильности. У 63 больных ИБС выполнялись ОКТ и ВСУЗИ [53]. Пациенты были разделены на 2 группы в зависимости от наличия или отсутствия vasa vasorum. АСБ с разрывом (50 и 28%; р=0,11), истончение фиброзной покрышки (60 и 100 мкм; р=0,001), ФАТК (54 и 21%; р=0,012), положительное ремоделирование АСБ (67 и 36%; р=0,02) чаще определялись у больных в группе vasa vasorum. Сходные данные получены в исследовании S. Uemura и соавт. [54].
В исследовании K. Kato и соавт. у 104 больных с разными формами ИБС методом ОКТ было выявлено 248 симптом-несвязанных поражений: 45 АСБ у больных с ОКС и 203 АСБ у больных со стабильной ИБС [56]. У больных с ОКС АСБ имели большое по объему липидное ядро, измеренный по формуле липидная дуга × длина липидного ядра (1605,5±1013,1 и 853,4±570,8; p<0,001). ФАТК (64,7 и 14,9%; р<0,001), инфильтрация макрофагами (82,4 и 37,9%; р=0,001), тромбоз (29,4 и 1,1%; р<0,001) чаще встречались в группе ОКС. Распространенность vasa vasorum не различалась между группами. Следовательно, симптом-несвязанные поражения у больных с ОКС имели чаще признаки нестабильности.
В последние годы появилась новая технология ОКТ, получившая название «ОКТ в частотной области» (frequency domain OCT). Преимуществами данного метода являются быстрая протяжка (40 мм/с), высокое качество изображения, отсутствие необходимости использовать окклюзирующий баллон, высоко-скоростная обработка информации, позволяющая немедленно получать изображения поперечного среза. Первое клиническое исследование с использованием данной методики было опубликовано в 2011 г. [57]. В работе оценивали оптимальность установки стента в КА.
В настоящее время ОКТ все чаще используется при проведении коронарного стентирования. Страты стента видны как сплошные полосы, поскольку металл не пропускает свет. Это дает возможность оценить взаиморасположение стратов стента и окружающей их интимы. ОКТ дает более достоверную информацию о распространении неоинтимы на стратах стентов и позволяет определить толщину слоя [58, 59]. E. Regar и соавт. [60] продемонстрировали успешное применение метода для выбора оптимального места установки стента. Y. Suzuki и соавт. [61] показали, что применение ОКТ позволяет оптимизировать углы между стратами после раскрытия стентов с лекарственным покрытием, что позволяет ограничить рост неоинтимы. Высокое разрешение ОКТ имеет явное преимущество перед ВСУЗИ для количественной оценки степени гиперплазии неоинтимы [62].
Важнейшие базовые параметры имплантации стента, такие как диаметр сосуда и неправильная позиция страт, оцениваются с помощью ОКТ лучше, чем методом ВСУЗИ [63]. ОКТ выявляет различные осложнения при имплантации стентов — мальпозицию (наличие просвета между стенкой сосуда и ячейкой стента), диссекцию стенки сосуда проксимальнее или дистальнее имплантированного стента, диссекцию в стентированном сегменте, протрузию ткани между стратами стента. Если страты не раскрыты, повышается риск тромбоза стента (рис. 8, см. цв. вклейку).
Ангиоскопия. Коронарная ангиоскопия является методом прямой визуализации просвета артерии и позволяет характеризовать морфологию АСБ, выявлять пристеночный тромб и повреждения стенки: эрозии, трещины, надрывы. По данным ангиоскопии принято разделять АСБ на желтые и белые. Желтые АСБ богаты липидами, имеют тонкую покрышку. Белые АСБ имеют толстую покрышку с большим количеством фиброзной ткани. Желтые АСБ в ряде работ [39, 65] классифицируются в соответствии с интенсивностью окраски: 1 — светло-желтые, 2 — желтые, 3 — интенсивно-желтые (рис. 9, см. цв. вклейку). Неудобствами метода являются необходимость замещения крови изотоническим раствором натрия хлорида, субъективность оценки, невозможность изучения мелких сосудов.
М. Takano и соавт. [66] сопоставили данные ангиоскопии и ВСУЗИ. Авторы использовали ВСУЗИ-эластографию для измерения растяжимости и жесткости АСБ, а также степени положительного ремоделирования. Обнаружено, что желтые АСБ характеризуется повышенной растяжимостью, пониженной жесткостью и положительным ремоделированием. Белые, или стабильные, АСБ характеризовались низкой растяжимостью, повышенной жесткостью и отрицательным ремоделированием.
В работе Т. Kubo и соавт. [67] оценивалась взаимосвязь цвета АСБ по ангиоскопии и толщины фиброзной покрышки. У 25 больных с ОКС (14 — с нестабильной стенокардией, 11 — с ИМ) проводились ангиоскопия и ОКТ. Изучалось 77 поражений: 25 симптом-связанных, 52 симптом-несвязанных. Выделяли группы с белыми, светло-желтыми, желтыми и интенсивно-желтыми АСБ. Получены значимые различия в группах по толщине фиброзной покрышки. В первой группе толщина покрышки составила 389±74 мкм, во второй 228±51, в третьей 115±28 и 59±14 мкм в группе интенсивно-желтых АСБ (р<0,0001). В ФАТК оказались 80% интенсивно-желтых АСБ с толщиной покрышки <65 мкм.
В проспективном исследовании 552 пациентам с ИБС выполнялись КГ и ангиоскопия [68]. У 39 больных в течение периода наблюдения (57,3±22,1 мес) развился ОКС. У данной группы значительно чаще встречались желтые АСБ (3,1±1,8 и 2,2±1,5; p=0,008). В схожем исследовании [69] у больных с двумя и более желтыми АСБ в одном сосуде чаще развивался ОКС по сравнению с теми, кто имел не более 1 желтой АСБ (средний период наблюдения 4,8 года). У больных с ≥2 или ≥5 желтыми АСБ в одном сосуде соответственно в 2,2 и 3,8 раза чаще развивался ОКС.
Визуализация пристеночного тромбоза является важным преимуществом ангиоскопии. K. Okamatsu и соавт. обследовали 57 больных, перенесших ОКС без подъема сегмента ST, и установили, что АСБ с пристеночным тромбозом определялись лишь в 18% случаев при КГ, тогда как ангиоскопия позволяла обнаружить тромбоз у 86% больных [70]. В работе C. White и соавт. получены сходные результаты [71]. В другой работе 843 больным с ОКС выполнялись ангиография и ангиоскопия симптом-связанного сосуда [72]. Желтые АСБ были классифицированы по цветовой окраске на 3 степени. Частота выявления тромбоза зависела от интенсивности желтого цвета: 15, 26 и 52% на поверхности АСБ при цветовой окраске 1, 2 и 3-й степени соответственно.
Несмотря на то что методика ангиоскопии разработана давно, ее применение в клинической практике ограничено в связи со сложностью проведения, трудностью интерпретации результатов и небольшой информацией о внутренней структуре АСБ.
Спектроскопия в диапазоне, близком к инфракрасному. Метод основан на том, что разные ткани поглощают свет с различными длинами волн, создавая уникальный спектр поглощения, и это позволяет определить химический состав ткани. Разработан способ анализа липидного состава бляшек непосредственно в коронарных сосудах с помощью специального катетера и спектроскопии в диапазоне, близком к инфракрасному (ИК-спектроскопия). Оказалось, что именно в этом спектре хорошо различим липидный компонент АСБ.
В исследовании SPECTACL [73] сопоставили результаты спектроскопии КА у больных ИБС с результатами, полученными на основании аутопсии. Показано, что с помощью внутрисосудистой системы спектроскопии в ближней инфракрасной области возможно с большей точностью выявлять АСБ с липидным ядром.
Комбинация в одном приборе ВСУЗИ и ИК-спектроскопии позволяет получать ультразвуковое и инфракрасное изображение с помощью одного катетера и сопоставить анатомию и химический состав стенки. Результаты ИК-спектроскопии отражаются в виде хемограммы сосудистой стенки, состоящей из блоков по 2 мм. Высокая вероятность выявления липидного ядра на хемограмме исследуемого сегмента артерии обозначена желтым цветом (95% специфичность). Участки с низким содержанием липидов обозначены красным цветом (рис. 10, см. цв. вклейку). Для оценки количества липидов внутри каждого липидного ядра используется показатель — индекс липидного ядра АСБ [74].
S. Brugaletta и соавт. опубликовали в 2012 г. результаты работы [75], посвященной оценке распределения липидных ядер АСБ в симптом-несвязанных сосудах у больных со стабильной ИБС и ОКС при помощи ИК-спектроскопии. Длина исследуемого участка каждой артерии составляла 50 мм, анализировали отдельно каждые 10 мм сосуда. Липидные ядра АСБ в основном располагались в проксимальных участках передней нисходящей и огибающей артерии и более равномерно в правой КА.
ИК-спектроскопия помогает определить объемные поверхностные липидные включения с высоким риском развития эмболии по время стентирования. Метод в сочетании с ВСУЗИ все активнее используется при ЧКВ. Есть данные, что при использовании ИК-спектроскопии удается снизить частоту развития периоперационных осложнений, таких как ИМ, за счет более точного определения длины АСБ, тяжести поражения; это улучшает тактику и результаты стентирования [76]. ИК-спектроскопия позволяет оценить динамику содержания липидов в АСБ на фоне терапии статинами (исследование YELLOW) [77]. Перспективы использования ИК-спектроскопии в клинической практике неясны.
Термография. Известно, что нестабильные АСБ инфильтрированы воспалительными клетками, которые интенсивно потребляют глюкозу и кислород, выделяют тепло, что может вызвать локальное повышение температуры. Для термографии используются катетеры, способные определять повышение температуры в АСБ с активным воспалением. Разрешение метода — 0,02 °С, пространственное разрешение — 500 мкм. Ограничения метода: для точного измерения температурной неоднородности необходима временная окклюзия сосуда, расстояние от датчика до стенки сосуда должно быть <0,5 мм, что может травмировать стенку сосуда.
C. Stefanadis и соавт. показали, что у пациентов с нестабильной стенокардией и ИМ температура бляшек была выше, чем у пациентов со стабильной стенокардией и в контрольной группе [79]. В другом исследовании, выполненном теми же авторами, температуру измеряли в 5 точках вдоль интересующей области и рассчитывали разницу температур [80], которая у пациентов с нестабильной стенокардией была достоверно выше, чем у пациентов со стабильной стенокардией. За время наблюдения у пациентов, перенесших кардиологические осложнения, отмечался более высокий уровень разницы температур.
В то же время результаты ряда исследований показали, что изменения давления в коронарных сосудах и сам кровоток меняют температуру на поверхности артерии. Температурная неоднородность поверхности участков стенки с АСБ может быть обусловлена артефактами [81]. В настоящий момент в связи с отсутствием убедительных доказательств, что термография позволяет выявить нестабильные АСБ, технической сложностью, методика практически не используется.
Внутрисосудистая магнитно-резонансная томография (МРТ). Этот новый метод предусматривает проведение внутрисосудистой радиочастотной катушки в КА. МРТ позволяет визуализировать компоненты АCБ — некротическое ядро, фиброзную покрышку и воспалительный инфильтрат [82, 83]. В основе методики лежит способность дифференцировать компоненты АСБ на основании различного химического состава, содержания воды, молекулярного движения или диффузии [84]. Светлые области на изображениях соответствуют фиброзной ткани, темные области — зонам с высоким содержанием липидов. МРТ способна визуализировать пристеночный тромб и оценить его размеры и расположение [85]. Исследование КА in vivo с помощью внутрисосудистой МРТ пока проводилось только у животных. Получены интересные результаты в предварительных работах с использованием ex vivo аорты и КА. Внутрисосудистая МРТ позволяет выявить нестабильные АСБ с тонкой покрышкой. Данные, полученные in vivo, в подвздошных артериях человека показывают, что внутрисосудистая МРТ имеет преимущество в определении липидов, волокнистых и кальцинированных компонентов АСБ по сравнению с ВСУЗИ [86, 87].
Заключение
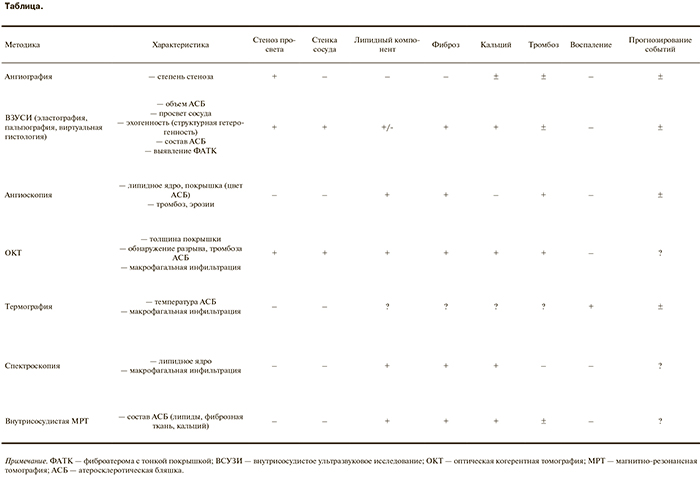
Инвазивные методики визуализации коронарных артерий (см. таблицу) позволяют получить самую подробную информацию о морфологических особенностях атеросклеротических бляшек, тяжести, распространенности процесса и т.д. Основным недостатком этих методов как раз и является инвазивность, которая ограничивает их широкое использование. В настоящее время наиболее актуальный вопрос — определение конкретных групп пациентов, которые могут получить пользу от инвазивной визуализации бляшек. Уже сейчас во многих ведущих клиниках проведение внутрисосудистого ультразвукового исследования или оптической когерентной томографии во время чрескожного коронарного вмешательства для уточнения тактики лечения и контроля положения стента является обычным обследованием. Вместе с тем потенциал этих методик намного выше. Индивидуальная стратификация риска на основании визуализации атеросклеротических бляшек может в значительной степени уточнить стратегию вторичной профилактики в отношении как выбора препаратов, так и продолжительности терапии. Наиболее актуальные вопросы в этом направлении связаны с интенсивной липид-снижающей и противовоспалительной терапией. В связи с тем что целесообразность обследования с помощью обсуждаемых методик для стратификации риска, уточнения лечебной тактики, коррекции терапии убедительно не доказана, самостоятельных показаний к проведению исследований нет. В этом направлении необходимы крупные исследования.
Остается открытым вопрос о необходимости инвазивного лечения нестабильных атеросклеротических бляшек, которые по данным коронарографии гемодинамически незначимы, но имеют признаки нестабильности по результатам внутрисосудистого ультразвукового исследования или оптической когерентной томографии. В декабре 2012 г. опубликованы результаты пилотного исследования SECRITT по изучению самораскрывающегося стента с ультратонким каркасом [88]. В исследование были включены больные с фиброатеромами с тонкой покрышкой, выявленными с помощью внутрисосудистого ультразвукового исследования и оптической когерентной томографии (поражения гемодинамически незначимые по ангиографии и значениям функционального резерва кровотока). Было выполнено стентирование нестабильных бляшек нитилоновыми саморасширяющимися стентами VSHIELD у 13 больных. Стеноз в области стентирования составлял в среднем 33,2±13,5%, функциональный резерв кровотока 0,93±0,06 до лечения. Через 6 мес наблюдения в группе VSHIELD стеноз составил 18,7±16,9%, функциональный резерв кровотока был неизменным. Толщина покрышки в начале исследования составляла 48±12 мкм, в конце увеличилась до 201±168 мкм. Через 6 мес наблюдения у стентированных больных не было неблагоприятных исходов. Исследование показало, что лечение нестабильных бляшек саморасширяющимися устройствами VSHIELD представляется безопасным и приводит к восстановлению нормальной толщины фиброзной капсулы. Очевидно, что в этом направлении необходимы проспективные исследования с «твердыми» конечными точками.
До сих пор отсутствуют четкие представления о том, какие признаки нестабильности и их сочетания обладают наибольшей прогностической способностью. Без этой информации невозможно сформировывать единый диагностический протокол. Польза от повторных исследований с учетом инвазивности методик также является предметом обсуждения. Можно предположить, что в ближайшие годы работы будут посвящены изучению этих вопросов и разработке новых диагностических подходов. Сочетание различных инвазивных и неинвазивных методик, использование биомаркеров может существенно расширить возможности обнаружения нестабильных бляшек. Уже сейчас интегрируют различные технологии в одном катетере. Комбинированное использование внутрисосудистого ультразвукового исследования и оптической когерентной томографии представляется наиболее перспективным.



