Повышенную дисперсию интервала QT (ΔQTc) принято рассматривать как признак неблагоприятного прогноза у широкой категории людей (здоровых, больных с врожденными заболеваниями сердца, ишемической болезнью сердца, инфарктом миокарда ― ИМ и др.). Основанием для такого заключения служат многочисленные исследования, свидетельствующие о том, что у пациентов, перенесших ИМ, ΔQTc выше, чем у лиц, не имевших в анамнезе ИМ, и существенно выше у лиц, имеющих пароксизмы желудочковой тахикардии, по сравнению с теми, у кого нарушения ритма сердца отсутствуют [1]. По мнению большинства исследователей, ΔQTc как маркер негомогенности реполяризации может быть использована для выявления групп высокого риска, в частности риска внезапной смерти [2―4]. В крупных исследованиях, таких как The Strong Heart Study (1839 участников) [5] и Роттердамское исследование (анализ более 5000 ЭКГ у лиц старше 55 лет) [6], подтверждена прогностическая значимость ΔQTc в отношении смерти по любой причине и в связи с сердечно-сосудистыми заболеваниями. Аналогично подгрупповой анализ исследования Val-HeFT (Valsartan Heart Failure Trial) показал, что ΔQTc>70 мс ассоциируется с повышением риска смерти [7, 8]. Несомненно, что значимости ΔQTc как предиктора смерти и аритмических осложнений особое внимание уделяют у пациентов с острым ИМ [9]. Важно, что ΔQTc определяет не только краткосрочные, но и долгосрочные прогнозы у пациентов с ИМ [10]. При этом указывают, что ΔQTc является чувствительным предиктором риска угрожающих жизни аритмий у пациентов, перенесших ИМ [11]. Причем ΔQTc является истинным фактором риска, так как она не только увеличивается при ишемии миокарда, но, что особенно важно, устранение ишемии приводит к отчетливому уменьшению выраженности ΔQTc. Это наблю-дают при успешно проведенной тромболитической терапии [12, 13] и при хирургическом восстановлении коронарного кровотока (в частности, при стентировании) [14, 15].
Важным моментом для дальнейшего прогноза является скорость уменьшения ΔQTc при устранении ишемии.
Так, если в ближайшие 6 ч уменьшение было маловыраженным, даже при восстановлении кровотока прогноз был неблагоприятным и смертность была выше (14,6% против 2,4%; p<0,001) [16].
Цель – оценить возможность препарата L-карнитина отечественного производства (элькар для внутривенного и внутримышечного введения, компания ПИК-ФАРМА) корригировать дисперсию QT у пациентов с ОКС.
Материал и методы
Дизайн исследования: проспективное двойное слепое рандомизированное плацебо-контролируемое в параллельных группах.
Критерии включения пациентов:
- наличие ОКС, отсутствие инвазивного коронарного вмешательства, возраст старше 18 лет.
- Наличие нестабильной стенокардии (НС):
- наличиеИМ
- типичный болевой приступ продолжительностью более 20 мин
- изменения на ЭКГ в виде подъемов или депрессий ST на ЭКГ.
- Появление новой блокады левой ножки пучка Гиса.
- Наличие повышенного уровня тропонина.
- Подписанное согласие пациента на проведение исследования.
Критериями невключения пациентов были: боли или изменения на ЭКГ, возникшие в связи с повышением артериального давления (АД) (более 180 и 100 мм рт.ст.); кардиогенный шок; хронические заболевания печени и почек с выраженными нарушениями функции (повышение активности аланинаминотрансферазы, аспартатаминотрансферазы более чем в 2 раза от верхней границы нормы и снижение уровня клубочковой фильтрации менее 30 мл/мин); наличие хронических интоксикаций (алкоголизм, наркомания); прием других препаратов метаболического действия.
Рандомизацию в группу плацебо и группу активного лечения проводили с помощью таблицы простых чисел.
Режим дозирования препарата. Способ введения препарата ― внутривенно капельно. Перед внутривенным введением содержимое ампулы растворяли в 100―200 мл растворителя (0,9% раствор хлорида натрия).
Препарат L-карнитина (элькар для внутривенного и внутримышечного введения, ООО «ПИК-ФАРМА», Россия) или плацебо назначали сразу после рандомизации.
Дозы: в течение первых трех сут по 2 г (по 4 ампулы) 2 раза в сутки (всего 8 ампул в сутки), с 4-е по 15-е сутки (или до выписки, если она происходила раньше) по 2 г (по 4 ампулы) 1 раз в сутки.
Продолжительность наблюдения ― не менее 15 дней или до выписки из стационара.
Оценка действия препарата. Анализировали параметры ЭКГ,зарегистрированной в покое в 12 общепринятых отведениях при скорости движения бумаги 25 мм/с в день поступления и затем на 2-е, 3, 5, 7 и 12―15-е сутки после госпитализации.
Измерение интервала QT производили вручную от места перехода изоэлектрической линии сегмента PQ (R) в зубец Q (R) до поздней точки зубца T, которую определяли как окончание зубца Т, в месте пересечения изоэлектрической линии ТР с касательной, проведенной по максимальному наклону нисходящей части волны Т. В отведениях, где имелась U волна, окончанием Т волны считалась низшая точка между двумя волнами U и Т. Измерение проводили во II стандартном отведении, интервал QT и предшествующий ему интервал RR измеряли не менее чем в трех последовательных циклах с расчетом средних значений. Для корректного измерения и клинической интерпретации интервала QT использовали формулу Базетта: QTс=QT/√RR, где QTс ― интервал корригированный QT, RR ― время между соседними зубцами R на ЭКГ.
Дисперсию интервала QTc (ΔQTc) определяли как разницу между максимальной и минимальной длительностью интервала QTc в каждом из 12 общепринятых отведений поверхностной ЭКГ (ΔQTc=QTc max – QTc min).
Статистическую обработку данных проводили с использованием пакета статистических программ SAS (Statistical Analysis System, SAS Institute Inc., США) – с применением параметрических и непараметрических алгоритмов вариационной статистики, учитывающих шкалы измерений каждого показателя. Для показателей, измеренных по интервальной шкале, рассчитывали средние значения, стандартные отклонения, ошибки среднего значения, медианы, интерквартильные размахи. Для показателей, измеряемых по номинальной (наличие/отсутствие) или ранговой шкале, определяли частоту регистрации разных порядковых оценок показателя в процентах. Необходимые размеры выборок для последующих межгрупповых сравнений вычисляли по специальным формулам, основанным на критериях хи-квадрат, Фишера и t Стьюдента. При анализе межгрупповых различий для показателей, измеренных по интервальной шкале, рассчитывали значения t-критерия Стьюдента для независимых выборок по соответствующим формулам в трех различных модификациях, учитывающих особенности статистического распределения конкретных показателей. Значимость внутригрупповой динамики таких показателей за период лечения оценивали по соответствующим t-критериям для парных измерений.
Результаты
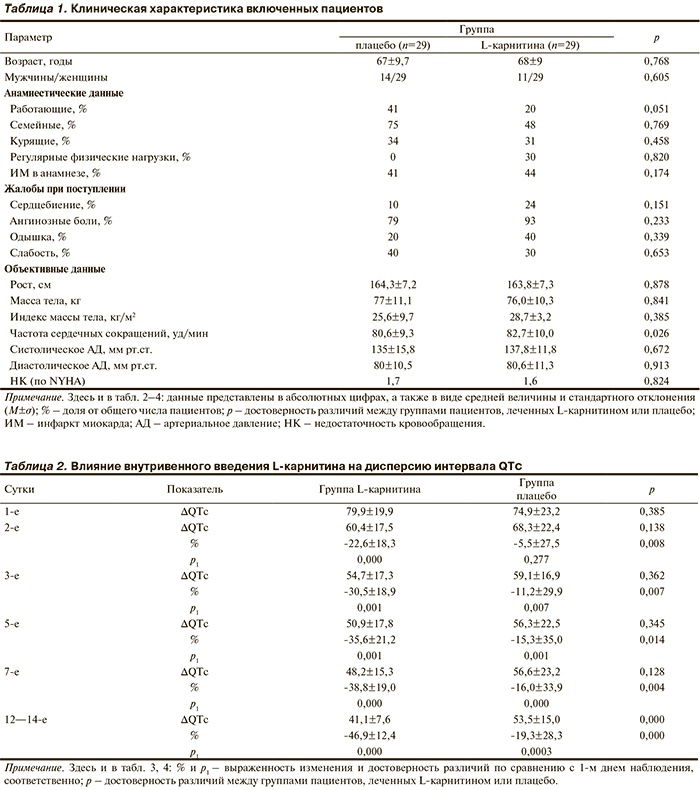
В соответствии с критериями включения и невключения в исследование вошли 58 пациентов, клиническая характеристика, которых приведена в табл. 1.
Как видно из приведенных данных, рандомизация была успешной и группы практически не различались по антропометрическим, анамнестическим и клиническим характеристикам, кроме частоты сердечных сокращений.
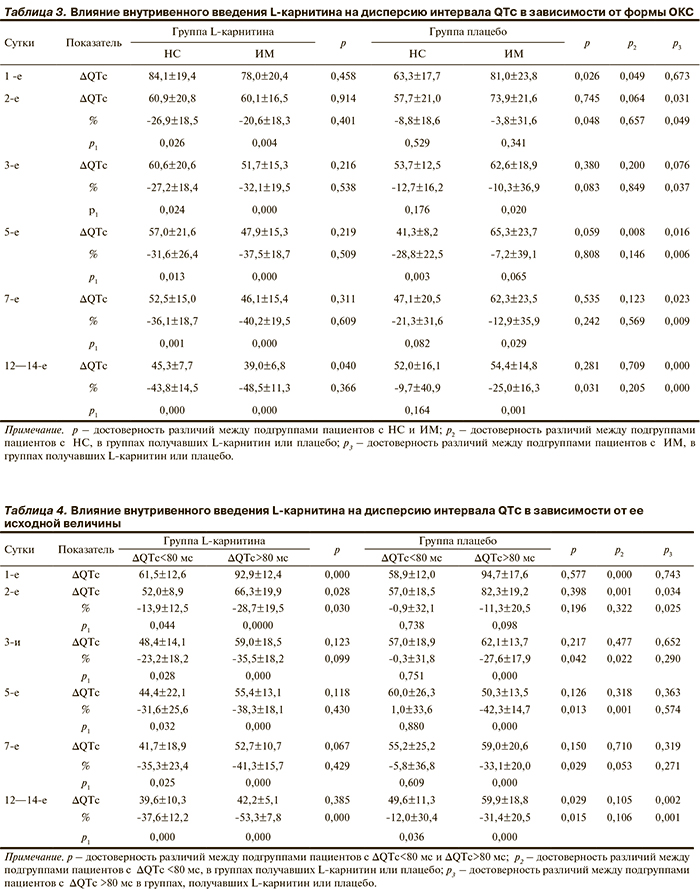
В среднем по группе обследованных величина ΔQTc приближалась к верхним границам нормы. Исходно ΔQTc>80 мс была выявлена у 29 (50%) из 58 больных ОКС, несколько чаще ― у пациентов с ИМ (51,2%), чем с НС (47,3%). Дисперсия QTc>80 мс выявлялась чаще в группе пациентов, леченных L-карнитином (58,6%), чем в группе плацебо (41,3%). Как видно из данных, представленных в табл. 2, в течение 12―14-дневного периода наблюдения ΔQTc уменьшалась в обеих группах (табл. 2).
Однако в группе L-карнитина достоверное снижение ΔQTc отмечено со вторых суток заболевания и выраженность снижения ΔQTc (в %) была больше, чем в группе плацебо в течение всего периода наблюдения.
Проведен анализ влияния L-карнитина на изменение ΔQTc в зависимости от типа ОКС (табл. 3), и пациенты были разделены на подгруппы с ИМ и НС. В группе пациентов, получавших L-карнитин, при обоих вариантах острого ОКС снижение ΔQTc носило достоверный характер с 1-го дня заболевания. В группе пациентов, получавших плацебо, при НС изменения не носили достоверного характера, а при ИМ достоверность отмечена к 7-м суткам заболевания. Важно, что во всех временных точках абсолютное значение ΔQTc и степень ее снижения при ИМ в группе пациентов, получавших L-карнитин была достоверно более выраженной.
Уменьшилось соответственно и число пациентов с бόльшей ΔQTc. На момент окончания наблюдения таковых осталось только 2 в группе плацебо. При анализе изменения ΔQTc в подгруппах в зависимости от ее исходной величины установлено (табл. 4), что у пациентов с исходными значениями ΔQTc≥80 мс снижение было выражено в большей степени, чем у пациентов с исходными значениями ΔQTc<80 мс. Это различие прослеживается наиболее отчетливо в группе плацебо, начиная с третьих суток заболевания. В группе пациентов, получавших L-карнитин, выраженность снижения ΔQTc в меньшей степени зависела от ее исходной величины и была достоверной в обеих подгруппах, начиная со 2-го дня заболевания. В группе пациентов, получавших L-карнитин, снижение ΔQTc было более выраженным, чем в группе плацебо, особенно у пациентов с исходно бόльшими величинами ΔQTc и к 12―14-м суткам наблюдения достигла статистически значимых различий.
Обсуждение
В рамках данного исследования показано, что лечение L-карнитином приводило к более выраженному и более быстрому улучшению одного из параметров, характеризующих электрическую стабильность миокарда у пациентов с ОКС. Наиболее выраженное влияние L-карнитин оказывал на больных, которых можно отнести к группе высокого риска, т.е. имеющих исходно ΔQTc>80 мс.
Известно, что дисперсия интервала QT увеличивается при острой ишемии, вызванной физической нагрузкой или ИМ [18, 19]. Дисперсия интервала QT отражает региональную неоднородность реполяризации (т.е. функционального восстановления) желудочков. Во многих работах показано повышение дисперсии реполяризации после острого ИМ и обосновано большое прогностическое значение данного показателя как предиктора возникновения в постинфарктном периоде опасных для жизни аритмий и внезапной смерти [19].
Ухудшение электрических свойств миокарда при ишемии связывают с истощением запасов L-карнитина в кардиомиоцитах. Причем уровень свободного и общего L-карнитина уменьшен в зоне ишемии и периишемической зоне [20, 21].
Можно полагать, что положительный эффект экзогенно введенного L-карнитина обусловлен его метаболическим цитопротективным действием [22]. Оптимизация выработки АТФ под влиянием L-карнитина обусловлена частичным торможением окисления длинноцепочечных жирных кислот в митохондриях за счет образования малонилкоэнзима А (КоА) ― физиологического ингибитора ключевого фермента, ответственного за транспорт жирных кислот
в митохондрии. Кроме того, L-карнитин удаляет из митохондрий и клеток токсичные метаболиты ацил-КоА, главным образом, короткоцепочечных ацил-КоА и ацилкарнитина, поддерживает баланс между ацил-КоА и свободным КоА, активирует пируватдегидрогеназу [23]. Обладая антиоксидантными свойствами, L-карнитин защищает клетки сердца от последствий окислительного стресса, гипоксии и ишемии [24, 25]. L-карнитин способен блокировать мега-пору митохондрий и, соответственно, подавлять процессы апоптоза и некроза кардиомиоцитов [26]. Комплексное воздействие L-карнитина на структурно-функциональное состояние кардиомиоцитов, по-видимому, и обусловило наблюдавшееся нами снижение дисперсии интервала QT и позволяет объяснить положительные эффекты этого препарата, наблюдавшиеся в различных клинических исследованиях у пациентов с ишемическим повреждением миокарда [22, 27].
Заключение
Внутривенное введение препарата L-карнитина (элькар для внуртивенного и внутримышечного введения, компания ПИК-ФАРМА, Россия) в ранние сроки острого коронарного синдрома в комбинации со стандартной терапией уменьшает выраженность дисперсии интервала QT и ускоряет процессы восстановления региональной неоднородности реполяризации желудочков, вызванной ишемией.



