Несмотря на успехи современной медицины, острый коронарный синдром (ОКС) является одной из основных причин, определяющих высокую смертность вследствие сердечно-сосудистой патологии как в Российской Федерации, так и во всем мире. В частности, согласно данным регистра Euro Heart Serveyon Acute Coronary Syndromes I, смертность и развитие острого инфаркта миокарда (ОИМ) в течение 6 мес после перенесенного ОКС составляет 10,2% [1—4].
В развитии ОКС решающую роль играет нарушение коронарного кровообращения чаще всего за счет воспаления и дестабилизации атеросклеротической бляшки и нарушений в свертывающей системе крови с формированием тромба в коронарном сосуде [5—7]. Роль воспаления и дисфункции эндотелия в атерогенезе и развитии ОКС отмечена многими авторами [8, 9]. Иммунное воспаление считается одним из клинически значимых факторов сочетания ишемической болезни сердца (ИБС) и тревожно-депрессивных расстройств (ТДР) [10, 11]. В основу предположения о том, что хроническая депрессия ассоциируется с хроническим воспалительным процессом, легли данные об ассоциированном с депрессией повышении уровня острофазовых белков в плазме крови [12]. Депрессия является не только фактором риска развития внутрисосудистого воспаления, но и повышает функциональную активность тромбоцитов, способст-вует возникновению тромботических осложнений у больных ИБС, однако механизмы взаимосвязи этих состояний до сих пор недостаточно изучены [13].
Данные, полученные в последние годы, свидетельствуют о том, что наличие сопутствующих ОИМ расстройств аффективного спектра (депрессии и тревоги) негативно влияет на его течение и прогноз [14—16]. Значение проблемы определяется еще и тем, что распространенность ТДР среди кардиологических больных достигает в среднем 20%, а по данным Всемирной организации здравоохранения, при сохранении существующих демографических тенденций к 2020 г. депрессия выйдет на второе место после ИБС по числу утраченных лет полноценной жизни [17]. Кроме того, сочетание ОИМ с ТДР у больных приводит к значительному увеличению частоты развития угрожающих жизни осложнений. Так, депрессия, развивающаяся непосредственно после ОИМ, в 3,5 раза повышает риск смертельного исхода болезни [18—20].
Целью настоящего исследования явилось изучение особенностей систем гемостаза и иммунитета у больных ОКС в сочетании с ТДР.
Материал и методы
В исследование включены 60 пациентов с ОКС (средний возраст 61,1±1,1 года, 29 мужчин и 31 женщина). Критериями включения в исследование являлись ОКС у пациентов обоего пола в возрасте от 35 до 75 лет в первые 24 ч поступления в стационар от начала заболевания, не принимавших до госпитализации антиагрегантов и антикоагулянтов и подписавших информированное согласие. Диагноз ОКС, а в дальнейшем нестабильной стенокардии или ОИМ устанавливали согласно Российским рекомендациям (версия 2007 г.) на основании результатов клинического обследования больного, изменений электрокардиограммы, лабораторных показателей и данных трансторакальной эхокардиографии [3]. Критерии исключения: сопутствующий сахарный диабет, беременность, тяжелая сопутствующая патология (почечная недостаточность, последствия инсульта), хроническая сердечная недостаточность III стадии, кардиогенный шок при поступлении в стационар, отсутствие информированного согласия.

Все больные в первые 72 ч после перевода из реанимационной палаты были протестированы с помощью Госпитальной шкалы тревоги и депрессии [21], опросника Бека [22], шкалы депрессии Центра эпидемиологических исследований США [23] и теста Спилбергера—Ханина для изучения уровня реактивной и личностной тревожности [24, 25]. При обследовании пациентов ТДР были выявлены у 27 (45%). У 33 (55%) пациентов расстройств аффективного спектра выявлено не было, на основании чего были сформированы две группы: 1-я — больные ОКС с ТДР, 2-я — больные ОКС без ТДР. С учетом наличия или отсутствия ТДР в табл. 1 и 2 представлены клинико-анамнестические характеристики обследованных пациентов, данные об амбулаторной и стационарной терапии больных ОКС приведены в табл. 3 и 4. Как следует из представленных данных, не выявлено статистически значимых различий между группами по анализируемым показателям.
Контрольная группа сформирована из 50 здоровых добровольцев без сердечно-сосудистых заболеваний (ССЗ), сопоставимых по полу и возрасту (средний возраст 56,9±1,4 года, 27 мужчин и 23 женщины). Все исследования выполнены с информированного согласия испытуемых.
Исследовали следующие показатели плазменного гемостаза: содержание фибриногена, международное нормализованное отношение (МНО), активированное частичное тромбопластиновое время (АЧТВ), уровень D-димера, растворимых фибрин-мономерных комплексов (РФМК), антитромбина III (АТ III) на анализаторе STA-COMPACT (Швейцария). Изучали показатели сосудисто-тромбоцитарного гемостаза: агрегацию тромбоцитов, спонтанную и индуцированную, с применением в качестве индукторов аденозиндифосфата (АДФ) в дозах 0,1 и 5 мкМ и адреналина в дозе 10 мкг/мл на агрегометре LA230-2 БИОЛА (Россия). Определяли концентрацию фактора Виллебранда (ФВ) в плазме крови [26].
Исследование фенотипа лимфоцитов крови проводили методом проточной цитометрии с использованием прямой иммунофлуоресценции цельной периферической крови с использованием моноклональных антител («Beckman Coulter», США), меченных FITC (fluoresceinisothiocyanate), PE или RD1 (phycoerythrin), ECD (phycoerythrin-TexasRed-X), PC5 (phycoerythrin-cyanin 5) и PC7 (phycoerythrin-cyanin 7) в следующих панелях: CD45-FITC/CD4-PE/CD8-ECD/CD3-PC5, CD45-FITC/CD56-RD1/CD19-ECD/CD3-PC5, CD5-FITC/CD45-PE/CD19-ECD/CD27-PC5, TCRpanγδ-PC5.
Для удаления эритроцитов пробоподготовку проводили по безотмывочной технологии с использованием лизирующего раствора OptiLyseC («Beckman Coulter», США). Анализ окрашенных клеток выполняли на проточном цитофлуориметре FC-500 («Beckman Coulter», США).

Исследование системы гемостаза и иммунитета осуществляли в первые 24 ч после госпитализации пациентов в палату интенсивной терапии и в динамике на 10-е сутки. В группе контроля проводили однократное исследование показателей систем гемостаза и иммунитета, а также тестирование для выявления ТДР.
Статистический анализ данных исследования проводили с помощью пакета программ Statistica 7.0 (StatSoft Inc., 2004). Данные представлены в виде абсолютных и относительных частот (n, %), медианы и интерквартильного размаха (25-й процентиль; 75-й процентиль). Различия между показателями независимых выборок (сравнение с показателями контрольной группы) оценивали по непараметрическому U-критерию Манна—Уитни. Различия между показателями зависимых выборок (сравнение в каждой группе больных между 1-ми и 10-ми сутками обследования) оценивали по непараметрическому критерию Вилкоксона. Различия считали статистически значимыми при p<0,05.
Результаты и обсуждение
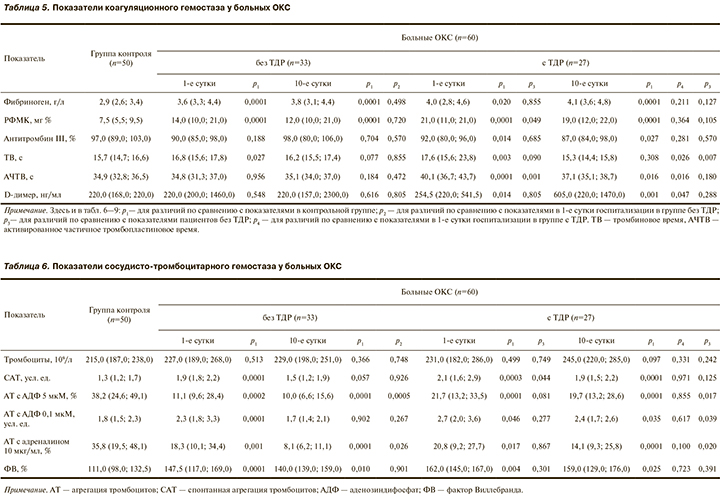
При оценке показателей коагуляционного гемостаза у всех пациентов с ОКС на всем протяжении исследования обнаружено повышенное содержание фибриногена и РФМК (табл. 5). Причем у больных ТДР уровни РФМК в 1-е сутки госпитализации выше показателей пациентов без аффективных нарушений, а уровень D-димера достоверно выше, чем в группе контроля на всех этапах обследования. При этом концентрация основного физиологического антикоагулянта — антитромбина III у больных ТДР ниже, чем в контроле на всех этапах обследования, тогда как в группе без аффективных нарушений он статистически значимо не отличается от значений контроля. Таким образом, у всех пациентов с ОКС наблюдаются гиперфибриногенемия и тромбинемия, более выраженные в группе пациентов с ТДР. Причем у больных ТДР выявлена выраженная активация внутрисосудистого свертывания с последующим фибринолизом.
Кроме того, выявлено, что в группах с ТДР и без них на всем протяжении наблюдения увеличены тромбиновое время и АЧТВ. Это можно объяснить применением нефракционированного гепарина в дозе 20 тыс. ед/сут: его получали 24 (72,7%) человек без аффективных нарушений, тогда как низкомолекулярный гепарин был назначен только 8 (29,6%) больным из группы с ТДР (см. табл. 5).
Оценивая динамику показателей сосудисто-тромбоцитарного гемостаза, следует уточнить, что до поступления в стационар больные не принимали антиагреганты. За время пребывания в стационаре ацетилсалициловую кислоту (АСК) в дозе 125 мг/сут получали 29 (87,9%) пациентов без ТДР и 24 (88,9%) больных с расстройствами тревожно-депрессивного спектра. Комбинация АСК в дозе 125 мг/сут с клопидогрелом в дозе 75 мг/сут была назначена 18 (54,5%) пациентам без ТДР и 16 (59,3%) больным с их наличием. Таким образом, различий по приему антиагрегантов между группами не было.
Несмотря на то что в отсутствие противопоказаний нагрузочную дозу АСК 250 мг/сут и клопидогрела 300 мг/сут пациенты с ОКС получали сразу при поступлении, в 1-е сутки госпитализации в обеих группах больных показатели спонтанной агрегации тромбоцитов (САТ) и стимулированной агрегации тромбоцитов (АТ) АДФ в дозе 0,1 мкМ превышали значения контроля (табл. 6). Кроме того, у больных ТДР значения САТ в 1-е сутки заболевания были выше, чем в группе без аффективных нарушений.
На фоне антиагрегантной терапии к выписке пациентов в группе без ТДР происходило снижение агрегации тромбоцитов в ответ на АДФ в дозе 5 мкМ и адреналин, тогда как САТ и АТ, индуцированные АДФ в дозе 0,1 мкМ, не снижались относительно уровней в 1-е сутки госпитализации и не отличались от показателей контроля. В группе больных ТДР также не происходило достоверного снижения САТ, АТ, индуцированных АДФ не только в дозе 0,1 мкМ, но и в более высокой — 5 мкМ и адреналином по сравнению с таковыми в 1-е сутки заболевания, что свидетельствует о сохранении значительной агрегационной активности тромбоцитов у пациентов этой категории. Причем значения АТ, индуцированной АДФ в дозе 5 и 0,1 мкМ и адреналином, у пациентов с ТДР на 10-е сутки заболевания достоверно превышали показатели больных без аффективных нарушений (см. табл. 6).
Уровень ФВ — маркера дисфункции эндотелия — был достоверно повышен в обеих группах больных на всем протяжении исследования (см. табл. 6). Эндотелий сосудов является ключевым регулятором сосудистого гомеостаза [27]. Установлено, что у пациентов с ССЗ повреждение эндотелия ассоциировано с увеличением сердечно-сосудистой смертности. Дисфункция эндотелия может быть одним из патогенетических звеньев взаимосвязи стресса, ТДР и прогрессирования ИБС [2].
При исследовании количества лейкоцитов и состояния Т-клеточного иммунитета обнаружено, что у больных ОКС независимо от ТДР в 1-е сутки госпитализации возрастает число лейкоцитов в периферической крови и остается повышенным на 10-е сутки пребывания в стационаре (табл. 7). У больных ОКС без ТДР выявляется достоверная динамика к снижению уровня лейкоцитов в крови. Процентное содержание лимфоцитов у больных ОКС понижено в 1-е сутки госпитализации, но в отсутствие ТДР к 10-м суткам наблюдается их восстановление до контрольного уровня, тогда как у больных ТДР относительный уровень лимфоцитов остается в этот период пониженным. Абсолютный уровень лимфоцитов у больных ОКС без ТДР в 1-е сутки госпитализации остается на контрольном уровне, но повышается к 10-м суткам. В то же время у больных ТДР абсолютное число лимфоцитов повышено относительно контрольного диапазона как в 1-е, так и на 10-е сутки пребывания в стационаре. Только у больных ОКС без ТДР в 1-е сутки госпитализации наблюдается снижение процентного содержания клеток CD3+, но при восстановлении до контрольных значений к 10-м суткам.
CD3 служит поверхностным маркером, специфичным для всех клеток субпопуляции Т-лимфоцитов — основных клеток иммунной системы, через которые реализуются механизмы адаптивного клеточного иммунитета [28]. При ряде воспалительных процессов наблюдается снижение числа Т-лимфоцитов в периферической крови [29, 30]. Известно, что повышение уровня соотношения нейтрофилы/лимфоциты является неблагоприятным фактором прогноза ССЗ [31, 32].
Необходимо отметить, что сниженное в 1-е сутки госпитализации число лимфоцитов у больных ОКС восстанавливается к 10-м суткам лечения в отсутствие ТДР, но сохраняется пониженным при наличии ТДР. Следовательно, у больных ОКС без ТДР даже на фоне пониженного содержания Т-лимфоцитов в периферической крови в 1-е сутки госпитализации можно прогнозировать более благоприятное течение заболевания, чем у больных ТДР.
Содержание В-лимфоцитов в периферической крови у больных ОКС в динамике лечения и в зависимости от ТДР изменяется незначительно (табл. 8). Только у больных без ТДР на 10-е сутки лечения выявляется повышение абсолютного содержания лимфоцитов CD19+ и CD19+CD5-.
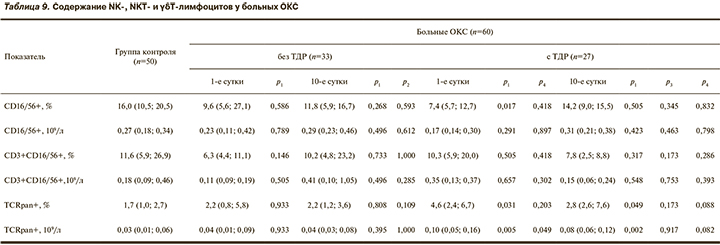
Только у больных ОКС с ТДР в 1-е сутки госпитализации значительно снижается процентное содержание клеток CD16/56+ и повышается относительное и абсолютное число лимфоцитов TCRpan+ (табл. 9). Причем высокое содержание клеток TCRpan+ у лиц данной группы сохраняется и на 10-й день лечения.
Естественные киллеры (CD16/56+) и gdТ-лимфоциты (TCRpan+) являются клетками врожденного иммунитета. Основная функция NК-клеток заключается в цитолизе клеток, несущих признаки трансформации, инфицирования или клеточного стресса, секретируя в окружающую среду интерферон γ, который активирует иммунные и воспалительные процессы [28, 33, 34]. γδТ-клетки составляют минорную субпопуляцию, представленную преимущественно в барьерных тканях. γδТ-лимфоциты выполняют функцию цитотоксических клеток, ограничивают интенсивность иммунного ответа в качестве регуляторных клеток, в лимфоидной ткани выполняют роль антигенпрезентирующих клеток и в барьерных тканях поддерживают выживаемость, функциональную активность и регенерацию эпителиальных клеток [28, 33, 35].
Следовательно, у больных ОКС с ТДР в 1-е сутки при снижении цитотоксической активности клеток системы неспецифической резистентности (за счет низкого содержания NK-клеток) повышается регуляторная стимуляция иммуновоспалительных процессов за счет фракции γδТ-лимфоцитов. К 10-му дню пребывания в стационаре у больных данной группы наблюдается восстановление содержания NK-клеток и сохранение повышенной регуляторной индукции γδТ-лимфоцитами иммуновоспалительных процессов.
Заключение
Полученные данные позволяют заключить, что у больных острым коронарным синдромом отмечается высокий уровень активации протромботического потенциала системы гемостаза, сохраняющийся в динамике заболевания. При этом у больных острым коронарным синдромом с сопутствующими тревожно-депрессивными расстройствами прокоагулянт-ная активность свертывающей системы крови выражена в большей степени, чем у пациентов без аффективных нарушений. Эти изменения у категории больных острым коронарным синдромом и тревожно-депрессивными расстройствами сочетаются со значительным угнетением антикоагулянтного потенциала крови. Несмотря на прием нагрузочных доз ацетилсалициловой кислоты и клопидогрела, у больных острым коронарным синдромом в 1-е сутки госпитализации наблюдается высокий уровень активации тромбоцитов, который более выражен у пациентов с сопутствующими тревожно-депрессивными расстройствами. На фоне антиагрегантной терапии у больных острым коронарным синдромом в целом можно отметить недостаточное гипоагрегационное действие препаратов на активность тромбоцитов, особенно в группе пациентов с тревожно-депрессивными расстройствами.
На всем протяжении обследования у больных острым коронарным синдромом независимо от наличия или отсутствия сопутствующих нарушений аффективного спектра выявляется высокий уровень фактора Виллебранда — маркера повреждения эндотелия.
При исследовании содержания лейкоцитов и фенотипического состава лимфоцитов периферической крови больных острым коронарным синдромом обнаружено увеличение числа лейкоцитов и снижение содержания лимфоцитов уже в 1-е сутки госпитализации. Высокий уровень лейкоцитов у больных сохраняется и на 10-й день пребывания в стационаре. Однако в отсутствие тревожно-депрессивного расстройства наблюдается восстановление числа лимфоцитов в крови к 10-му дню, тогда как при наличии тревожно-депрессивных расстройств снижение содержания лимфоцитов продолжается. Только у больных острым коронарным синдромом без тревожно-депрессивных расстройств выявляется низкий уровень Т-лимфоцитов и высокое содержание В-клеток (за счет фракции В2-лимфоцитов) в 1-е сутки госпитализации и последующее восстановление до контрольного уровня к 10-му дню. У больных острым коронарным синдромом с тревожно-депрессивными расстройствами дополнительно выявляется повышение иммунорегуляторной индукции воспалительных процессов за счет высокого содержания γδТ-лимфоцитов, но при снижении количества NK-клеток.
Таким образом, наличие у больных острым коронарным синдромом сопутствующих тревожно-депрессивных расстройств способствует не только развитию высокой прокоагулянтной готовности свертывающей системы крови и повышению функциональной активности тромбоцитов, но и снижению содержания лимфоцитов и повышению иммунорегуляторной индукции воспалительных процессов, что в конечном итоге является основным механизмом возникновения тромботических осложнений у больных ишемической болезнью сердца.