Согласно современным представлениям развитие острого коронарного синдрома (ОКС) в значительной степени связано с воспалительными процессами в атеросклеротической бляшке (АСБ). Подтверждением этого является обнаружение в «нестабильных» АСБ моноцитов, макрофагов и активированных Т-лимфоцитов, способствующих повреждению эндотелия и внутрисосудистому тромбообразованию [1—3]. Как следствие у больных с ОКС в периферической крови обнаруживаются признаки системной воспалительной реакции: повышение уровня маркеров воспаления (С-реактивного белка — СРБ [4, 5], интерлейкинов [6]).
В настоящее время опубликованы результаты ряда исследований, в которых выявлена четкая связь между уровнем СРБ и других маркеров воспаления с риском развития неблагоприятных исходов у больных с ОКС.
Если роль факторов приобретенного иммунитета в патогенезе ОКС активно изучается, то вклад факторов врожденного иммунитета в развитие ОКС остается неясным. Маннозосвязывающий лектин (mannose-binding lectin, MBL), называемый также протеином, связывающим маннозу, или маннан (MBP) — важный фактор врожденного иммунитета, участвующий в защите от бактерий, вирусов, грибов. Он запускает лектиновый путь активации комплемента, играет ключевую роль в фагоцитозе и опсонизации чужеродных организмов.
У детей низкий уровень MBL ассоциируется с рецидивирующими инфекциями [7—9]. Выявлена роль MBL в патогенезе аутоиммунных и онкологических заболеваний [10, 11].
Учитывая важную роль иммунных факторов в патогенезе ОКС, в последние годы активно изучают влияние факторов врожденного иммунитета, в том числе MBL, на развитие ОКС. В литературе содержатся противоречивые данные о влиянии концентрации MBL на риск развития ишемической болезни сердца (ИБС) и инфаркта миокарда (ИМ). В ряде работ показано защитное влияние MBL, по другим источникам получен обратный результат. Имеются неоднозначные данные о прогностической значимости как высокого уровня MBL [12—16], так и дефицита фермента у больных с ИМ [17—19]. Кроме того, имеются работы, в которых показано отсутствие влияния концентрации MBL на течение и прогноз атеросклероза.
 К клеточным факторам врожденного иммунитета относятся фагоцитарные факторы активности нейтрофилов: процент нейтрофилов, участвующих в фагоцитозе; фагоцитарное число — количество поглощенных частиц в одном фагоците; фагоцитарный резерв — соотношение показателей индуцированного и спонтанного НСТ-теста, отражающий бактерицидный резерв фагоцитов. Их роль в развитии сердечно-сосудистых заболеваний в настоящее время мало изучена.
К клеточным факторам врожденного иммунитета относятся фагоцитарные факторы активности нейтрофилов: процент нейтрофилов, участвующих в фагоцитозе; фагоцитарное число — количество поглощенных частиц в одном фагоците; фагоцитарный резерв — соотношение показателей индуцированного и спонтанного НСТ-теста, отражающий бактерицидный резерв фагоцитов. Их роль в развитии сердечно-сосудистых заболеваний в настоящее время мало изучена.
Принимая во внимание важную роль MBL и клеточных фагоцитарных факторов в воспалительных реакциях, представляется актуальным провести сравнительный анализ уровня этих показателей у больных с ОКС с учетом пола, возраста, общепринятых факторов риска развития ИБС и хорошо изученных биомаркеров (СРБ, мозговой натрийуретический пептид — BNP).
Материал и методы
В исследование были включены 45 больных с ОКС 30—70 лет независимо от пола. Контрольную группу составили 15 человек без ИБС такого же возраста.
Всем больным с ОКС с подъемом сегмента ST на электрокардиограмме — ЭКГ (ОКСпST) проведена тромболитическая терапия (ТЛТ) или транслюминальная баллонная ангиопластика со стентированием (ТБКА). ТЛТ проводили пациентам либо в стационаре, либо на этапе скорой медицинской помощи (догоспитальная ТЛТ). Эндоваскулярную реваскуляризацию выполняли как самостоятельный метод реперфузионного лечения (первичная ТБКА) или после ТЛТ. В дальнейшем больные получали стандартную медикаментозную терапию, включающую ацетилсалициловую кислоту, клопидогрел, β-адреноблокаторы, статины, ингибиторы ангиотензинпревращающего фермента, а также по показаниям мочегонные и другие препараты. При выявлении клинических и инструментальных признаков ишемии пациентам была рекомендована коронарография, а в дальнейшем эндоваскулярное или хирургическое лечение.
Больным с ОКС без подъема сегмента ST на ЭКГ (ОКСбпST) назначали стандартную лекарственную терапию, основу которой составляли антитромботические, антиангинальные препараты и статины. Помимо консервативного лечения отдельным больным с ОКСбпST проведена экстренная или плановая ТБКА.
Критерии исключения из исследования: злокачественные новообразования и другие тяжелые сопутствующие заболевания, самостоятельно влияющие на прогноз; вторичная нестабильная стенокардия, в частности обусловленная анемией, тиреотоксикозом, тахиаритмиями; повышение уровня аспартатаминотрансферазы >75 ед/л, аланинаминотрансферазы >200 мкмоль/л или печеночная недостаточность; острые инфекционные и воспалительные заболевания; заболевания, при которых требуется постоянный прием нестероидных противовоспалительных препаратов, блокаторов циклооксигеназы-2, глюкокортикоидов; хронические болевые синдромы; тяжелая бронхиальная астма; хроническая почечная недостаточность.
Диагностические критерии ОКС: в группу с ОКС включали больных с типичным болевым приступом длительностью не менее 20 мин, наличием на ЭКГ подъема сегмента ST более 1 мм в 2 стандартных отведениях или более 2 мм в грудных отведениях, впервые выявленной блокады левой ножки пучка Гиса, появлением новых зон нарушения локальной сократимости по данным визуализирующих методик в сочетании с повышением уровня тропонина I или T.
В группу с ОКСбпST включали больных с ИМ без подъема сегмента ST и больных с нестабильной стенокардией. Диагноз ИМ без подъема ST устанавливали при сочетании повышения уровня тропонина с одним из следующих симптомов: типичный болевой приступ, отсутствие подъема сегмента ST на ЭКГ, появление новых зон нарушения локальной сократимости по данным визуализирующих методик (чаще эхокардиографии). Диагноз нестабильной стенокардии устанавливали при учащении болевых приступов, присоединении стенокардии покоя, впервые возникшей стенокардии в отсутствие повышения уровня тропонина в крови.
Контрольную группу составили лица в возрасте 37—80 лет без ИБС, которую исключали на основании результатов клинического осмотра, нагрузочного тестирования, в ряде случаев проводилась коронарография.
Группа больных с ОКС и контрольная группа оказались сопоставимы по основным параметрам (табл. 1). Средний возраст в группе больных с ОКС — 58 лет, в контроле — 56 лет. Около 70% в больных в обеих группах курят, страдали артериальной гипертонией и гиперхолестеринемией. У 15% больных с ОКС и у 10% в контроле выявлен сопутствующий сахарный диабет (СД) 2-го типа.
У всех больных при поступлении брали кровь для последующего определения MBL, фагоцитарных факторов (фагоцитарной активности нейтрофилов, фагоцитарного числа, фагоцитарного резерва), маркера воспаления СРБ и BNP. Сыворотка была заморожена и хранилась при температуре –70 °С.
Определение уровня MBL проводили с помощью стандартного коммерческого набора HBT Human MBL (lectin assay) ELISA. В основе метода лежит специфическая реакция антиген—антитело. Выявление образовавшегося комплекса проводят с использованием фермента в качестве метки для регистрации сигнала.
Показатели фагоцитарной активности нейтрофилов изучали с помощью лазерной проточной цитофлоуметрии на аппарате Beckmann-Сulter FC 500 с использованием тест-системы FagoFlowEx Kit. Методика заключается в выявлении рассеяния света лазерного луча при прохождении через него клетки в струе жидкости. В ходе анализа учитывается уровень флуоресценции химических соединений, входящих в состав клетки (аутофлуоресценция) или внесенных в образец перед проведением проточной цитометрии.

Статистический анализ. Описательную статистику проводили с помощью параметрических критериев (среднее, среднеквадратичное отклонение). Для оценки достоверности различий количественных показателей использовали параметрический критерий Стьюдента, а также непараметрический критерий U Манна—Уитни для межгруппового сравнения. Уровень достоверности был принят р<0,05. Корреляционный анализ выполняли по методу Спирмана (ранговая корреляция). Статистический анализ данных проводили с помощью программы для статистического анализа Statistica 6.0.
Результаты
У больных с ОКС уровень MBL оказался выше, чем в контроле (127,2 и 52,7 нг/мл соответственно; р=0,07).
У больных с ОКСбпST уровень MBL был достоверно выше, чем в контроле (164,7 и 52,7 нг/мл соответственно; р=0,03). Не выявлено достоверной различий по уровню MBL при сравнении больных с ОКСпST с контролем, а также у больных с ОКСпST и с ОКСбпST (табл. 2).
У больных с ИМ нижней локализации выявлена достоверно более высокая концентрация MBL (182,8 нг/мл) по сравнению с таковой у больных с ИМ передней локализации (92,7 нг/мл; р=0,03). У больных с нижним ИМ уровень MBL оказался достоверно выше, чем в контроле (182,7 и 52,7 нг/мл соответственно; р=0,02). Концентрация MBL у больных с передним ИМ значимо не отличалась от контрольной группы (табл. 3).
Для оценки обширности поражения миокарда мы использовали показатель фракции выброса (ФВ) левого желудочка (ЛЖ), разделив больных с ОКС на подгруппы с низкой ФВ ЛЖ (<40%) и умеренно сниженной ФВ ЛЖ (≥40%). Уровень MBL у больных с умеренно сниженной ФВ ЛЖ оказался достоверно выше, чем в контроле (148,9 и 52,7 нг/мл соответственно; р=0,04). Достоверных различий между концентрацией белка у больных с низкой и умеренно сниженной ФВ не выявлено. Уровень MBL у больных с обширным ИМ не отличался от показателя контрольной группы (табл. 4).
Больных с ОКС разделили по возрасту: старше и моложе 65 лет. При сравнении уровня MBL в этих подгруппах выявлено, что уровень MBL оказался выше у больных старше 65 лет (168 и 116 нг/мл соответственно). У больных старше 65 лет уровень MBL оказался в 3 раза выше, чем в контрольной группе (168 и 52,7 нг/мл соответственно; р=0,02). Уровень MBL у больных моложе 65 лет достоверно не отличался от показателей контрольной группы. У женщин уровень MBL оказался более высоким, чем у мужчин (144 и 124 нг/мл соответственно; p=0,12).
Уровень MBL у больных с сопутствующим СД 2-го типа оказался в 3 раза выше, чем у больных без СД (227 и 98 нг/мл соответственно; р=0,03). Концентрация MBL в крови у больных с ОКС без сопутствующей артериальной гипертонии оказался достоверно выше, чем в контроле (p=0,03; табл. 5).
Уровень фагоцитарных факторов значимо не различался у больных с ОКС и в контроле. При разделении больных с ОКС на подгруппы в зависимости от динамики ST мы не получили достоверных различий ни по одному фагоцитарному фактору (см. табл. 2.)
У пациентов старше 65 лет фагоцитарный резерв оказался достоверно выше, чем в контроле (94,3 и 85,5% соответственно). Фагоцитарная активность нейтрофилов практически не различалась в группе ОКС и контроле в зависимости от возраста.
У больных моложе 65 лет выявлено более низкое фагоцитарное число (3,24) по сравнению с контролем (4,37; р=0,05). Достоверных различий по уровню фагоцитарного резерва и фагоцитарной активности нейтрофилов не получено.
При разделении по полу уровень фагоцитарных факторов практически не отличался в группе с ОКС от показателей контрольной группы.
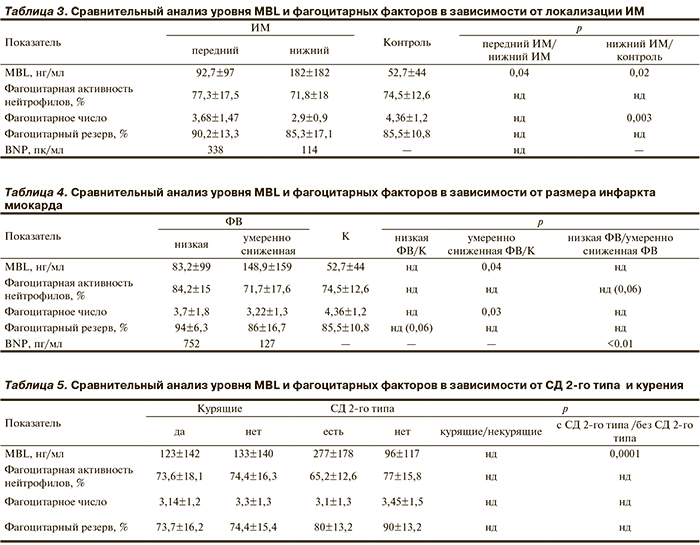
У больных с ИМ нижней локализации фагоцитарное число оказалось достоверно ниже, чем в контроле (2,9 и 4,36 соответственно; р=0,03). Достоверной разницы по фагоцитарной активности нейтрофилов, фагоцитарному резерву у больных с ИМ передней и нижней локализации не выявлено (см. табл. 3).
У больных с обширной зоной поражения миокарда (ФВ<40%) фагоцитарное число оказалось значительно ниже, чем в контрольной группе (3,22 и 4,36 соответственно; р=0,03). Различий между фагоцитарным числом у больных с ФВ<40% и у больных с ФВ≥40% не выявлено было. Получен более высокий уровень фагоцитарной активности нейтрофилов у больных с обширным ИМ по сравнению с таковым у больных с умеренно сниженной ФВ. Различия, однако, оказались недостоверными (84,2 и 71,2% соответственно; р=0,06). Уровень фагоцитарного резерва не отличался в зависимости от размера ИМ (см. табл. 4).
При сравнении уровня фагоцитарных факторов у курящих и некурящих больных, больных с сопутствующим СД 2-го типа, артериальной гипертонией, гиперхолестеринемией и без факторов риска достоверных различий между уровнем фагоцитарных факторов не выявлено (см. табл. 5).
Проведен корреляционный анализ между фагоцитарной активностью нейтрофилов, фагоцитарным числом и фагоцитарным резервом. Все факторы у больных с ОКС находятся в достоверной прямой зависимости между собой, корреляционные индексы >0,5.
Средний уровень СРБ у больных с ОКС составил 0,87 ед/л. Достоверных различий по уровню СРБ у больных с ОКС в зависимости от динамики сегмента ST на ЭКГ не выявлено.
В нашей работе мы не выявили корреляции между уровнем СРБ, BNP и MBL в группе больных с ОКС. При разделении больных в зависимости от размеров и локализации ИМ, динамики сегмента ST на ЭКГ корреляционный индекс составил <0,3. Корреляции между всеми фагоцитарными факторами и BNP, СРБ не выявлено.
Обсуждение
Нормальный уровень MBL у людей точно не определен. Он находится в широких пределах от 10 до 5000 нг/мл. Среди представителей европеоидной расы более 12% популяции имеют уровень MBL ниже 100 нг/мл. Уровень MBL ниже 100 нг/мл относят к одному из типов иммунодефицита. В популяционном исследовании Санкт-Петербурга 16% здоровых людей имели мутантный аллель MBL, обусловливающий низкую концентрацию белка в плазме [20], что согласуется с данным популяционных исследований, проведенных в Западной Европе [21].
В японской популяции носителей мутантного гена еще больше [22].
Уровень MBL у больных с ОКС согласно нашим данным выше, чем в контрольной группе. Различия достоверны для больных с ОКСбпST. Эти данные коррелируют с результатами исследования EPIC-Norfolk. В нем показано, что у мужчин, перенесших за период наблюдения ИМ или умерших от ИБС, исходная концентрация MBL была достоверно выше, чем у лиц, у которых не развились коронарные осложнения [20].
Сходные данные получены в ходе крупного проспективного исследования, в котором генотипировали 978 больных, перенесших операцию коронарного шунтирования. В нем показано, что гаплотип LYQA, который обусловливает высокую концентрацию MBL в крови, является независимым предиктором послеоперационного ИМ у больных, перенесших аортокоронарное шунтирование [22].
Обсуждается несколько механизмов возможного участия MBL в атерогенезе и тромбообразовании, способствующих возникновению ОКС. Во-первых, MBL запускает лектиновый путь активации комплемента. Есть данные, что активация комплемента повышает риск развития сердечно-сосудистых осложнений у больных с распространенным атеросклерозом. Отложение комплемента iC3b в нестабильных АСБ приводит к увеличению риска развития ОКС, по-видимому, за счет усиления воспалительной реакции и увеличения риска тромбообразования. Кроме того, оксидантный стресс, играющий ключевую роль в патогенезе ОКС, активирует комплемент через лектиновый путь в культуре клеток. В экспериментальных работах показано, что моноклональные антитела к MBL ингибируют MBL и уменьшают отложение субъединицы C3 комплемента после оксидантного стресса. Таким образом, активация лектинового пути может способствовать запуску процессов тромбооразования, приводя к увеличению риска развития ИМ [23].
Система комплемента является одним из триггеров воспалительной реакции. Его мембранно-атакующие комплексы обнаружены в клетках поврежденного вследствие ИМ кардиомиоцитов, у многих животных, а также у человека [24]. Ингибирование комплемента рассматривалось в качестве перспективной мишени при лечении ИМ.
В ряде небольших исследований ингибирование отдельных компонентов комплемента приводило к уменьшению размеров ИМ [25]. Однако 3 крупных рандомизированных исследования (COMMA, COMPLY, APEX-AMI) по влиянию ингибитора компонента С5 комплемента пекселизумаба не показали, что использование этого препарата улучшает течение и прогноз ИМ [26, 27]. В последнее время внимание исследователей переключилось на один из факторов активации комплемента — MBL.
Из результатов нашего исследования видно, что уровень MBL значительно выше у больных с сопутствующим СД 2-го типа, чем у больных без СД, а также у больных с ОКС с сопутствующим СД 2-го типа концентрация MBL выше, чем в контроле. В литературе имеются данные о ключевой роли MBL в развитии реперфузионного повреждения при ОКС с сопутствующим СД 2-го типа. Так, в экспериментальном исследовании L. La Bonte и соавт. [28] показали, что при терапии моноклональными антителами к MBL у мышей с экспериментальным ИМ на фоне СД 2-го типа размер ИМ, уровень комплемента С3 и аккумуляция нейтрофилов оказались значительно ниже, чем у мышей без этой терапии. Сходные получены в экспериментальном исследовании у М. Busche и соавт. [29].
Высокую концентрацию MBL можно рассматривать как фактор риска развития ОКС, особенно у больных с сопутствующим СД 2-го типа. В литературе встречаются противоположные данные об увеличении риска развития ИМ у больных с низким уровнем MBL. Так, среди американских индейцев — носителей вариантов генотипов MBL, обусловливающих низкий уровень MBL в крови, риск развития ИБС был значительно выше, чем у лиц с «диким» генотипом [30]. После операции коронарного шунтирования окклюзия венозных шунтов наблюдалась значительно чаще у больных с дефицитом MBL (p<0,01) [12]. В подгруппах Рейкъявикского исследования у больных с высоким уровнем MBL риск развития ИМ был значительно ниже (отношение шансов 0,66; р<0,01) [15]. Авторы предположили, что механизмом снижения риска развития ИМ явилось возможное участие MBL в связывании и утилизации окисленных липопротеидов низкой плотности, что приводит к снижению скорости атерогенеза.
В то же время у больных с развившимся ИМ высокий уровень MBL, согласно нашим данным, чаще наблюдается при нижней локализации ИМ и при ФВ ≥40%.
В литературе данные о связи высокого уровня MBL с уменьшением размера ИМ не найдены. Напротив, имеются данные, что повышенный уровень MBL связан с неблагоприятным прогнозом.
Наши данные свидетельствуют о том, что высокая концентрация MBL увеличивает риск развития коронарных осложнений, тогда как при развившемся ИМ высокая концентрация MBL является протективной.
Таким образом, MBL может играть существенную роль в патогенезе атеросклероза, коронарного тромбоза и реперфузионного повреждения миокарда, способствуя увеличению риска развития сердечно-сосудистых заболеваний у здоровых лиц, и снижению риска развития осложнений у больных с ОКС.
В нашей работе уровень фагоцитарной активности нейтрофилов, фагоцитарного числа и фагоцитарного резерва достоверно не различался у больных с ОКС, ОКСпST, ОКСбпST и в контроле. Корреляции между фагоцитарным числом и уровнем MBL не выявлено. Фагоцитарный резерв был выше у больных с обширным ИМ по сравнению с контролем. В общей группе больных с ОКС фагоцитарный резерв практически не отличался от такового в контрольной группе. Показатели фагоцитарных факторов коррелируют между собой у больных с ОКС.
Давно установлен факт нейтрофилии в первые несколько суток от развития ИМ. Имеются данные об активации хемотаксиса и агрегации нейтрофилов при ОКС [31]. Активация нейтрофилов происходит в результате взаимодействия с лигандами эндотелиальных клеток и с продуктами метаболизма клеток некротизированного и ишемизированного миокарда. Однако результаты исследования фагоцитарной активности нейтрофилов неоднозначные и малочисленные. Так, у больных с ОКС выявлена значительная активация нейтрофилов, но не фагоцитоза [32]. В другой работе у больных с ИМ уровень всех факторов фагоцитарной активности оказался выше, чем в контрольной группе. Показатели фагоцитарной активности коррелировали с уровнем креатинкиназы в первые сутки от развития заболевания [33]. В нескольких работах показано, что фагоцитарная активность нейтрофилов снижается при развитии ИМ. Таким образом, роль факторов фагоцитарной активности нейтрофилов в патогенезе ИМ остается неясной и нуждается в дальнейшем изучении.
Выводы
Повышение концентрации маннозосвязывающего лектина в сыворотке крови обусловливает повышение риска развития инфаркта миокарда, особенно у больных сахарным диабетом 2-го типа.
У больных с острым инфарктом миокарда высокий уровень маннозосвязывающего лектина связан с меньшим размером поражения и чаще наблюдается при нижней локализации инфаркта.
Фагоцитарные факторы не влияли на риск развития инфаркта миокарда.



