Острый коронарный синдром (ОКС) — потенциально угрожающее жизни состояние, обусловливающее необходимость максимально быстрой диагностики и активных лечебных действий. Современная доктрина ведения пациентов с ОКС имеет целью восстановление кровотока в инфаркт-связанной артерии, способствуя тем самым ограничению зоны некроза миокарда и снижая непосредственную и отдаленную летальность, а также вероятность развития тяжелой хронической сердечной недостаточности.
В современных отечественных и зарубежных рекомендациях четко прописаны основные алгоритмы, которых должны придерживаться как врачи первичного звена, так и кардиологи стационара. При типичной картине ОКС подобные руководства к действию обеспечивают быстрое и качественное лечение. Однако сопутствующие заболевания, часто имеющиеся у пациентов с развившимся ОКС, способны существенно изменить его клиническую картину. Так, хорошо известно, что больные сахарным диабетом нередко имеют бессимптомное/малосимптомное течение ОКС, что зачастую увеличивает время до постановки диагноза и ухудшает результаты лечения [1].
В ряде работ продемонстрирована способность хронической обструктивной болезни легких (ХОБЛ) ускорять развитие коронарного атеросклероза, а также способствовать дестабилизации ишемической болезни сердца (ИБС), т.е. возникновению ОКС [2—5]. Однако, несмотря на то что ХОБЛ является частой сопутствующей нозологией у больных ИБС, данных о влиянии ХОБЛ на клиническую картину ОКС немного.
Цель настоящего исследования — установить особенности клинического течения ОКС у больных ХОБЛ.
 Материал и методы
Материал и методы
В когортное исследование с параллельными группами были включены 272 больных, которым в 2012—2014 гг. было выполнено чрескожное коронарное вмешательство (ЧКВ) по поводу ОКС. Значительная часть материала была получена в Центре грудной хирургии Краснодара (Краевая клиническая больница №1 им. проф. С.В. Очаповского).
Критерии включения в основную группу: возраст ≥40 лет; курение на момент поступления либо прекращение курения не более чем за 1 год до момента госпитализации; анамнез курения ≥10 пачка-лет; наличие ОКС с окончательным диагнозом инфаркт миокарда (ИМ) или нестабильная стенокардия; проведение ЧКВ со стентированием (голометаллический стент либо стент с лекарственным покрытием) с полным восстановлением кровотока в инфаркт-связанной артерии в течение 24 ч от начала симптомов, приведших к госпитализации, без ангиографических признаков остаточного стеноза, диссекции или дистальной эмболизации; ХОБЛ, диагностированная в соответствии с критериями GOLD (2011) [6], согласно которым постбронходилатационное значение объема форсированного выдоха за 1-ю секунду (ОФВ1), отнесенное к величине форсированной жизненной емкости легких (ФЖЕЛ), должно быть менее 0,70, а степень тяжести заболевания определяется, исходя из значения ОФВ1.
Критерии исключения: пороки сердца при наличии показаний к их хирургической коррекции; аортокоронарное шунтирование (АКШ) либо ЧКВ в анамнезе; бронхиальная астма; активный туберкулез; интерстициальные заболевания легких; идиопатическая легочная артериальная гипертензия; легочная тромбоэмболическая болезнь; системные заболевания соединительной ткани; злокачественные новообразования; торакотомия с резекцией легкого в анамнезе; развитие осложнений при выполнении ЧКВ: диссекция, перфорация либо разрыв коронарной артерии (КА), феномен «no reflow»; фракция выброса левого желудочка (ФВ ЛЖ) менее 35% к концу 1-й недели после выполненной реваскуляризации, отказ пациента от участия в исследовании.
Контрольная группа сформирована, исходя из тех же критериев включения, что и основная, кроме наличия ХОБЛ, которая была исключена на основании данных спирографии. Критерии исключения были те же, что и для основной группы.
Поскольку число больных, удовлетворявших критериям включения в контрольную группу, значительно превышало число больных в основной группе, с целью уменьшения дисбаланса в численности групп включение пациентов в контрольную группу проводилось при помощи генератора случайных чисел из числа подходящих кандидатов.
 Основную группу составили 110 больных ОКС и ХОБЛ, контрольную — 162 больных ОКС без ХОБЛ.
Основную группу составили 110 больных ОКС и ХОБЛ, контрольную — 162 больных ОКС без ХОБЛ.
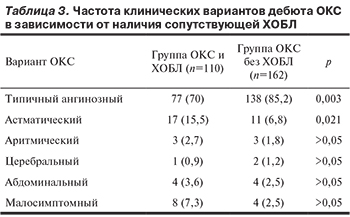
На основании доминирующих в клинической картине симптомов ОКС включенные в исследование больные были отнесены к одному из следующих вариантов, как это описывается в рекомендациях Российского кардиологического общества по ведению больных ОКС с подъемом сегмента ST на электрокардиограмме (ЭКГ) [7]: типичный классический ангинозный вариант, а также атипичные формы: астматический, абдоминальный, аритмический, цереброваскулярный и малосимптомный. Класс острой сердечной недостаточности (ОСН) оценивали по классификации Killip [8].
В течение 24 ч от момента поступления в стационар пациенту устанавливали клинический диагноз: Q-позитивный ИМ, Q-негативный ИМ либо нестабильная стенокардия. Для этого оценивали концентрацию тропонина I в крови и показатели ЭКГ. Диагноз острого ИМ и нестабильной стенокардии устанавливали согласно критериям Европейского общества кардиологов (2012) [9].
На основании комплексного анализа ЭКГ (интерпретация динамики изменений сегмента ST, зубцов R и Т), данных эхокардиографии (зоны гипо- и акинезии), а также данных коронарографии (КГ) определяли преимущественную локализацию ишемического процесса в миокарде ЛЖ.
 В течение не менее 48 ч от момента поступления в стационар все больные находились под мониторным электрокардиографическим наблюдением, что позволяло регистрировать нарушения ритма сердца (НРС). Учитывали наличие следующих аритмий: устойчивая пароксизмальная фибрилляция предсердий (ПФП), постоянная ФП, устойчивая желудочковая тахикардия (ЖТ), а также фибрилляция желудочков (ФЖ) — независимо от длительности.
В течение не менее 48 ч от момента поступления в стационар все больные находились под мониторным электрокардиографическим наблюдением, что позволяло регистрировать нарушения ритма сердца (НРС). Учитывали наличие следующих аритмий: устойчивая пароксизмальная фибрилляция предсердий (ПФП), постоянная ФП, устойчивая желудочковая тахикардия (ЖТ), а также фибрилляция желудочков (ФЖ) — независимо от длительности.
Учитывали также время от начала симптоматики (по данным анамнеза) до момента раздувания баллона в условиях рентгеноперационной (время симптом—баллон).
Статистический анализ полученных данных проводили с помощью программы Statistica 10.0 for Windows. При описании данных мерой центральной тенденции для непрерывных переменных при условии распределения, близкого к нормальному, служила средняя арифметическая (M), а при распределениях, значительно отличающихся от нормального, — медиана (Me). В качестве меры разброса использовали стандартное отклонение (SD), либо межквартильный размах (Q1; Q3); для описания долей использовали проценты.
Для оценки распределения переменных использовали критерий Шапиро—Уилка. С целью оценки различий между группами применяли непараметрический критерий Манна—Уитни, а при наличии более 2 групп — критерий Крускала—Уоллиса. Для сравнения долей использовали точный критерий Фишера и χ2-критерий. Корреляционные связи изучали с помощью метода Спирмена. За пороговый уровень статистической значимости принимали p<0,05.
 Результаты
Результаты
Характеристика больных по демографическим признакам и характеру сопутствующей патологии представлена в табл. 1.
В группе ОКС и ХОБЛ 47 (42,7%) пациентов имели ХОБЛ 1-й степени тяжести, 37 (33,6%) — 2-й степени, 20 (18,2%) — 3-й степени, 6 (5,5%) — 4-й.
Распределение больных по поражению крупной инфаркт-связанной артерии, по данным КГ, представлено в табл. 2. В группе больных ОКС и ХОБЛ реже, чем в контрольной группе, встречалось поражение передней нисходящей артерии (ПНА) и, наоборот, отмечалось более частое поражение правой коронарной (ПКА) и огибающей артерий (ОА).
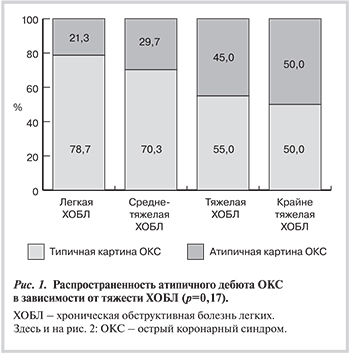
Основная и контрольная группы существенно не различались по наличию сопутствующей патологии. В табл. 3 отражено распределение больных в зависимости от особенностей клинических вариантов дебюта ОКС, а в табл. 4 — по степени тяжести ОСН в соответствии с классификацией Killip. Суммарная распространенность атипичных форм дебюта ОКС среди пациентов с сопутствующей ХОБЛ более чем в 2 раза превышала таковую в группе без ХОБЛ, причем атипичное начало ОКС чаще встречалось при тяжелой ХОБЛ (рис. 1).
Среди больных ХОБЛ зарегистрирован более высокий класс тяжести ОСН по классификации Killip: при суммарной оценке распределения степеней тяжести ОСН в основной и контрольной группах (см. табл. 4) отмечалось явное смещение в сторону большей тяжести ОСН у больных ХОБЛ (p=0,025).
Основной вклад в различие между группами по тяжести ОСН внесло увеличение относительной частоты II класса ОСН в группе ХОБЛ, за счет этого I класс ОСН среди больных ХОБЛ встречался существенно реже. Относительная частота III и IV классов ОСН была невелика в обеих группах и различия не достигли уровня статистической значимости. Второй класс ОСН по классификации Killip характеризуется наличием влажных хрипов над базальными отделами легких, что служит проявлением умеренной левожелудочковой недостаточности и может быть предвестником отека легких. Степень тяжести ХОБЛ и класс ОСН оказались связаны между собой прямой корреляцией (r=0,28; p<0,01).
Время от начала симптоматики до раздувания баллона в условиях рентгеноперационной различалось у больных с разными вариантами клинического течения ОКС (рис. 2). В целом наличие у больного атипичного варианта дебюта ОКС было связано с увеличением задержки до проведения ЧКВ: 14 (8; 19) ч против 8 (4; 12 ч; p<0,001). Поскольку у больных ХОБЛ атипичные варианты ОКС встречались чаще, это приводило к задержке с выполнением ЧКВ: время симптом—баллон в группе ХОБЛ составляло 10 (7; 15) ч, а в контрольной группе — 8 (4; 13 ч; p=0,04).

У больных ХОБЛ выявлена прямая корреляция между степенью тяжести ХОБЛ и интервалом времени симптом—баллон (r=0,24; p<0,05).
Частота НРС в группах наблюдения отражена в табл. 5. ПФП регистрировалась чаще более чем в 2 раза у больных ХОБЛ, чем в контрольной группе (относительный риск — ОР 2,06 при 95% доверительном интервале — ДИ от 1,14 до 3,74). Частота желудочковых аритмий была сопоставимой в обеих группах.
Частота ПФП зависела от степени тяжести ХОБЛ: если при легкой ХОБЛ ПФП встречалась лишь в 10,6% случаев, то при средней тяжести и тяжелой ХОБЛ — в 27% (p=0,05).
Обсуждение
Атипичное течение ОКС способно, по меньшей мере, затруднить диагностику и увеличить время до момента постановки правильного диагноза, в худшем случае — нарушить логистическую цепочку стандарта оказания специализированной медицинской помощи больным ОКС, конечным звеном которой является ЧКВ. Обнаруженная нами более высокая частота атипичных форм дебюта ОКС у пациентов с сопутствующей ХОБЛ способна привести к неблагоприятным последствиям в плане своевременности оказания специализированной медицинской помощи больным данной категории. Ошибочная трактовка симптомов больными ХОБЛ способна привести их к пульмонологу или терапевту, а в отсутствие типичных ангинозных болей высока вероятность того, что будет проигнорирована необходимость как можно более ранней регистрации ЭКГ. Выглядит обоснованным предположение, что истинная распространенность астматической «маски» ОКС у больных ХОБЛ выше, чем приведенные нами 15,5%. Ряд пациентов могут так и не получить своевременного лечения по поводу ОКС в первые часы заболевания ввиду задержки, связанной с неправильной трактовкой респираторных симптомов и возможной госпитализацией в непрофильное отделение. Именно такие больные имели невысокую вероятность войти в наше исследование благодаря тому, что мы включали лишь пациентов, для которых время от начала симптомов до первого раздувания баллона в ангиографической лаборатории не превышало 24 ч.
 Кроме того, в исследование не вошли больные, умершие в стационаре, а также те, у кого ФВ ЛЖ оказалась слишком низкой, что также могло иметь связь с задержкой проведения ЧКВ или тромболитической терапии. Таким образом, большинство нашей выборки составили больные ОКС с относительно хорошим прогнозом. Использовавшиеся критерии включения и исключения были продиктованы необходимостью сформировать такую выборку для изучения отдаленного прогноза сердечно-сосудистого заболевания у больных ХОБЛ, в которой роль иных, хорошо известных факторов неблагоприятного прогноза была бы сведена к минимуму, а сами больные были бы достаточно однородными в отношении сердечно-сосудистой патологии и ее тяжести.
Кроме того, в исследование не вошли больные, умершие в стационаре, а также те, у кого ФВ ЛЖ оказалась слишком низкой, что также могло иметь связь с задержкой проведения ЧКВ или тромболитической терапии. Таким образом, большинство нашей выборки составили больные ОКС с относительно хорошим прогнозом. Использовавшиеся критерии включения и исключения были продиктованы необходимостью сформировать такую выборку для изучения отдаленного прогноза сердечно-сосудистого заболевания у больных ХОБЛ, в которой роль иных, хорошо известных факторов неблагоприятного прогноза была бы сведена к минимуму, а сами больные были бы достаточно однородными в отношении сердечно-сосудистой патологии и ее тяжести.
Доказательством влияния особенностей клинической картины на своевременность оказания специализированной помощи может служить обнаруженная разница значений времени симптом—баллон в зависимости от клинических особенностей дебюта ОКС, причем наибольшая задержка во времени отмечалась при малосимптомном варианте начала ОКС. Названный интервал времени в клинической практике зависит от ряда факторов. Во-первых, от наличия у самого пациента настороженности в отношении возможного развития острого состояния, требующего экстренного обращения за медицинской помощью. Во-вторых, от времени до прибытия бригады скорой медицинской помощи (СМП) и первой записи ЭКГ у пациента с подозрением на ОКС, если клиническая картина позволит такому подозрению возникнуть. В-третьих, от удаленности места проживания пациента до центра проведения ЧКВ. Время задержки пациента в приемном отделении, особенно в случаях ОКС с подъемом сегмента ST, было минимальным, а большинство пациентов, минуя приемное отделение, напрямую транспортировались в рентгеноперационную.
Среди больных, включенных в наше исследование, многие проживали в региональном центре (наиболее вероятно, именно поэтому они и удовлетворяли критерию включения, связанному с интервалом времени симптом—баллон, находящемуся в пределах 24 ч), что значительно сокращало время доставки их в стационар. Поскольку организация службы СМП в Краснодарском крае находится на высоком уровне, время до приезда бригады обычно минимально, развитая транспортная система позволяет быстро доставить пациента в специализированный центр ЧКВ (за исключением отдаленных районов края), поэтому основной вклад в суммарный показатель симптом—баллон вносит именно интервал времени от появления первых симптомов до вызова бригады СМП.
Астматический вариант начала ОКС в 2,3 раза чаще встречался у больных ХОБЛ, поэтому мы полагаем, что наличие сопутствующей ХОБЛ способно существенно изменить клиническую картину ОКС, увеличивая вероятность развития атипичной астматической формы и тем самым увеличивая время до проведения ЧКВ. Объяснением такой особенности, как мы полагаем, могут служить два обстоятельства. При классическом ангинозном варианте клинической картины ОКС основная жалоба больных обычно связана с интенсивной давящей либо жгучей загрудинной болью. Часто болевой синдром сочетается с одышкой, однако ввиду превалирования в субъективной картине болезни именно боли респираторные нарушения среди жалоб больного отходят на второй план. При наличии ХОБЛ (особенно тяжелой и длительно протекающей), как это было установлено в ряде работ, изменяется порог восприятия ангинозной боли [10]. В результате увеличивается доля больных, у которых в клинической картине ОКС начинает превалировать именно одышка. Кроме того, отек слизистой оболочки бронхов при развитии острой левожелудочковой недостаточности усугубляет имеющуюся у пациентов бронхообструкцию, что также способствует выходу одышки на первый план в клинической картине ОКС. Это подтверждается и более высоким классом тяжести ОСН у больных ХОБЛ.
Отсутствие характерных болевых ощущений в грудной клетке, с которыми у большинства населения ассоциируется острое сердечно-сосудистое заболевание, увеличивает время, необходимое больному для принятия решения об обращении за медицинской помощью, особенно в тех случаях, когда у пациента ранее случались обострения ХОБЛ, сопровождающиеся усугублением респираторной симптоматики.
Увеличение времени от момента начала симптомов до обращения за медицинской помощью способно влиять на объем жизнеспособного миокарда, сохраняющегося после выполнения реваскуляризации миокарда и тем самым предопределять в дальнейшем развитие систолической хронической сердечной недостаточности.
В нашей выборке больных ХОБЛ заметно реже, чем в контрольной группе, встречалось поражение ПНА и, наоборот, отмечалось более частое поражение ПКА и ОА (см. табл. 2). Это вряд ли может быть объяснено истинным увеличением частоты поражения ПКА и ОА при ХОБЛ. Поскольку поражение ПНА имеет тенденцию протекать тяжелее, чем поражение иных КА за счет большей массы вовлеченного миокарда, то сочетание тромбоза ПНА и ХОБЛ, особенно тяжелой, может оказаться особенно неблагоприятным и чаще приводить к летальному исходу, чем в отсутствие данных признаков. В нашу выборку не вошли больные, умершие от ОКС на догоспитальном этапе, а также умершие в клинике, что могло повлиять на показатели частоты поражения той или иной КА. Кроме того, повлиять могло исключение больных со слишком низкой ФВ ЛЖ, а также подвергшихся АКШ либо леченых консервативно.
Повышенная распространенность ФП (как постоянной, так и пароксизмальной) среди больных ХОБЛ известна давно, однако эти данные относятся к пациентам, находящимся в стабильном состоянии. В то же время острый ИМ в сочетании с ХОБЛ могут создавать особые предпосылки для развития ФП и других аритмий у пациентов из группы ХОБЛ. Среди таких предпосылок наиболее вероятными представляются гипоксемия и персистирующее системное воспаление, проаритмические эффекты которых усугубляются снижением сократимости миокарда, его электрической нестабильностью и системной воспалительной реакцией в ответ на некроз кардиомиоцитов. ПФП в группе больных ХОБЛ встречалась более чем в 2 раза чаще, чем в контрольной (ОР 2,06 при 95% ДИ от 1,14 до 3,74). ОКС сам сопровождается значительным увеличением частоты пароксизмов ФП, и в связи с этим можно было бы ожидать выравнивания частоты возникновения этой аритмии между группами по сравнению с большей частотой ФП у больных ХОБЛ в стабильном состоянии. Однако ишемическое повреждение и некроз миокарда, по-видимому, создают предпосылки для возникновения пароксизмов ФП у больных ХОБЛ не только по тем механизмам, которые свойственны ишемическому поражению миокарда вообще. Можно полагать, что они «активируют» те патофизиологические звенья патогенеза ФП у больных ХОБЛ, которые существовали у них до развития острого ИМ. Факторами, способствующими развитию ФП у больных ХОБЛ, считаются дисфункция автономной нервной системы сердца, дисфункция левого и правого желудочков, повышение уровня катехоламинов в крови при развитии гипоксемии, гипокалиемия, гипомагниемия, респираторный ацидоз. Все они потенцируются развившимся ишемическим поражением миокарда, т.е. имеется своего рода синергизм, а не их «поглощение» более тяжелой патологией, что и приводило бы к определенному выравниванию различий по частоте развития ФП между группами. Большинству пациентов с ХОБЛ, включенных в наше исследование, этот диагноз впервые был установлен во время их пребывания в стационаре, и лишь немногие из тех, кто имел ранее диагностированную ХОБЛ, получали соответствующую терапию, поэтому применительно к исследуемой выборке больных гипотетический проаритмогенный вклад применяющихся для лечения ХОБЛ β-агонистов и М-холиноблокаторов представляется минимальным.
Частота устойчивой ЖТ и ФЖ не зависела от наличия ХОБЛ, вероятно потому, что предпосылки для их возникновения и при ХОБЛ, и в ее отсутствие складываются именно при ОКС. Установлено, что ЖТ при ОКС может возникать как по механизму re-entry, связанному с замедлением проводимости, укорочением потенциала действия и рефрактерности кардиомиоцитов, вызванными острой ишемией, так и по механизмам, связанными с патологическим автоматизмом и ранними постдеполяризациями [11]. Дисперсия рефрактерности и реполяризации способствует формированию множественных петель micro re-entry, лежащих в основе развития ФЖ. При сравнении полученных нами данных о распространенности желудочковых НРС с результатами других авторов [12, 13] обращает на себя внимание значительно меньшая частота развития как эпизодов устойчивой ЖТ, так и ФЖ, что мы связываем со 100% реперфузией в бассейне инфаркт-связанной артерии. Безусловно, это уменьшает выраженность ишемии/повреждения миокарда и степень его электрической нестабильности.
Таким образом, представленные нами данные дают основания рассматривать ХОБЛ не просто как сопутствующее заболевание, а как фактор, изменяющий и отягощающий течение ОКС ввиду способности ХОБЛ существенно изменять типичную клиническую картину ОКС, утяжелять степень ОСН, увеличивать риск возникновения ПФП, а также затруднять постановку диагноза и способствовать задержке проведения ЧКВ.
Выводы
У больных хронической обструктивной болезнью легких в 2 раза чаще, чем в контрольной группе встречаются атипичные варианты дебюта острого коронарного синдрома (преимущественно астматический и малосимптомный), что приводит к задержке выполнения чрескожного коронарного вмешательства.
Хроническая обструктивная болезнь легких сопровождается развитием более тяжелой острой сердечной недостаточности по классификации Killip. Степень тяжести хронической обструктивной болезни легких имеет прямую корреляционную связь с классом острой сердечной недостаточности по Killip.
У больных острым коронарным синдромом и хронической обструктивной болезнью легких реже, чем в контрольной группе, симптом-связанным было поражение передней нисходящей артерии, и, наоборот, чаще симптом-связанным оказывалось поражение правой коронарной и огибающей артерий.
У больных хронической обструктивной болезнью легких риск развития пароксизмальной фибрилляции предсердий во время острого коронарного синдрома увеличен в 2,1 раза, в основном за счет вклада средней и тяжелой хронической обструктивной болезни легких. Риск возникновения фибрилляции желудочков и устойчивой желудочковой тахикардии при остром коронарном синдроме не зависит от наличия обструктивной болезни легких.



