Коронарография (КГ) — всемирно признанный «золотой стандарт» в диагностике ишемической болезни сердца. Однако данный метод диагностики имеет ряд ограничений и порой не способен ответить на вопросы, интересующие практикующего врача. В частности, КГ не позволяет оценить функциональную значимость стеноза коронарной артерии (КА), что является крайне важным при выборе тактики лечения, особенно пациентов с многососудистым поражением и пограничными стенозами КА.
Для оценки функционального поражения коронарного русла предложены различные индексы. В настоящее время наиболее распространенной является оценка фракционного резерва кровотока (ФРК).
Коронарный резерв кровотока (КРК)
В 1974 г. K.L. Gould сделал революционное открытие в физиологии коронарного русла, показав, что кровоснабжение миокарда остается нормальным до тех пор, пока эпикардиальные артерии стенозированы не более чем на 85%. При гиперемии миокард начинает страдать уже при стенозе сосудов эпикарда >50%. КРК определялся как отношение скорости кровотока при гиперемии к скорости кровотока в покое в изучаемой артерии, снижаясь по мере усугубления поражения артерии [1]. Наиболее достоверным значением, указывающим на функциональную значимость стеноза, был индекс КРК <2,0 [2]. В ряде исследований было предложено считать значение КРК больше 4 нормальным; это означает, что сопротивление микроциркуляторного русла может снижать кровоток в 4 раза [3].
Вне зависимости от метода, который используется для определения КРК, данный индекс имеет ряд ограничений: 1) скорость кровотока в покое может сильно варьировать; 2) скорость кровотока при гиперемии зависит от системного артериального давления; 3) измерение скорости кровотока в покое и при гиперемии проводится не одновременно, а по очередности; 4) КРК не является специфичным для поражения артерий эпикарда, так как значение КРК зависит от кровотока и в эпикарде, и в микроциркуляторном русле. При низких значениях КРК невозможно определить, связано ли это только с сужением артерий эпикарда, только с дисфункцией микрососудистого русла или же с сочетанием обоих поражений.
Данные ограничения метода обусловливают его малую распространенность в повседневной клинической практике.
Индекс микрососудистого сопротивления (ИМС)
Сопротивление сосудистого русла определяется как отношение градиента давления к скорости кровотока через изучаемый участок кровеносного русла. ИМС специфичен для микроциркуляторного русла и его относительно легко определять с помощью проводника с датчиком давления PressureWire (St. Jude Medical, Minneapolis, MN, США). Данный индекс хорошо изучен в экспериментах на животных [4], в настоящее время стал использоваться в исследованиях при остром коронарном синдроме для определения возможных клинических исходов [5] и оценки эффективности терапии [6]. Нормальным значением ИМС считается 30 [7].
Теоретические аспекты применения ФРК
ФРК — инвазивный показатель, который может быть легко измерен во время проведения диагностической КГ с помощью коронарного проводника с датчиком давления на контрастном кончике. Этот показатель позволяет точно установить, какие поражения КА вызывают ишемию в кровоснабжаемой ею области [8]. ФРК определяется как отношение среднего дистального коронарного давления (Pd), измеряемого коронарным проводником с датчиком давления, к среднему проксимальному или аортальному давлению (Pa), измеряемого с кончика направляющего катетера, на фоне максимальной дилатации и гиперемии [9].
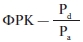
Иными словами, ФРК дает представление о степени снижения максимального кровотока в миокарде, обусловленного стенотическим поражением эпикардиальной артерии. ФРК ≤0,75 (рис. 1, см. цветную вклейку) свидетельствует о функционально значимом стенозе и необходимости реваскуляризации, что очень полезно при лечении пациентов с «пограничными» стенозами (40—70%) [10, 11]. На значения ФРК не влияют изменение системного давления, частота сердечных сокращений и сократимость миокарда [12]. К преимуществам данного метода также можно отнести его легкую воспроизводимость и точность.
Отличительные особенности ФРК
ФРК является уникальным методом, незаменимым в клинической практике в силу некоторых своих особенностей. В частности, у данного индекса есть совершенно определенное нормальное значение, равное 1. Ведь в нормальной эпикардиальной артерии нет перепада давления, как в покое, так и при достижении максимальной гиперемии; таким образом, отношение Pd/Pa либо равно 1, либо имеет очень близкое значение. Кроме того, есть общепринятые значения, точно характеризующие функциональную значимость поражения КА. Стенозы с ФРК <0,75 без сомнения вызывают ишемию миокарда (специфичность 100%, чувствительность 88%) [10]. Стенозы с ФРК ≥0,80 (рис. 2, см. цветную вклейку) практически никогда не ассоциируются с ишемией даже при физической нагрузке [13]. Таким образом, «серая зона» для ФРК (0,76—0,79) охватывает около 6—7% всех значений индекса. Как было отмечено выше, на значения ФРК не влияют показатели системной гемодинамики. Установлено также, что на ФРК не влияют пол пациента и такие факторы риска, как наличие артериальной гипертензии и сахарного диабета [12].
ФРК учитывает наличие коллатерального кровотока. Для миокарда не столь важно, в каком направлении осуществляется кровоток — анте- или ретроградно. Давление в КА в дистальном сегменте при максимальной гиперемии отражает, как правило, и антеградный, и ретроградный кровоток. Это справедливо как для стенозированных сосудов, получающих коллатерали от непораженных артерий, так и для сосудов с имеющимся стенозом, отдающих коллатерали к другим артериям, еще более пораженным атеросклерозом.
Методика измерения и достижения максимальной гиперемии
В устье КА устанавливают диагностический или направляющий катетер без боковых отверстий (последний предпочтительнее). Рекомендуется использовать катетер размером 6F или 7F. Однако результаты исследований показывают, что применение катетеров 4—5F также возможно для проведения измерения [14]. Как только катетер достигает КА, можно руководствоваться правилами введения антикоагулянтов во время стандартной ангиопластики. Гепарин вводят по стандартной схеме под контролем активированного времени свертывания. Следует поддерживать значение активированного времени свертывания в пределах 250 с. Для измерения ФРК абсолютно необходимо достичь максимальной дилатации как эпикардиальных артерий, так и сосудов микроциркуляторного русла. С этой целью интракоронарно вводят 250 мкг нитроглицерина. После введения нитроглицерина и гепарина датчик давления промывают, автоматически обнуляют и лишь после этого вводят в организм пациента. Датчик необходимо расположить непосредственно у выхода из направляющего катетера. Необходимо убедиться в том, что давление в аорте и на кончике датчика равно, т.е. Pd/Pa=1; для этого проводят нормализацию давлений. Далее необходимо провести датчик давления не менее чем на 2 см дистальнее стеноза. Максимальная гиперемия достигается путем введения вазодилататоров интракоронарно болюсно или внутривенно с помощью длительной инфузии. После этого может быть осуществлено измерение ФРК. После измерения необходимо снова расположить датчик давления на уровне кончика направляющего катетера, при этом отношение Pd/Pa должно быть равным 1, что свидетельствует о достоверности результатов измерения.
Системы для измерения ФРК и проводники, оснащенные датчиком давления
В настоящее время на рынке представлены 4 основные системы с соответствующими проводниками с датчиком давления:
— SmartMap (Volcano Corporation, Rancho Cordova, California)
— ComboMap (Volcano Corporation, Rancho Cordova, California)
— S5/S5i (Volcano Corporation, Rancho Cordova, California)
— RadiAnalyzer (St Jude Medical, Minneapolis, MN, США).
Проводники SmartWire, BrightWire и PrimeWire совместимы с первыми двумя системами, BrightWire и PrimeWire также используется с системой S5/S5i. RadiAnalyzer доступен с проводником PressureWire.
Во всех системах в основе лежит 0,014-дюймовый коронарный проводник, где датчик давления находится на 3 см проксимальнее кончика.
Препараты для достижения максимальной гиперемии
Для проведения достоверного измерения ФРК крайне важно добиться максимальной вазодилатации, иначе градиент давления в месте стеноза может быть недооценен, что может привести к неадекватной оценке тяжести стеноза. В клинической практике максимальная гиперемия КА может быть достигнута либо при введении интракоронарного болюса препарата, либо при длительной внутривенной инфузии. Наиболее часто применяемыми в мировой практике препаратами для достижения гиперемии являются аденозин [14], аденозин-5'-трифосфат (АТФ) [15—17], папаверин [18], дипиридамол [19] и добутамин [20] (см. таблицу). В исследовании, проведенном W. Parham и соавт. [21], показано, что нитропруссид натрия также может быть использован в качестве эффективного и безопасного препарата для достижения гиперемии при проведении измерения ФРК. По сравнению с вводимым внутрикоронарно аденозином нитропруссид натрия оказывает столь же эффективное, но более продолжительное действие.
Таблица. Сравнительная характеристика 5 вазодилататоров, применяющихся при измерении ФРК
Примечание. ФРК — фракционный резерв кровотока; АТФ — аденозин-5'-трифосфат; ПКА — правая коронарная артерия; ЛКА — левая коронарная артерия; ЭКГ — электрокардиограмма; АВ- — атриовентрикулярная.
С практической точки зрения идеальный препарат для достижения гиперемии должен соответствовать следующим критериям: низкая цена, быстрое развитие гиперемии, короткая продолжительность действия, простота в применении и малое количество побочных эффектов.
Таким образом, учитывая соотношение цены и качества, высокие показатели безопасности, простоту введения, интракоронарные введения папаверина, АТФ или аденозина следует признать наиболее распространенными в мировой практике для измерения ФРК.
Интракоронарное введение папаверина
Интракоронарное введение папаверина вызывает максимальную вазодилатацию и характеризуется короткой продолжительностью действия [18]. Максимальный эффект достигается через 10—30 с после введения, плато эффекта продолжается 45—60 с [24]. Рекомендованные дозы для интракоронарного введения папаверина 12—16 мг для правой коронарной артерии (ПКА) и 16—20 мг для левой коронарной артерии (ЛКА) [25]. Исторически сложилось, что папаверин был препаратом выбора для измерения коронарного резерва кровотока, но со временем аденозин стал более широко применяться в связи с меньшим количеством осложнений. При интракоронарном введении папаверин может вызывать удлинение интервала Q—T на ЭКГ и может, в свою очередь, приводить к развитию полиморфной желудочковой тахикардии и фибрилляции желудочков [26—29].
Подготовка пациента, включающая коррекцию гипокалиемии и отмену препаратов, вызывающих удлинение интервала Q—T (противоаритмические препараты классов I и III), уменьшает вероятность возникновения побочных эффектов и осложнений. В исследованиях N. Pijls и B. De Bruyne [30] сообщалось о более чем 1000 случаях удлинения интервала Q—T, при этом фибрилляция желудочков встречалась не чаще, чем после введения обычного контрастного вещества. Интракоронарное введение папаверина противопоказано при использовании некоторых ионных контрастных веществ (например, гексабрикс), так как оно может вызывать кристаллизацию этих веществ [31]. W. Van der Voort и соавт. провели сравнительное исследование интракоронарного введения папаверина и внутривенного введения аденозина (140 мкг/кг/мин) и показали, что оба препарата вызывают максимальную гиперемию, при этом применение их в клинической практике является безопасным [24]. B. De Bruyne и соавт. сравнили интракоронарный и внутривенный путь введения АТФ, аденозина, папаверина и контрастного вещества для измерения ФРК и доказали, что только интракоронарное введение папаверина и внутривенное введение аденозина (140 мкг/кг/мин) индуцируют максимальную стойкую гиперемию, достаточную для записи кривой-протяжки (pull-back curve) [31]. К сожалению, из-за относительно продолжительного периода полураспада папаверина, между введениями необходимо делать 5-минутный перерыв, а вводить папаверин следует не более 3 раз за процедуру для минимизации риска возможных побочных действий и осложнений.
Интракоронарное введение аденозина
Пик действия при интракоронарном введении аденозина отмечается менее чем через 10 с после введения, продолжительность действия составляет не более 20 с. В соответствии со стандартным протоколом введения аденозина интракоронарно рекомендованными дозами ранее являлись 15—20 мкг для ПКА и 20—40 мкг для ЛКА. Однако позднее выявлено, что принятые ранее дозы аденозина являются не достаточными для достижения максимальной гиперемии, т.е. у некоторых пациентов необходимо применение более высоких доз, вызывающих гиперемию. В частности, В. Murtagh и соавт. [22] показали, что однократное болюсное введение 40 мкг аденозина для ПКА и 60 мкг для ЛКА является достаточным для достижения максимальной гиперемии в бассейне как ПКА, так и ЛКА. Однако для пациентов, у которых ФРК находится в диапазоне 0,75—0,80, необходимо введение более высоких доз для обеспечения максимальной гиперемии, в противном случае тяжесть стеноза может быть недооценена. Более того, в исследовании, опубликованном G. Casella и соавт. [23], продемонстрировано, что высокие дозы аденозина (до 150 мкг) необходимы для достижения максимальной гиперемии у некоторых больных, а их введение по сравнению со стандартной дозировкой безопасно и ассоциировано с незначительным количеством побочных эффектов. К недостаткам данного вида введения можно отнести короткую продолжительность действия и, соответственно, невозможность выполнить запись кривой-протяжки. К наиболее часто встречающимся побочным эффектам относится преходящая атриовентрикулярная (АВ-) блокада при введении аденозина в ПКА.
Внутривенное введение аденозина
При введении через центральную вену (бедренную или крупную локтевую) обычно используется доза 140 мкг/кг/мин [31]. Пик гиперемии достигается через 1 мин, действие препарата проходит примерно через 1 мин после прекращения инфузии. В случае попадания в «серую зону» (ФРК 0,75—0,80) доза может быть безопасно увеличена до 180 мкг/кг/мин [30]. При внутривенном введении аденозина АВ-блокада встречается редко. Наиболее распространенным осложнением является бронхоспазм. Главным противопоказанием к применению аденозина служат тяжелые обструктивные заболевания легких, такие как бронхиальная астма и хроническая обструктивная болезнь легких. Кроме того, возможны преходящие ощущения, схожие с приступом стенокардии, сопровождающиеся одышкой [30]. Эти ощущения быстро купируются после прекращения инфузии. Введение аденозина снижает артериальное давление на 10—20%, в той же степени учащается пульс.
Аденозин-5′-трифосфат
AТФ в плазме крови быстро распадается на аденозиндифосфат, аденозинмонофосфат и аденозин. B. De Bruyne и соавт., сравнивая гиперемическое действие папаверина, аденозина и АТФ, пришли к выводу, что АТФ так же эффективен, как и аденозин, и рекомендовали его использование в тех же дозах [31]. Авторы также предлагают сделать методом выбора внутривенную инфузию аденозина со скоростью 140 мкг/кг/мин, поскольку такой метод введения обеспечивает более надежное достижение гиперемии у большинства пациентов по сравнению с аденозином, вводимым интракоронарно.
Измерение ФРК при реваскуляризации у пациентов с многососудистым поражением коронарного русла
В известном исследовании FAME оценивались исходы и прогноз у пациентов с многососудистым поражением при проведении чрескожного коронарного вмешательства (ЧКВ) с измерением ФРК. В исследование были включены 1005 больных с множественным поражением КА в 20 центрах Европы и США. Пациенты были рандомизированы на 2 группы: в 1-й группе решение о реваскуляризации и ее объеме принималось на основании ангиографической картины; во 2-й группе реваскуляризация проводилась только при ФРК ≤0,80. Через 2 года число смертей или случаев инфаркта миокарда (ИМ) составило 12,7% в группе ангиографии и 8,4% в группе ЧКВ после измерения ФРК (p=0,03). Число повторных ЧКВ или операций коронарного шунтирования (КШ) составило 12,3 и 10,4% соответственно (p=0,35). Комбинированная точка (смерть, нефатальный ИМ и повторные реваскуляризации) достигала 22,2 и 17,7% в 1-й и 2-й группах соответственно (p=0,07). Таким образом, измерение ФРК в обычном порядке у пациентов с многососудистым поражением перед проведением ЧКВ с установкой стентов с лекарственным покрытием значительно снижает смертность и вероятность развития ИМ в течение 2 лет [32]. Кроме того, в ходе данного исследования было доказано, что оценка ФРК у больных данной категории является одной из редких ситуаций, когда новая технология не только улучшает исход, но и снижает экономические затраты [33].
Заключение
Стандартная коронарная ангиография без дополнительных методов визуализации и физиологических исследований не всегда является надежным средством диагностики и выбора дальнейшей тактики лечения. Поэтому современный интервенционный кардиолог должен использовать в повседневной практике такие методы диагностики, как измерение фракционного резерва кровотока и внутрисосудистое ультразвуковое исследование, особенно у пациентов с «пограничными» стенозами и многососудистым поражением коронарного русла.



