Трепетание предсердий (ТП) занимает второе место среди тахиаритмий по распространенности после фибрилляции предсердий (ФП) с частотой встречаемости до 10—15% всех наджелудочковых нарушений ритма [1—3]. Согласно существующим современным рекомендациям по ведению больных с ФП и ТП, при проведении кардиоверсии с целью профилактики тромбоэмболических осложнений (ТЭО) показана антикоагулянтная терапия (АКТ) [4]. В то же время необходимость назначения АКТ до кардиоверсии и после нее у пациентов с изолированным ТП не доказана в многоцентровых рандомизированных исследованиях. Риск возникновения ТЭО у таких больных изучен недостаточно. В большинстве клинических исследований, посвященных АКТ, уделяли внимание ее роли в профилактике ТЭО у пациентов с ФП. Кроме того, отсутствуют данные о влиянии способа восстановления синусового ритма на развитие ТЭО у больных с ТП.
Проведенные за последние 15 лет эпидемиологические и нерандомизированные исследования позволяют сделать вывод, что ТП связано с умеренным риском развития ТЭО, который выше такового в сравнительной популяции пациентов с синусовым ритмом и меньше, чем у больных с ФП.
Выявлять лиц с высоким риском развития ТЭО помогает чреспищеводная эхокардиография (ЧП-ЭхоКГ) [5]. Маркерами повышенного риска тромбообразования являются феномен спонтанного эхоконтрастирования (ФСК) или тромб в полости и ушке левого предсердия (УЛП). Выявлена также зависимость между ФСК и продолжительностью аритмии. Снижение скорости изгнания крови из УЛП напрямую коррелирует с повышением риска развития ТЭО [6, 7]. В то же время исследований по оценке эффективности кардиоверсии в зависимости от гемодинамических характеристик УЛП у лиц с ТП нами не найдено.
Цель работы — оценить эффективность электростимуляционной кардиоверсии при ТП I типа неклапанной этиологии в зависимости от данных ЧП-ЭхоКГ.
Материал и методы
С целью восстановления синусового ритма при ТП I типа неклапанной этиологии проведено 89 кардиоверсий у 75 (84,3%) мужчин и 14 (15,7%) женщин в возрасте 40–77 лет (в среднем 58,8±0,8 года).
ТП возникало у 59 (66,3%) больных на фоне ишемической болезни сердца (ИБС), в том числе постинфарктного кардиосклероза — у 3 (3,4%), стабильной стенокардии — у 8 (9%) и у 30 (33,7%) пациентов — на фоне постмиокардитического кардиосклероза. Сопутствующую АГ наблюдали у 45 (50,6%) больных, в том числе с острыми нарушениями мозгового кровообращения и транзиторными ишемическими атаками в анамнезе — у 2 (2,2%). Кардиохирургические вмешательства перенесли 7 (7,9 %) больных. Хроническую сердечную недостаточность (СН) I степени диагностировали у 63 (70,8%) больных, IIА степени — у 9 (10,1%). Выявлена сопутствующая патология: сахарный диабет — у 6 (6,7%), различные заболевания щитовидной железы без нарушения ее функции — у 8 (9%) и хронические заболевания легких — у 13 (14,6%).
У 38 (42,7%) пациентов пароксизм аритмии зарегистрирован впервые. При обследовании на фоне синусового ритма выявлены нарушения проводящей системы сердца: синдром слабости синусового узла (ССУ) — у 1 (1,1%) пациента, дисфункция ССУ — у 7 (7,9%), нарушения атриовентрикулярного (АВ) проведения органического генеза — у 2 (2,2%) и функционального — у 4 (4,5%). Анамнез аритмии составлял от 7 сут до 16 лет (в среднем 2,8 года), а продолжительность существующего эпизода — от 3 сут до 5 лет (в среднем 146,3±25,2 дня).
В исследование не включали больных ревматизмом, врожденными и приобретенными клапанными пороками, острым миокардитом, острым коронарным синдромом, тяжелыми нарушениями функции печени и почек, СН выше IIА степени.
Перед восстановлением синусового ритма всем больным проводили лечение основного заболевания, коррекцию артериального давления, компенсацию СН, а также АКТ в соответствии с существующими современными рекомендациями. У всех больных попытки медикаментозной кардиоверсии были неэффективными. С этой целью назначали пропафенон, этацизин, амиодарон и их различные комбинации, в том числе с антиаритмическими препаратами (ААП) замедляющими АВ-проведение (β-адреноблокаторы, верапамил). У 40 (44,9%) пациентов с хорошо переносимым ТП восстановление ритма осуществляли без антиаритмической подготовки.
Перед плановой кардиоверсией всем больным выполняли трансторакальную эхокардиографию на ультразвуковой системе HDI 5000 («Philips») для оценки структурно-функционального состояния миокарда предсердий и желудочков, исключения клапанных пороков сердца.
При проведении ЧП-ЭхоКГ оценивали структурно-функциональные показатели миокарда УЛП, наличие предикторов тромбообразования в УЛП (ФСК III—IV степени, снижение средней пиковой скорости изгнания крови из УЛП менее 20 см/с) и тромбов в УЛП, определяли тип внутрипредсердной гемодинамики (ВПГ) и характеристики кровотока в легочных венах (максимальную скорость волн S, D, A, индекс S/D) [7, 8].
ЧП-ЭКС осуществляли с помощью электрокардиостимулятора Cordelectro-05 (Литва), диагностическими электродами ПЭДМ-6 и ПЭДМ-9 (Украина). Положение электрода определяли по монополярной чреспищеводной электрограмме (ЧП-ЭГ). Оптимальным считали такое положение, когда от дистального полюса электрода регистрировали двухфазные зубцы А максимальной амплитуды. Электростимуляцию начинали с частоты, на 25–35% превышающей частоту ТП, и в последующем ее повышали до восстановления синусового ритма или перевода в стойкую ФП. Сила тока составляла 15–30 мА, продолжительность импульса — 10 мс, продолжительность залпа — 1–5 с, межполюсное расстояние 10–20 мм. При сохранении ТП электростимуляцию повторяли через несколько секунд в том же режиме, а в отсутствие эффекта повышали частоту электростимуляции. Число повторных залпов электростимуляции не ограничивали. При сохранении ФП в течение 15–20 мин внутривенно вводили прокаинамид в дозах до 2000 мг.
При первой процедуре не удалось восстановить синусовый ритм у 16 (18%) пациентов. Из них у 3 (3,4%) ФП в течение суток трансформировалась в ТП, и ритм восстановлен повторной ЧП-ЭКС, а у 3 (3,4%) — с помощью электроимпульсной терапии. У 10 (11,2%) больных синусовый ритм восстановить не удалось. Кроме того, у 7 (7,9%) больных, несмотря на успешную кардиоверсию, в течение 3 мес возникли рецидивы аритмии, и всем им сохранена постоянная форма ФП/ТП в связи с неэффективностью ААТ, тяжестью основного заболевания, наличием значимой сопутствующей патологии или СН.
Статистическую обработку полученных результатов проводили с помощью пакета прикладных программ Microsoft-Excel 2003 и Statistica. Использовали методы вариационной статистики, t-критерий Стьюдента.
Результаты и обсуждение
По результатам проведенного исследования, средняя скорость изгнания крови из УЛП у больных составляла 10,1–98,3 см/с (в среднем 46,9±2,2 см/с), наиболее часто (у 22,5%) ее выявляли в пределах 31–40 см/с. Согласно имеющимся данным, у лиц с ФП этот показатель составляет в среднем 20–30 см/с, а у здоровых людей с синусовым ритмом — более 50 см/с [5, 8].
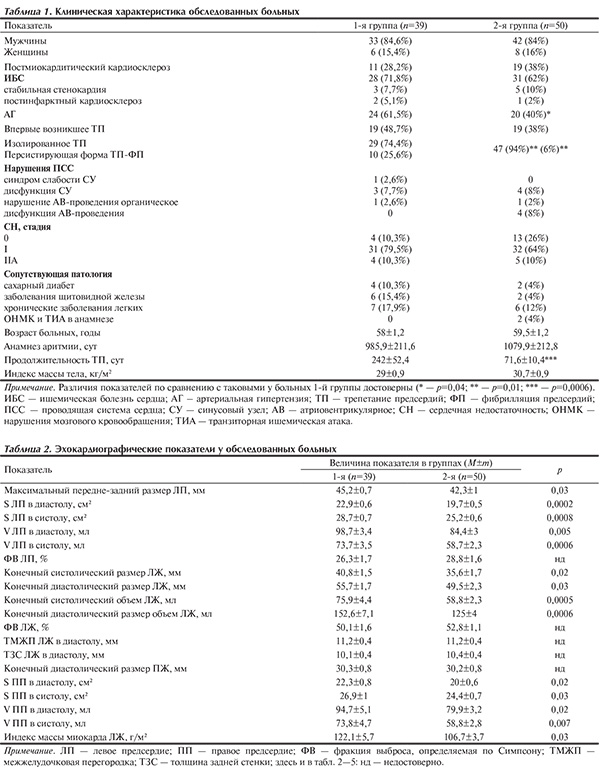
В зависимости от скоростных гемодинамических показателей УЛП все больные были разделены на 2 статистически сопоставимые группы: в 1-й (n=39) — средняя скорость изгнания крови из УЛП была 40 см/с и менее, во 2-й (n=50) — более 40 см/с. По возрасту, соотношению полов, индексу массы тела, длительности анамнеза аритмии, основному и сопутствующим заболеваниям, частоте выявления впервые возникших эпизодов аритмии и дисфункции проводящей системы сердца, тяжести СН обе группы были сопоставимы (табл. 1). У больных 1-й группы отмечено более длительное существование эпизода ТП (р<0,001), чаще выявляли АГ (р=0,04), сочетание ТП и ФП (р=0,01), в то же время у обследованных 2-й группы преобладало изолированное ТП.
По данным эхокардиографии, у больных 1-й группы имелись достоверно более неблагоприятные изменения линейных и объемных показателей обоих предсердий и левого желудочка (ЛЖ), был выше индекс массы миокарда ЛЖ, но статистически достоверного различия функциональных показателей предсердий и ЛЖ между группами не выявлено (табл. 2). По данным литературы, длительное существование аритмии приводит к диастолической дисфункции миокарда ЛЖ, а затем – и систолической с последующим формированием аритмогенной кардиомиопатии [2, 4]. В то же время, несмотря она продолжительный (более 8 мес) эпизод аритмии у пациентов 1-й группы нами не выявлено нарушений систолической функции ЛЖ, что, по-видимому, связано с тем, что у 74,4% больных было изолированное ТП и у 48,7% — впервые выявленные пароксизмы. Структурные изменения при изолированном ТП отличаются от таковых при ФП [9—12].
При проведении ЧП-ЭхоКГ у пациентов 1-й группы максимальная и средняя скорость изгнания и максимальная скорость наполнения кровью УЛП (р<0,0001), показатель максимальной скорости волны S пульмонального кровотока (р=0,003) были ниже, а размер устья УЛП — больше (р=0,03), чаще встречались II и III типы ВПГ (р=0,001 и р=0,045) (табл. 3). В то же время в группе с высокими скоростными показателями у 98% обследованных наблюдался I тип ВПГ (р=0,0001), а в полости и УЛП отсутствовал ФСК II—IV степени. Следовательно, наличие маркеров тромбообразования напрямую зависело от структурных и гемодинамических показателей миокарда УЛП, типа ВПГ, максимальной скорости волны S пульмонального кровотока, что соответствует данным проведенных ранее исследований [5, 6].
Дозу ААП перед проведением ЧП-ЭКС подбирали индивидуально в зависимости от тяжести основного заболевания и сопутствующей патологии, стадии СН, частоты сокращений желудочков. Амиодарон назначали в суточных дозах по 200–800 мг, пропафенон — 450 мг, этацизин — 75–150 мг, бетаксолол — 2,5 мг, бисопролол — 2,5–10 мг, верапамил — 240 мг. В 1-й группе чаще использовали амиодарон и его комбинацию с другим ААП I класса или β-адреноблокатором (р=0,03), а у 54% пациентов 2-й группы восстановление ритма осуществляли без предварительной ААТ, что обусловлено частотой возникновения и продолжительностью эпизода аритмии.
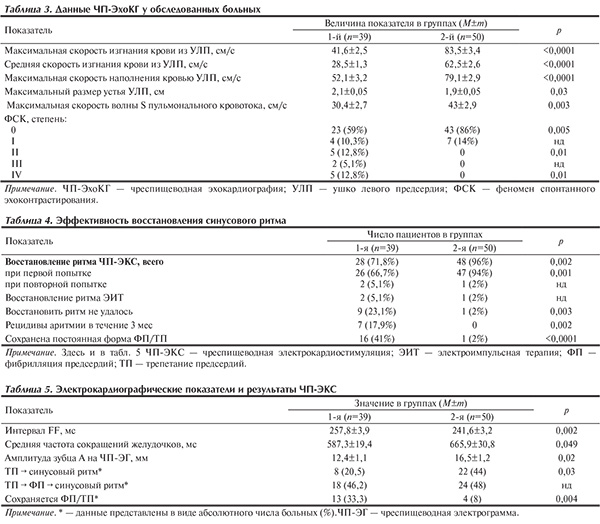
При проведении ЧП-ЭКС отмечалось достоверное различие по эффективности метода между группами как при первой процедуре (р=0,001), так и с учетом повторных попыток (р=0,002), чаще кардиоверсии были неэффективны (р=0,003) (табл. 4). Кроме того, в течение 3 мес у 7 (17,9%) больных 1-й группы возникли повторные пароксизмы ТП (р=0,002). Таким образом, у больных с более низкими скоростными показателями гемодинамики УЛП достоверно чаще не удавалось восстановить и сохранить синусовый ритм (р<0,0001).
Анализируя показатели электрокардиограммы у больных 1-й группы, отметили меньшую частоту сокращений предсердий (интервал FF) (р=0,002), что обусловлено увеличением длины волны круга re-entry за счет замедления скорости проведения импульса в предсердиях (амплитуда зубца А на ЧПЭГ; р=0,02) на фоне их гипертрофии (табл. 5). Величина амплитуды зубца А на ЧП-ЭГ отражает электрический потенциал кардиомиоцитов предсердий, а чем больше локальный ток (разница потенциалов между зоной поляризации и зоной деполяризации, т.е. амплитуда потенциала действия), тем быстрее распространяется импульс по кругу re-entry [2]. В обеих группах регистрировали тахисистолическую форму ТП.
При проведении процедуры у обследованных пациентов 2-й группы чаще проходила прямая конверсия в синусовый ритм (р=0,03) без периодов ФП, а у пациентов 1-й группы ЧП-ЭКС были неэффективны (р=0,004), что, по-видимому, обусловлено наличием сочетания ТП и ФП, гипертрофии левого предсердия, а также длительностью эпизода аритмии.
При ТП в отличие от ФП кровоток внутри камер сердца остается однородным в результате относительно сохраненной сократительной способности УЛП, поэтому у пациентов с изолированным ТП значительно реже регистрируют ФСК. При ТП не выявлено маркеров тромбообразования со стороны системы гемостаза. По-видимому, сохранение регулярного ритма с меньшей частотой сокращений предсердий и высокой скоростью изгнания крови из камер сердца по сравнению с ФП предотвращает их развитие [11, 12].
Исследование SPAF III показало, что у пациентов с ФП, у которых максимальная средняя скорость изгнания крови из УЛП составила менее 20 см/с, риск развития ишемического инсульта был почти в 3 раза выше, чем у больных с более высокой скоростью; у них также достоверно чаще выявлялся тромб в УЛП (17% по сравнению с 5%) [4]. В другом исследовании показано, что максимальная средняя скорость изгнания крови из УЛП более 40 см/с положительно коррелирует с вероятностью длительного сохранения синусового ритма у пациентов с персистирующей формой ФП неклапанной этиологии [6].
Таким образом, по результатам проведенного нами исследования выявлено, что использование ЧП-ЭхоКГ у больных с ТП может значительно оптимизировать период перед проведением кардиоверсии и прогнозировать последующую тактику сохранения синусового ритма. Следует предположить, что у пациентов с высокими скоростными показателями гемодинамики УЛП возможно не только сокращение сроков проведения АКТ, но и полная ее отмена у лиц без факторов риска развития ТЭО в связи с отсутствием условий для тромбообразования в полостях и УЛП. Кроме того, полученные результаты могут быть использованы для дифференцированного отбора больных с ожидаемой высокой эффективностью катетерных аблаций при ТП и прогнозирования появления ФП после проведения процедуры.
Выводы
В группе больных с трепетанием предсердий и средней скоростью изгнания крови из ушка левого предсердия менее 40 см/с регистрировали достоверно бóльшую продолжительность существующего эпизода, чаще выявляли сопутствующую артериальную гипертензию и фибрилляцию предсердий, кардиоверсия была менее эффективной, чаще возникали рецидивы аритмии и сохранялась постоянная форма аритмии.
У пациентов со средней скоростью изгнания крови из ушка левого предсердия более 40 см/с не выявлено феномена спонтанного контрастирования II–IV степени и внутрипредсердной гемодинамики II–III типа, а при проведении электростимуляционной кардиоверсии достоверно чаще отмечали прямую конверсию в синусовый ритм без периодов фибрилляции предсердий, поэтому у больных данной категории возможно сокращение сроков проведения антикоагулянтной терапии.



