Сердечно-сосудистые заболевания, в том числе острый коронарный синдром (ОКС), несмотря на успехи современного лечения, продолжают оставаться ведущей причиной смертности в мире. Структура атеросклеротической бляшки (АСБ) наряду со степенью стеноза просвета коронарной артерии (КА) и некоторых других условий играет первостепенную роль в патогенезе нестабильной стенокардии (НС) и инфаркта миокарда (ИМ). Данные гистологических исследований показали, что наиболее часто встречающимся морфологическим типом нестабильной АСБ является фиброатерома с тонкой капсулой [1—3].
С появлением данных о структурных особенностях нестабильных АСБ стали развиваться методы, позволяющие их визуализировать, и прежде всего — внутрисосудистое ультразвуковое исследование (ВСУЗИ) и оптико-когерентная томография (ОКТ). Мультиспиральная компьютерная томография (МСКТ) КА из-за низкого временно'го и пространственного разрешения долгое время находилась в стороне от реализации подобных задач, несмотря на ряд преимуществ, к которым можно отнести неинвазивность и относительную простоту исполнения метода. В последнее десятилетие одновременно с появлением более современных томографов с улучшенными техническими характеристиками стали появляться работы, посвященные выявлению компьютерно-томографических (КТ-) признаков нестабильности АСБ.
К описанным критериям можно отнести положительное ремоделирование (высокий индекс ремоделирования), низкую плотность АСБ (менее 30 HU), наличие микрокальцинатов в виде депозитов размерами менее 3 мм, неровный контур, а также «кольцевидное контрастирование», не превышающее 130 HU [4—9]. Вместе с тем до сих пор окончательно не определено значение каждого из признаков, как и не найдены их сочетания, позволяющие отличить стабильную АСБ от нестабильной.
Целью нашей работы были оценка состояния АСБ в КА и выявление возможных признаков их нестабильности у больных с ОКС.

Материал и методы
Клинический материал. Путем проспективного набора в исследование включали больных, поступающих в блок интенсивной терапии отделения неотложной кардиологии с подозрением на ОКС без стойкого подъема сегмента ST. Диагнозы «инфаркт миокарда» и «нестабильная стенокардия» устанавливали согласно общепринятым критериям [10]. ИМ без подъема сегмента ST диагностировали при выявлении новой депрессии сегмента ST >0,1 мВ или инверсии зубца Т по меньшей мере до 0,3 мВ более чем в 2 смежных отведениях, сопровождающихся повышением уровня тропонина выше 99-го процентиля. НС диагностировали при наличии типичной клинической картины прогрессирующей стенокардии на уровне III—IV функционального класса, впервые возникшего ангинозного приступа или ранней постинфарктной стенокардии без повышения уровня тропонина в крови.
 В исследование не включали больных с тяжелыми осложнениями основного заболевания, в том числе отеком легких, кардиогенным шоком, а также тахиаритмиями и бради-аритмиями с нерегулярным ритмом сердца, наличием доказанной аллергической реакции на контрастный препарат, почечной недостаточностью со снижением скорости клубочковой фильтрации <50 мл/мин и перенесенной операцией коронарного шунтирования или имплантацией более одного стента в анамнезе.
В исследование не включали больных с тяжелыми осложнениями основного заболевания, в том числе отеком легких, кардиогенным шоком, а также тахиаритмиями и бради-аритмиями с нерегулярным ритмом сердца, наличием доказанной аллергической реакции на контрастный препарат, почечной недостаточностью со снижением скорости клубочковой фильтрации <50 мл/мин и перенесенной операцией коронарного шунтирования или имплантацией более одного стента в анамнезе.
Первоначально в исследование были включены 90 больных с подозрением на ОКС. После проведения МСКТ были исключены пациенты с плохим качеством изображения, массивным кальцинозом КА, а также больные, у которых отсутствовали гемодинамически значимые стенозы КА и впоследствии был исключен диагноз «ОКС». Таким образом, в общую группу вошли 70 больных — 48 (68,6%) с НС и 22 (31,4%) с ИМ. Клинические характеристики больных представлены в табл. 1.
При анализе данных МСКТ за симптом-связанный сегмент КА во всех случаях принимали только один сегмент артерии, кровоснабжающей зону инфаркта или ишемии миокарда, выявляемых на основании данных электро- и эхокардиографии (локальные зоны нарушения сократимости), нагрузочных тестов и инвазивной коронарографии. В случае обнаружения в артерии нескольких АСБ, симптом-связанной считали ту, которая вызвала наибольшее сужение просвета сосуда.
МСКТ КА выполняли всем пациентам на 1—3-и сутки заболевания до проведения инвазивной коронарографии на томографе с 64 рядами детекторов. В качестве контрастного препарата использовали ультравист из расчета 1,5 мл на 1 кг массы тела больного. Препарат вводили внутривенно со скоростью 5 мл/с автоматическим шприцем. Исследование выполняли в 2 фазы: нативную (до введения контрастного препарата) и артериальную, во время которой вводили контрастный препарат. Нативную фазу выполняли в пошаговом режиме с силой тока 100 мА, напряжением 120 кВ и толщиной среза 3 мм. Время полуоборота трубки составило 250 мс. После выполнения первой фазы проводили визуальную оценку степени выраженности кальциноза КА для определения целесообразности выполнения второй фазы. Артериальную фазу выполняли в спиральном режиме с получением 64 срезов шириной 0,5 мм с силой тока 400 мА и напряжением 120 кВ. Время полуоборота трубки составило 400 мс. Оценку степени стеноза КА и состояния АСБ проводили в артериальную фазу.
После серии поперечных томографических срезов выполняли трехмерные, мультипланарные и другие реконструкции томограмм с учетом стандартизованного деления КА на 14 сегментов в соответствии с классификацией Американской ассоциации кардиологов [11], за исключением некоторых ветвей артерий (2-я диагональная, 2-я артерия тупого края, заднебоковая ветвь, задняя межжелудочковая ветвь) при условии малого их диаметра. Степень стеноза определяли по стандартным ангиографическим критериям как отношение диаметра просвета сосуда в месте сужения к диаметру сосуда дистальнее сужения. Оценку ремоделирования сосуда проводили на основании расчета отношения диаметра наружного контура сосуда в месте расположения АСБ к диаметру его проксимального сегмента. За положительное ремоделирование принимали отношение диаметров (индекс ремоделирования) >1,1.
АСБ определялись во всех сегментах КА в сосудах с диаметром не менее 2 мм в поперечном сечении. При визуальном анализе АСБ распределяли на кальцинированные, мягкие и комбинированные в зависимости от наличия и объема включений кальция. Оценку минимальной плотности АСБ проводили в поперечных срезах КА. При этом выделяли «зону интереса» — мягкотканный компонент АСБ, не содержащий включений кальция, в котором выполняли 3—5 автоматических измерений плотности в различных участках с последующим выбором минимального значения. Кроме того, оценивали такие признаки нестабильности АСБ, как наличие включений точечных микрокальцинатов в виде депозитов размерами менее 3 мм, неровный контур, положительное ремоделирование КА (высокий индекс ремоделирования) и «кольцевидное контрастирование», с плотностью не более 130 HU. На мультипланарных реконструкциях измеряли протяженность АСБ.
В окончательный анализ включали все АСБ при степени сужения >50%, диаметре сосуда более 2 мм и хорошем качестве изображения. Контур АСБ, а также в ряде случаев ее протяженность не определялись при наличии окклюзии сосуда. При невозможности достоверного анализа диаметра артерии проксимальнее места стеноза ремоделирование сосуда также не оценивали.
Статистический анализ выполняли с использованием программы Microsoft Excel и пакетов статистических программ Statistica 10 for Windows (StatSoft Inc., USA) и SPSS 11 for Windows. Для количественных критериев рассчитывали средние значения с использованием стандартного отклонения, а при распределении, отличном от нормального, — медианы с 25-м и 75-м процентилями. При оценке межгрупповых различий средних значений использовали критерий t Стьюдента и критерий U Манна—Уитни. Определение пограничного значения минимальной плотности АСБ и ее протяженности для оценки нестабильности АСБ проводили с построением ROC-кривых и расчетом площади под кривой. При сравнении частоты выявления качественных критериев в обеих группах использовали критерий χ2 Пирсона максимального правдоподобия с построением таблиц сопряженности. Для каждого признака нестабильности АСБ проводили расчет чувствительности, специфичности, прогностической ценности положительного и отрицательного результатов по таблицам сопряженности 2×2, а также относительного риска. Поиск комбинации признаков, позволяющих верифицировать нестабильную АСБ, осуществляли с помощью многомерного анализа — логистической регрессии. Статически значимыми считали различия при p<0,05.

Результаты
При анализе клинических характеристик, представленных в табл. 1, достоверные различия между группами больных с ИМ и НС были выявлены только по числу ранее перенесенных ИМ (p=0,048).
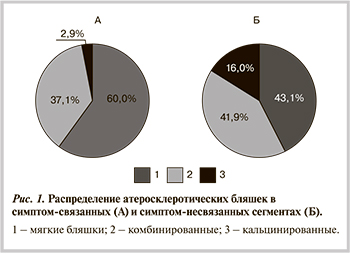
Для окончательного анализа были объединены все проанализированные сегменты КА у больных с НС и ИМ. Таким образом, суммарно было включено 214 коронарных сегментов, разделенных на 2 группы — симптом-связанные (1-я группа, n=70) и остальные (2-я группа, n=144). Все АСБ в 1-й группе считались нестабильными. Стенозы от 75 до 90% наблюдались в большинстве случаев — 56,3%, более 90% — в 36,2% и лишь в 7,3% случаев они оказались умеренными (50—75%). В 1-й группе количество мягких АСБ оказалось достоверно выше, а кальцинированных — ниже по сравнению со 2-й группой (60 и 43,1%; p=0,02; 2,9 и 16%; p=0,005 соответственно). Распределение типов АСБ в обеих группах показано на рис. 1.
Минимальная КТ-плотность, рассчитанная по медиане с учетом неправильного распределения, а также протяженность АСБ достоверно различались в обеих группах: 37 (20; 50) HU и 47 (26; 75,5) HU (p=0,009); 16,8±13,4 и 13,2±6,9 мм (p=0,01) соответственно. Пограничные значения минимальной КТ-плотности и протяженности АСБ, позволяющие отличить нестабильную АСБ, были определены по ROC-кривым и оказались равными 40 HU (площадь под кривой 0,66) и 13,5 мм (площадь под кривой 0,59). Полученные ROC-кривые представлены на рис. 2.
Таким образом, по нашим данным, дополнительными признаками, ассоциированными с нестабильностью АСБ, оказались минимальная КТ-плотность <40 HU и протяженность АСБ >13,5 мм.

В 1-й группе по сравнению со 2-й группой статистически значимо выше оказалась частота положительного ремоделирования (70,2 и 54,3%; p=0,03), неровного контура АСБ (91,7 и 68,7%; p=0,0002), протяженности >13,5 мм (57,4 и 38,2%; p=0,009). Различие между группами по количеству АСБ с минимальной плотностью <40 HU приближалось к статистически значимому (55,1 и 41%; p=0,053), в то время как по частоте выявления микрокальцинатов и «кольцевидного контрастирования» статистически значимых межгрупповых различий не получено (p=0,12 и p=0,27 соответственно).
При сравнении симптом-связанных поражений у больных с ИМ и НС ни по одному из перечисленных признаков статистически значимых различий выявлено не было, что является дополнительным аргументом для объединения всех пациентов в общую группу при анализе КТ-данных.
Пример симптом-связанного сегмента КА с несколькими КТ-признаками «нестабильности» АСБ представлен на рис. 3.
Чувствительность, специфичность, прогностическая ценность положительного (ПЦПР) и отрицательного (ПЦОР) результатов, а также относительный риск для каждого из анализируемых признаков представлены в табл. 2.
Наиболее чувствительным признаком нестабильного характера АСБ оказался неровный контур (91,7%), а наиболее специфичными — «кольцевидное контрастирование»(78,3%) и наличие микрокальцинатов (72,9%). ПЦОР практически всех перечисленных признаков была относительно высокой —70% и более.
 Многофакторный анализ показал, что единственной комбинацией признаков, позволяющей получить достоверные различия между обеими группами, оказалась мягкая АСБ с минимальной плотностью <40 HU и неровным контуром, которая встречалась в 1/3 случаев в 1-й группе и почти в 2 раза реже во 2-й группе (31,67 и 17,91% соответственно; p=0,04). Хотя чувствительность данной комбинации оказалась низкой (32%), ее специфичность, также как и ПЦОР, были достаточно высокими — 82 и 72,8% соответственно.
Многофакторный анализ показал, что единственной комбинацией признаков, позволяющей получить достоверные различия между обеими группами, оказалась мягкая АСБ с минимальной плотностью <40 HU и неровным контуром, которая встречалась в 1/3 случаев в 1-й группе и почти в 2 раза реже во 2-й группе (31,67 и 17,91% соответственно; p=0,04). Хотя чувствительность данной комбинации оказалась низкой (32%), ее специфичность, также как и ПЦОР, были достаточно высокими — 82 и 72,8% соответственно.
Обсуждение
Результаты ряда работ указывают, что существуют специфические КТ-критерии нестабильности АСБ, выявляемые как при сравнении групп больных с ОКС и стабильной стенокардией, так и при сопоставлении данных МСКТ и ВСУЗИ. Прогностическая роль этих критериев исследовалась в крупных проспективных работах, позволивших оценить вероятность развития ОКС вследствие разрыва АСБ с исходными признаками нестабильности.
Наиболее часто среди подобных признаков упоминаются низкая плотность АСБ <30 HU, положительное ремоделирование и включения микрокальцинатов. Так, в работе S. Motoyama и cоавт. [4] данные критерии отличались высокими ПЦПР и ПЦОР (77—91% и 65—85% соответственно). В другом исследовании, выполненном с участием 1059 больных с известной коронарной болезнью или подозрением на нее, авторы подтвердили высокую прогностическую ценность в развитии ОКС и положительного ремоделирования, и низкой плотности АСБ, тогда как наличие микрокальцинатов значимой роли не играло [5]. В большинстве более поздних работ подтвердилась концепция о значении микрокальцинатов, положительного ремоделирования и низкой плотности АСБ как наиболее часто встречающихся признаков нестабильности. В то же время появились и другие критерии, такие, как объем АСБ и, в частности, мягкотканной ее части с плотностью менее 30 HU [12], «кольцевидное контрастирование» [6—8] и в некоторых исследованиях — неровный контур АСБ [9]. Стоит отметить, что при описании почти всех критериев у авторов отмечается единство мнений, за исключением оценки плотности АСБ. Так, в ранней работе S. Motoyama и соавт., посвященной сопоставлению данных МСКТ-16 и ВСУЗИ, было показано, что плотность мягкой АСБ <30 HU соответствует липидному ядру, определенному по данным ВСУЗИ [13]; позднее это было принято в ряде работ как признак нестабильности АСБ. В то же время при расчете «средней плотности АСБ» большинством авторов используются данные, полученные при определении плотности в 3—5 участках АСБ, не содержащих включений кальция, что, по нашему мнению, не вполне соответствует понятию «средняя плотность АСБ». Вероятно, правильнее было бы говорить о «средней плотности компонента АСБ, не содержащего кальций». В то же время ряд авторов при подобном расчете оценивали только минимальную плотность АСБ [14, 15], причем в работе Т. Kitagawa и соавт. за признак нестабильности принималась плотность 40 HU, а не 30 HU [14], а в работе W.C. Huang и соавт. она составила 49,6 HU [16]. В некоторых исследованиях проводилась оценка различий средних значений плотности между стабильными и нестабильными АСБ [14—17].
В нашем исследовании помимо всех описанных ранее признаков дополнительно проводилась визуальная оценка структуры АСБ с последующим их разделением на мягкие, комбинированные и кальцинированные, и именно мягкие АСБ наиболее часто оказывались симптом-связанными (60%). Статистически значимые различия были получены в частоте выявления положительного ремоделирования и неровного контура, что совпадает с большинством из упомянутых исследований. Однако в отношении микрокальцинатов и кольцевидного контрастирования статистически значимых межгрупповых различий не получено. Стоит отметить, что хотя в большинстве работ оба критерия чаще встречались в нестабильных АСБ, в проспективных исследованиях роль микрокальцинатов в прогнозировании ОКС не подтвердилась [5, 18], что согласуется с нашими результатами.
По нашим данным, минимальная плотность АСБ оказалась статистически значимо ниже, а число АСБ с минимальной плотностью менее 40 HU — больше среди симптом-связанных АСБ, хотя различия для последних приближались, но не достигли статистически значимого уровня (p=0,053). Полученные данные по плотности АСБ также совпадают с представленными ранее результатами исследований, и хотя при ROC-анализе пограничной плотностью для нестабильных АСБ оказалась не 30 HU, a 40 HU, это не противоречит данным литературы. Ранее упоминалось, что в работе Т. Kitagawa и соавт. данная плотность оказалась равной как раз 40 HU [14], а в некоторых исследованиях и выше — 49,6 HU [16] и даже 68 HU [17]. Интересными представляются полученные нами данные, согласно которым средняя протяженность симптом-связанных АСБ оказалась статистически значимо больше (p=0,009), чем симптом-несвязанных АСБ. Хотя в литературе не встречается подобных упоминаний, ряд авторов показали, что объем нестабильных АСБ статистически значимо больше, чем стабильных [5, 7, 12]. Таким образом, с учетом того, что объем АСБ при прочих равных условиях пропорционален ее протяженности, наше исследование подтверждает результаты приведенных работ.
В единичных публикациях авторы пытались определить комбинацию признаков, позволяющую выявить нестабильную АСБ. Так, в работе S. Motoyama и cоавт. было показано, что наличие одновременно 3 критериев нестабильности АСБ, таких как низкая плотность (менее 30 HU), положительное ремоделирование и включения микрокальцинатов позволяет с 95% вероятностью прогнозировать нестабильность АСБ, а отсутствие всех 3 — со 100% вероятностью исключить ее [4]. В нашей работе единственным сочетанием признаков, позволившим отличить нестабильную АСБ от стабильной, оказалась мягкая АСБ с неровным контуром и минимальная плотностью <40 HU.
Необходимо заметить, что большинство исследований, направленных на изучение КТ-признаков нестабильности, проводилось при сравнении симптом-связанных АСБ у больных с ОКС и АСБ у пациентов со стабильной стенокардией. Поскольку в наше исследование не включались больные со стабильной стенокардией, у всех пациентов проводилось сравнение симптом-связанных и остальных поражений. В настоящее время существует гипотеза о генерализованном процессе дестабилизации АСБ у больных с ОКС, ведущую роль в котором играет активация факторов воспаления. Это может быть одной из причин, объясняющих отсутствие достоверных межгрупповых различий по частоте выявления некоторых признаков нестабильности в нашем исследовании. В ряде работ показано, что признаки нестабильности и разрывов АСБ могут выявляться одновременно в нескольких коронарных сегментах у больных данной категории. Так, А. Tanaka и соавт. продемонстрировали, что у 24% больных с ОКС по данным ВСУЗИ выявляются множественные (более 1) АСБ с признаками разрыва во всем коронарном русле (p<0,01) [19]. В исследовании А. Mauriellо и соавт. данные аутопсии КА показали, что признаки активного воспаления у умерших от ИМ определяются не только в симптом-связанных сегментах КА [20]. Возвращаясь к работам, выполненным с помощью МСКТ, можно отметить исследования Т. Kunimasa и соавт. и Y. Sato и соавт., показавших, что АСБ, не связанные с развитием ОКС у больных данной группы, также отличаются от АСБ у больных со стабильной стенокардией более часто встречающимися признаками нестабильности АСБ и меньшей плотностью [17, 21]. В работе Т. Kitagawa статистически значимые различия между симптом-связанными и остальными сегментами у больных с ОКС получены только по индексу ремоделирования [14]. Тем не менее немало работ, в которых авторы, подобно нам, для оценки признаков нестабильности рассматривали в качестве референтных сегментов все остальные поражения КА, считая их «стабильными», и получали при этом достоверные межгрупповые различия [12, 16, 22]. Мы получили достоверные различия по частоте выявления большинства признаков. Это еще раз подчеркивает, что описанные критерии позволяют распознать очевидно нестабильные АСБ. В то же время в остальных сегментах артерий также встречаются АСБ с признаками нестабильности.
Ограничением нашей работы является то, что у больных с ОКС для оценки признаков нестабильности АСБ в симптом-связанных поражениях в качестве группы сравнения использовались АСБ в остальных сегментах КА тех же больных, поскольку в исследование не включались пациенты со стабильной стенокардией.
Заключение
Современная компьютерная томографическая ангиография позволяет оценивать не только степень стеноза коронарного русла, но и состояние атеросклеротической бляшки, в том числе с признаками нестабильности. Атеросклеротические бляшки в симптом-связанных сегментах коронарных артерий отличаются от остальных сегментов более низкой плотностью, большей протяженностью, положительным ремоделированием и неровным контуром. По нашим данным, дополнительными признаками, ассоциированными с нестабильностью атеросклеротической бляшки, оказались также минимальная плотность менее 40 HU и протяженность >13,5 мм. Признаком, позволяющим с высокой специфичностью отличить нестабильную атеросклеротическую бляшку от стабильной, является мягкая бляшка с минимальной плотностью <40 HU и неровным контуром.



