Артериальная гипертензия (АГ) — одна из наиболее распространенных форм патологии у беременных женщин, которая по-прежнему остается главной причиной материнской, фетальной и неонатальной заболеваемости и смертности во всем мире [1, 2]. Дисплазия соединительной ткани (ДСТ) в свою очередь является широко распространенным наследственным нарушением структуры и функции соединительной ткани [3, 4]. Универсальный и генерализованный характер мезенхимального дефекта при ДСТ вовлекает в патологический процесс репродуктивную систему со значительным увеличением риска развития акушерской и перинатальной патологии [5, 6].
Все это делает чрезвычайно важным выявление и изучение коморбидной патологии при АГ у беременных, понимание ее механизмов развития и морфофункциональных проявлений, обоснование диагностических подходов и необходимость лечебно-организационных мероприятий, направленных на снижение акушерских и перинатальных потерь.
Целями настоящего открытого контролируемого исследования были выявление клинических особенностей гипертонической болезни (ГБ) у беременных женщин с ДСТ и оценка эффективности комплексной антигипертензивной и метаболической терапии.
Материал и методы
В условиях созданной в Удмуртской Республике системы оказания мультидисциплинарной помощи беременным женщинам с сердечно-сосудистой патологией (специализированные женская консультация, стационарное отделение, санаторий, родильный дом) под нашим наблюдением находились 150 беременных. В 1-ю группу вошли 38 женщин с ГБ: у 20 из них была диагностирована, согласно российским рекомендациям по диагностике и лечению АГ у беременных [2], I стадия болезни, у 18 — II стадия (табл. 1). Всем больным проводили адекватную длительную антигипертензивную терапию медикаментозными препаратами, получившими доказательство относительной безопасности для плода в клинических исследованиях [1, 2]. В I триместре беременные получали метилдопу, в случаях недостаточно эффективного контроля артериального давления (АД) со II триместра гестации назначали пролонгированный нифедипин или амлодипин, бисопролол или метопролола тартрат. В лечении 38 беременных рандомизированной 2-й группы с ГБ I—II стадий, наряду с рациональной антигипертензивной терапией со II триместра применяли 3—4 курса оротата магния (магнерот, «Wörwag Pharma», Германия): по 1000 мг 3 раза в сут в течение 1 нед, затем по 500 мг 3 раза в сут в течение 3 нед. В 3-ю группу включили 42 беременных с ГБ I—II стадий, у которых была диагностирована ДСТ [4].
Антигипертензивная терапия у этих больных также дополнялась 3—4 курсами оротата магния.

Оценка t-критерия Стьюдента и непараметрических критериев Манна—Уитни (U), Пирсона (χ2) подтвердила сопоставимость (p>0,05) сравниваемых групп по возрасту, индексу массы тела, степени, стадии, длительности АГ и риску сердечно-сосудистых осложнений, акушерскому анамнезу, наличию сопутствующей экстрагенитальной патологии и гинекологических заболеваний, паритету родов. Тем не менее в группе больных ГБ и ДСТ отмечалась склонность к большим степени и тяжести АГ, к более частым воспалительным заболеваниям органов малого таза, инфекциям мочевыводящих путей, отягощенному акушерскому анамнезу (см. табл. 1).
Контрольную (4-ю) группу составили 32 практически здоровые женщины (средний возраст 22,6±0,4 года) с неосложненным течением беременности и родов, родившие здоровых доношенных детей.
В исследование не были включены женщины с классифицируемыми наследственными нарушениями соединительной ткани, ожирением II—III степени, сахарным диабетом, многоплодной беременностью.
Комплексное лечение и наблюдение помимо антигипертензивной и метаболической терапии включало разъяснительные беседы по поводу АГ (возможные осложнения, необходимость квалифицированного наблюдения и лечения; угрожающие симптомы, при возникновении которых необходимо срочно обратиться к врачу), обеспечение лечебно-охранительного режима с обязательным отдыхом в постели в утренние часы и днем в течение часа на левом боку, физиологическую психопрофилактическую подготовку беременной и ее семьи к рождению ребенка, занятия лечебной физкультурой (легкие тренирующие физические упражнения, в том числе в плавательном бассейне), соблюдение индивидуальной лечебно-профилактической диеты, проведение седативной фитотерапии пустырником и мочегонной (уросептической) фитотерапии канефроном. При развитии анемии под контролем уровня сывороточного железа, ферритина и общей железосвязывающей способности сыворотки крови проводилось своевременное лечение ферро-фольгаммой («Wörwag Pharma», Германия).
Всем женщинам проводили стандартное общеклиническое и акушерское обследование и необходимый комп-лекс лабораторных и инструментальных исследований. Последние включали динамический контроль показателей электрокардиограммы (ЭКГ), эхокардиографии (ЭхоКГ), кардиотокографии, ультразвукового исследования (УЗИ) состояния плода и маточно-плацентарного кровотока, клиническое измерение АД, суточное мониторирование и самоконтроль АД, УЗИ почек и органов брюшной области. По показаниям проводили чреспищеводное электрофизиологическое исследование, суточный мониторинг ЭКГ, фиброгастродуоденоскопию, спирометрию и др.
УЗИ сердца и сосудов выполняли на аппаратах Siemens Acuson CV 70 и Acuson 128 ХР/10c мультичастотным (4—2 МГц) и линейным (7 МГц) датчиками с регистрацией изображения на жестких магнитооптических дисках. ЭхоКГ проводили в одно- (М-) и двухмерном (В-) режимах по стандартной методике, рекомендованной Американским обществом эхокардиографии (ASE) [7]. Из парастернального и верхушечного доступов визуализировали клапанный аппарат сердца, измеряли систолический диаметр левого и правого предсердий (ЛП, ПП), конечный диастолический размер (КДР) правого желудочка (ПЖ), конечные размеры левого желудочка (ЛЖ) в систолу и диастолу (КСР, КДР), толщину задней стенки ЛЖ (ТЗСд) и межжелудочковой перегородки (ТМЖПд) в диастолу. Рассчитывали следующие структурно-функциональные показатели ЛЖ: фракцию укорочения (ФУ)=(КДР-КСР)/КДР×100, конечные объемы в систолу и диастолу (КСО, КДО) по формуле Teichholz КСО=7×(0,1×КCР)3/(2,4+0,1×КCР), КДО=7×(0,1×КДР)3/(2,4+0,1×КДР), ударный объем УО=КДО-КСО, фракцию выброса (ФВ)= УО/КДО×100, относительную толщину стенок ОТС=(ТМЖПд+ТЗСд)/КДР, меридиональный миокардиальный стресс в диастолу МСд=0,334×АДд×КДР/ТЗСд×[1+(ТЗСд/КДР)]. Массу миокарда ЛЖ (ММЛЖ) вычисляли по корригированной формуле ASE [8], ММЛЖ=0,832×[0,1×(ТМЖПд+КДР+ТЗСд)3-(0,1×КДР)3]+0,6 и индексировали к площади поверхности тела (ППТ, м2) при индексе массы тела (ИМТ) с вычетом прибавки в течение беременности ≤25 кг/м2 или на ППТ идеальной фигуры при ИМТ>25 кг/м2 (ППТид.=0,216×рост2,7+0,83) [9]. Увеличение ИММЛЖ констатировали при ее значениях >80 г/м2, гипертрофию ЛЖ (ГЛЖ) — при более 110 г/м2 [10].
Диагностику пролапса митрального клапана (ПМК) основывали на российских рекомендациях [4].
Состояние диастолической функции ЛЖ изучали по трансмитральному допплеровскому кровотоку с определением максимальной скорости в фазы раннего (пик Е) и позднего, или предсердно-индуцированного (пик А) наполнения, отношения Е/А, времени замедления раннего наполнения (DTE) и времени изоволюмического расслабления (IVRT).
Морфофункциональная характеристика сосудов включала оценку диаметра плечевой артерии (dПА), эндотелийзависимой вазодилатации (ЭЗВД) и толщины интимы—медии (ТИМ) общей сонной артерии. ЭЗВД изучали по приросту dПА в пробе с реактивной гиперемией через 60 с после снятия манжеточной компрессии: ЭЗВД менее 10% свидетельствовала о вазомоторной дисфункции эндотелия [11]. Проведение исследования одобрено Комитетом по биомедицинской этике ГБОУ ВПО «Ижевская государственная медицинская академия».
Статистическую обработку данных проводили с помощью пакета программы SPSS 13 (SPSS Inc., США). После проверки характера распределения данные представлены в виде средних и ошибки (M±m) и относительных величин. Для установления достоверности различий между группами сопоставления использовали критерии t, U, χ2, при множественных сравнениях — t-критерия с поправкой Бонферрони χ2.
Различия считали статистически значимыми при p<0,05.
Результаты и обсуждение
У всех беременных с ДСТ выявлен первичный (изолированный, идиопатический) ПМК с характерной аускультативной картиной (систолический шум и поздний систолический щелчок на верхушке сердца). У 29 (69%) женщин 3-й группы диагностирован ПМК I степени с пролабированием митральных створок в полость ЛП от 3 до 5 мм (у 12 из них — с регургитацией I степени, у 3 — II степени), у 13 (31%) беременных — ПМК II степени с провисанием створок на 6—9 мм (у 9 — с митральной регургитацией I и у 3 — II степени). На фоне настоящей беременности первичный ПМК впервые выявлен у 28 (66,7%) больных.
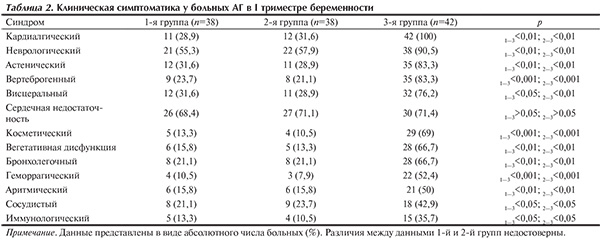
Структурно-функциональные признаки ДСТ у беременных с ГБ отличались многообразием клинических синдромов, связанных с полиорганными дисплазическими и изменениями патологическими состояниями (табл. 2). Все 100% женщин с ДСТ и ГБ и 1/3 больных ГБ (p1—3<0,01; p2—3<0,01) отмечали кардиалгии различного характера (колющие, ноющие, сжимающие, давящие и жгучие апексалгии или загрудинные боли, иррадиирующие в левую руку). Нередко при ДСТ встречались преходящая депрессия сегмента ST и низкий или слабо-отрицательный зубец T в III стандартном отведении ЭКГ. Неврологические нарушения были представлены признаками хронической недостаточности мозгового кровообращения, венозной дисциркуляции, подтвержденными при ультразвуковой допплерографии брахиоцефальных сосудов и результатами электроэнцефалографии (интенсивные головные боли, головокружение, мелькание «мушек» перед глазами), липотимией и в единичных случаях синкопальными состояниями (p1—3<0,01; p2—3<0,01). Астенический синдром (снижение работоспособности, повышенная утомляемость, ухудшение переносимости физических и психоэмоциональных нагрузок) отмечали 83,3% беременных с ДСТ и ГБ и 28,9–31,6% больных ГБ (p1—3<0,01; p2—3<0,01). Вертеброгенный синдром (дизонтогенетический остеохондроз позвоночника, межпозвонковые грыжи, вертебробазилярная недостаточность, спондилолистез) и вегетососудистый синдром (расстройство терморегуляции, метеочувствительность, лабильность пульса и АД, вегетативные кризы, нарушения периферического кровообращения, парестезии, дизестезии, варикозная болезнь нижних конечностей, геморрой, телеангиэктазии и др.) также значительно чаще встречались у женщин с ДСТ (см. табл. 2).
Нарушения ритма сердца в виде синусовой тахикардии, наджелудочковой и желудочковой экстрасистолии, пароксизмальной АВ-узловой тахикардии, миграции водителя ритма по предсердиям, аномалии проведения импульса по дополнительным путям и т.д. зафиксированы к концу I триместра беременности у 50% больных с ДСТ и у 15,8% — 1-й и 2-й групп (p1—3<0,01; p2—3<0,01). Геморрагический синдром (повторные носовые кровотечения, петехиально-пятнистые кровоизлияния в кожу, длительные и/или обильные менструации в анамнезе) отмечали 52,4% больных ГБ с ДСТ и лишь 7,9—10,5% беременных с ГБ (p1—3<0,001; p2—3<0,001). Синдром иммунологических нарушений в виде иммунодефицитных, аутоиммунных и аллергических состояний встречался у каждой десятой больной ГБ и каждой третьей женщины с ГБ и ДСТ (p1—3<0,05; p2—3<0,05; см. табл. 2).
Всеобъемлющее поражение соединительной ткани у женщин с ДСТ определяло выраженность висцерального синдрома (синдромы неязвенной диспепсии и раздраженного кишечника, нефроптоз и дистопии почек, птозы и дискинезии органов желудочно-кишечного тракта, птоз органов малого таза и половых органов, гастроэзофагеальные и дуоденогастральные рефлюксы, грыжи пищеводного отверстия диафрагмы), бронхолегочного (вентиляционные нарушения, гиперреактивность бронхов) и косметического (в рамках дизрафических нарушений) синдромов (аномалии прикуса, готическое небо, асимметрии лица, О- и Х-образные деформации нижних конечностей, изменения кожных покровов и др.).
Вероятно, нефроптоз, дистопии почек и связанные с ними нарушения гемодинамики почек, уродинамики и инфекции мочевых путей, а также наличие вертебробазилярных, цереброваскулярных и вегетативных нарушений явились неблагоприятным фоном для развития АГ у женщин с ДСТ (почечные и нейрогенные механизмы АГ у таких больных могли включаться раньше и чаще).
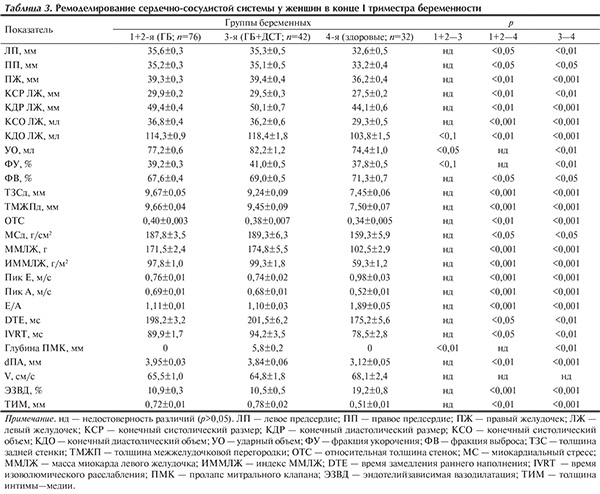
Визуализация сердца у женщин в конце I триместра гестации выявила выраженную гипертрофическую перестройку ЛЖ у больных ГБ 1-й и 2-й групп (табл. 3). Если средний ИММЛЖ при ГБ I стадии свидетельствовал о его увеличении — 81,5±1,8 г/м2, что, по мнению В.А. Vakili и соавт. (2001) [12], повышает риск развития тяжелых сердечно-сосудистых осложнений), то при ГБ II стадии — о явной ГЛЖ (113,8±2,1 г/м2). МСд существенно не различался у больных ГБ I и II стадий (что может объясняться частично компенсаторными возможностями ГЛЖ, направленной на уменьшение нагрузки на стенки ЛЖ в диастолу), но был выше, чем в группе здоровых беременных. Глобальная систолическая функция ЛЖ была несколько ниже при ГБ: физиологическая беременность уже в ранние сроки приобретает гемодинамический характер, соответствующий высокому потоку и низкой резистентности (гипердинамический тип и системная вазодилатация) [13].
Наблюдавшееся у беременных 1-й и 2-й групп увеличение систолического размера ЛП свидетельствовало о возрастании давления в его полости, обусловленном необходимостью наполнения и растяжения ЛЖ. Связанная с систолой ЛП диастолическая функция ЛЖ требует повышенного давления в малом круге кровообращения, что в нашем исследовании отразилось в росте КДР ПЖ и в напряжении систолы ПП. В целом ремоделирование у беременных с ГБ затрагивало все камеры сердца (см. табл. 3).
Характер ремоделирования сердечно-сосудистой системы у больных ГБ на фоне ДСТ в конце I триместра беременности свидетельствовал о гиперфункции миокарда ЛЖ, его перегрузке и дисфункции эндотелия, связанных, по-видимому, с дисплазической дезорганизацией роста тканевых структур миокарда и сосудов и гиперреактивностью компенсаторных механизмов. У больных 3-й группы (ГБ+ДСТ) отмечались достоверно больший, чем у беременных 1-й и 2-й групп, ударный объем ЛЖ и тенденция к увеличению его КДО и ФУ. Изменение указанных параметров свидетельствует о наличии гиперфункции миокарда при провисании створок митрального клапана, что, возможно, обеспечивается не только усилением инотропных вегетативных (симпатических) влияний, гиперконстрикцией папиллярных мышц, но и увеличением мощности мембранных систем транспорта кальция и возрастающей мощностью систем митохондрий, обеспечивающих повышение интенсивности функционирования клеточных структур кардиомиоцитов [14]. Достоверное по сравнению с контролем увеличение КДО и конечного диастолического напряжения миокарда, или миокардиального стресса (МСд), отражающего преднагрузку ЛЖ у больных ДСТ, также способствовало повышению сердечного выброса и общей насосной функции ЛЖ за счет увеличения венозного притока. Факторы, вызывающие увеличение объема ЛЖ (гиперволемия, увеличение венозного возврата крови), при первичном ПМК частично носят компенсаторный характер, так как способствуют натяжению сухожильных хорд и соответственно уменьшают выбухание створок (преимущественно задней створки) митрального клапана в полость ЛП (см. табл. 3).
Анализ характеристик диастолического трансмитрального потока у беременных с ДСТ показал, что исходные параметры у них существенно отличались от таковых контрольной группы. Эти отличия, прежде всего, касались скоростных показателей (пики Е, А, Е/А) и в меньшей степени — временны'х DTE, IVRT и свидетельствовали о выраженных нарушениях диастолической функции ЛЖ в связи с дисплазическими изменениями расслабления и растяжения миокарда — снижении эластичности вследствие дисбаланса кровоснабжения эндо- и субэндокардиальных слоев, коронароспазме или ишемии и фиброзе сосочковых мышц.
Обоснованию применения препаратов магния у беременных с ДСТ посвящено множество работ [5, 15—18]. Установлено, что Mg2+ играет важную роль в регуляции энергозависимых транспортных каналов Са2+ как в митохондриях гладких мышечных клеток, так и в саркоплазматической сети. Магний входит в состав основного вещества соединительной ткани и участвует в регуляции ее метаболизма, в условиях недостаточности магния нарушается способность фибробластов продуцировать коллаген [14, 19]. Недостаток магния сопряжен с угрозой прерывания беременности и гипертензивными состояниями, ведет к развитию фетоплацентарной недостаточности, задержке внутриутробного роста плода, патологическому прелиминарному периоду, дискоординированной родовой деятельности [20—22]. Отмечен опыт успешного применения оротата магния при гестационной АГ [16].
В нашем исследовании на фоне приема оротата магния произошло заметное снижение потребности в антигипертензивных средствах для поддержания адекватного АД у беременных с хронической АГ. Следует отметить существенное снижение частоты развития клинических синдромов у женщин с ДСТ к середине III триместра беременности (табл. 4). Это может быть объяснено как отчетливым положительным действием комплексной антигипертензивной, метаболической (оротат магния) и седативной (пустырник) терапии в условиях специализированного динамического наблюдения и выполнения немедикаментозных мероприятий (лечебная физкультура, психологическая подготовка к родам и др.), так и гестационными изменениями центральной и внутрисердечной гемодинамики (увеличение объема циркулирующей крови способствовало уменьшению глубины ПМК с 5,8±0,2 мм в конце I триместра до 4,1±0,1 мм — в III; р<0,001). Достоверно снизилась частота развития клинической симптоматики ГБ (кардиалгический, неврологический, астенический, вегетативный, аритмический, сосудистый синдромы) и у женщин 2-й группы наблюдения, в лечении которых использовался оротат магния. Гестационный период сопровождался увеличением частоты развития хронической сердечной недостаточности (ХСН) в 1-й группе больных (р<0,05), тогда как во 2-й группе число беременных с признаками ХСН к моменту родов имело тенденцию к снижению.

У 3 (7,1%) женщин с ПМК и регургитацией II степени на митральном клапане произошло увеличение тяжести ХСН по классификации Нью-Йоркской ассоциации сердца (NYHA) в III триместре, что послужило показанием к плановой госпитализации в родильный дом для подготовки к родоразрешению. Следовательно, несмотря на благоприятный «ответ» больных ГБ на фоне ДСТ на комплексную антигипертензивную и метаболическую терапию в ходе мультидисциплинарного сопровождения гестационного периода, беременные с ДСТ и ГБ, особенно при наличии митральной регургитации, нуждаются в тщательном наблюдении специалистов и эффективной организации лечебной помощи.
Беременность у женщин с ГБ и ГБ на фоне ДСТ, получавших со II триместра 3—4-месячные курсы терапии оротатом магния, закончилась срочными родами в 100 и 95,2% соответственно (в 1-й группе больных ГБ — в 84,2%; p<0,05), преждевременными — в 0 и 4,8% (1-я группа — 16,4%; p<0,05), оперативными — в 18,4 и 19,0% (23,7%; p>0,05) случаев. Абдоминальное родоразрешение преимущественно проводилось по акушерским показаниям в плановом порядке, в 2 случаях в 1-й группе проведено экстренное кесарево сечение в связи со слабостью родовой деятельности.
Известно, что ГБ значительно осложняет течение беременности: по эпидемиологическим данным, преэклампсия развивается у 5—7% беременных, но этот показатель возрастает до 25% у женщин с хронической (предсуществующей) АГ [1].
В нашем исследовании преэклампсия диагностирована у 8 (19,0%) женщин 3-й группы (что не отличалось от показателей в группе беременных с ГБ без ДСТ — 21,1 и 18,4%) и во всех случаях сопровождалась нарушениями маточно-плацентарно-фетального кровотока. Однако тяжелая преэклампсия (потребовавшая магнезиальной терапии и досрочного родоразрешения в интересах здоровья и жизни матери и плода) развилась только у больных ГБ 1-й группы (2 случая, или 5,2%; p1—2, 1—3>0,05). Из общего числа наблюдений антенатальная гибель плода наступила у одной беременной 1-й группы в срок 31 нед. У 149 женщин наблюдался благополучный исход беременности. Таким образом, перинатальная смертность и перинатальные потери в 1-й группе (ГБ составили по 26,3‰, во 2-й, 3-й группах (где применялся оротат магния) и в группе здоровых беременных — 0 (p1—2, 1—3 >0,05). В группах наблюдения и сравнения не было ни одного случая материнской смерти (смерти женщины во время беременности, родов и в течение 42 дней после родов).
Гестационный возраст новорожденных 2-й и 3-й групп (в которых в течение беременности применялся оротат магния) оказался существенно больше (38,5±0,2 нед; 38,3±0,2 нед), чем в 1-й группе (37,5±0,2 нед.; p1—2, 1—3<0,05), и меньше, чем в контрольной (39,5±0,1 нед; p2—4, 3—4<0,05; p1—4<0,001). Масса тела при рождении во 2-й группе наблюдения в среднем составила 3315,4±63,5 г, в 3-й — 3294,4±63,2 г, в 1-й (включая мертворожденного) и контрольной группах здоровых — 3114,8±62,4 и 3551,3±53,8 г соответственно (p1—2, 1—3<0,05; p2—3>0,05; p1—4<0,01; p2—4, 3—4<0,01). Оценки по шкале Апгар на 1-й и 5-й минутах после рождения во 2-й и 3-й группах также оказались выше, в среднем составляя 8—9 баллов (в 1-й группе 7—8, в контрольной — 8—10 баллов). Малую массу тела при рождении (<2500 г) имели 15,8% живых доношенных детей 1-й группы, 2,6% — новорожденных 2-й группы, 4,8% — 3-й группы (p1—2<0,05; p1—3<0,01; p2—3, 2—4, 3—4>0,05). Заболеваемость новорожденных 1-й группы составила 526,3‰, 2-й — 394,7‰ и 0 — у детей контрольной группы (p1—2<0,05; p1—4, 2—4<0,001). Заболеваемость новорожденных 3-й группы составила 476,2‰ (p1—2, 1—3>0,05, р3—4<0,001), в ее структуре отсутствовали врожденные пороки развития. Последние (дисплазия тазобедренных суставов, крипторхизм) при ДСТ у матерей отмечали А.В. Клеменов и соавт. (2005) [6]. Среди заболеваний новорожденных 1-й, 2-й и 3-й групп преобладала гипербилирубинемия. Большинство детей основных групп (76,3, 89,5 и 83,3%) и все дети группы сравнения в удовлетворительном состоянии были выписаны домой, остальные новорожденные переведены на второй этап выхаживания.
Заключение
Наличие дисплазии соединительной ткани у беременных женщин с эссенциальной гипертензией (гипертонической болезнью) отягощает сердечно-сосудистые и цереброваскулярные проявления заболевания. Гипердинамический тип кровообращения, патология почек, дистонический психовегетативный фон у беременных с нарушением структуры и функции соединительной ткани служат отражением исходно низких резервных возможностей сердечно-сосудистой и вегетативной нервной систем. В течение всей беременности, родов и послеродового периода такие больные нуждаются в пристальном наблюдении специалистов за их клиническим состоянием, уровнем артериального давления и функциональным состоянием почек.
Применение средств метаболического (оротат магния), антигипертензивного, уросептического и седативного действий в условиях мультидисциплинарного динамического гестационного сопровождения, выполнение немедикаментозных мероприятий (лечебная физкультура, психологическая подготовка к родам, лечебно-охранительный режим) способствуют регрессу клинической симптоматики, благоприятному течению беременности и успешным исходам родов у женщин как с эссенциальной гипертензией, так и с гипертонической болезнью на фоне дисплазии соединительной ткани.



