Операция транскатетерного протезирования аортального клапана (ТПАК) за последние десятилетия получила широкое распространение в медицинской практике. Главным показанием к операции является критический аортальный стеноз (АС) у больных из группы высокого хирургического риска [1, 2].
Несмотря на меньшую инвазивность операции ТПАК по сравнению с операцией с использованием искусственного кровообращения (ИК), существует ряд осложнений, связанных с данной методикой.
В многоцентровом исследовании C.R. Smith и соавт. (2011) определена частота развития осложнений у больных, которым выполнялась транскатетерная коррекция АС [3].
Так, 30-дневная летальность составляла 3,4%, годичная — 4,2%.
Среди осложнений наиболее часто встречались сосудистые осложнения (11%), кровотечение (9,3%), вновь возникшие нарушения ритма сердца — НРС (8,6%), острые нарушения мозгового кровообращения — ОНМК (3,8%) [3].
В исследовании M. Seiffert и соавт. (2013), включавшем 458 пациентов с АС, показано, что в 35 (7,6%) случаях возникли интра-операционные осложнения, а в 13 (2,8%) случаях потребовалась экстренная хирургическая операция [4]. Чаще всего среди осложнений встречались дислокация аортального протеза (17%), тяжелая аортальная регургитация (12%), повреждение дуги аорты (5%). Стернотомию и хирургический гемостаз потребовалось выполнять у 5 (13%) пациентов, у которых операция осложнилась перфорацией левого желудочка и острой тампонадой сердца. Обструкция коронарных артерий аортальным протезом наблюдалась в 6 (1,3%) случаях. У пациентов с осложнениями 30-дневная летальность составила 31,4%, а у пациентов, которым пришлось выполнять экстренную хирургическую операцию, — 38,5% [4].
 Целью нашего исследования являлась оценка частоты и характера осложнений после ТПАК. Количество осложнений оценивалось в группе операций, проведенных трансапикальным и трансфеморальным доступами. Мы попытались выявить зависимость осложнений от вида анестезии в группе трансфеморального протезирования аортального клапана (АК).
Целью нашего исследования являлась оценка частоты и характера осложнений после ТПАК. Количество осложнений оценивалось в группе операций, проведенных трансапикальным и трансфеморальным доступами. Мы попытались выявить зависимость осложнений от вида анестезии в группе трансфеморального протезирования аортального клапана (АК).
Материал и методы
Исследование проведено на базе отдела сердечно-сосудистой хирургии в ФГБУ «Российский кардиологический научно-производственный комплекс» Министерства здравоохранения Российской Федерации.
В исследование были включены 99 больных с критическим АС в период с 2009 по 2014 г. У одного из больных наряду с критическим АС отмечалась выраженная недостаточность АК. Риск смерти оценивали по шкалам EuroSCORE II и STS Score [5,6]. Характеристики больных представлены в табл. 1.
Больные были разделены на 2 исследуемые группы. В группу А включены 25 пациентов, которым ТПАК выполнялось из трансапикального доступа в условиях общей анестезии. В группу Б включены 74 пациента, которым ТПАК выполнялось из трансфеморального доступа. В свою очередь группа Б была разделена на 2 подгруппы: Б1 и Б2. В подгруппе Б1 (n=18) операция выполнялась под местной анестезией в сочетании с седацией. В подгруппе Б2 (n=56) операция выполнялась в условиях общей анестезии. Распределение пациентов по группам представлено в табл. 2.
Статистическую обработку данных исследования проводили с помощью программы Statisticа 7.0. Использовали непараметрические методы статистического анализа.
Для оценки качественных признаков использовали таблицы частот, χ2. Результаты представлены в виде абсолютных и относительных частот или медианы (Me) и интерквартильного размаха (25-й процентиль; 75-й процентиль). Различия считали статистически значимыми при p≤0,05.
Результаты и обсуждение
В период с 2009 по 2014 г. выполнено 99 операций ТПАК по поводу критического АС. Оценивали частоту и характер осложнений, возникающих в стационаре. Летальность составила 9,1% (умерли 9 пациентов). Данные о летальности зарубежных многоцентровых исследований сопоставимы с полученными нами результатами и составляют от 3,4 до 12,7% [7—10].
У двух пациентов наблюдалась дислокация аортального протеза, что потребовало экстренного репротезирования в условиях ИК, в последующем они умерли от полиорганной недостаточности. В 4 случаях возникла острая ишемия миокарда с развитием кардиогенного шока. У 1 пациента произошел отрыв хорды передней створки митрального клапана при имплантации протеза CoreValve. Пациент умер от острой сердечной недостаточности после экстренной пластики митрального клапана. В 1 случае причиной смерти явилось ОНМК, еще у 1 больного причиной смерти послужила терминальная стадия хронической почечной недостаточности с развитием отека легких.
Среди самых частых осложнений ТПАК наблюдалась кровопотеря, не требующая дополнительного хирургического гемостаза, — 17,2% (17 пациентов). Гемоперикардом операция осложнилась у 6 (6%) больных. Из них троим потребовалось экстренное хирургическое вмешательство. Потребность в имплантации постоянного водителя ритма по поводу остро возникшей атриовентрикулярной блокады (АВБ) 2—3-й степени возникла у 15 (15,1%) пациентов. Фибрилляция желудочков (ФЖ) развилась у 5 (5,1%) больных, инфаркт миокарда — у 2 (2%). Острая почечная недостаточность (ОПН) после транскатетерных операций возникла у 8 (8%) пациентов, из них потребность в проведении гемодиализа наблюдалась у 5 пациентов. Делирий в послеоперационном периоде отмечен у 10 (10,1%) больных, а ОНМК — у 7 (7,1%). Продленная искусственная вентиляция легких (ИВЛ) потребовалась 7 (7%) пациентам.
Кроме общего числа осложнений после ТПАК оценивали характер и частоту развития осложнений в зависимости от вида хирургического доступа, а также от вида анестезии в группе трансфеморального протезирования АК.
В группе трансапикального доступа продолжительность операции составила 180 (150; 200) мин, пребывания в стационаре после операции — 10 (9; 12) сут. Длительность операции и пребывания стационаре после трансфеморального протезирования оказалась несколько меньше: 160 (140; 200) мин и 9,5 (7; 14) сут соответственно. Медиана пребывания в отделении реанимации в обеих группах составила 1 (1; 1) сут.
При использовании местной анестезии продолжительность операции составила 155 (120; 200) мин, пребывания в стационаре после операции — 9,5 (7;13) сут. Длительность операции при выполнении общей анестезии оказалась больше: 220 (205; 265) мин, пребывания в стационаре — 9,5 (7; 15) сут.
Медиана пребывания в отделении реанимации в обеих группах составила 1 (1; 1) сут.
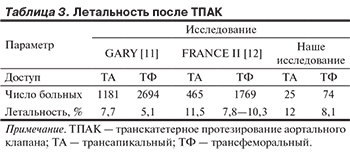
 В группе трансапикального протезирования летальность оказалась выше, чем в группе трансфеморального протезирования (12% против 8,1%), однако различия не были статистически значимыми. В зарубежных исследованиях GARY (2013) [11] и FRANCE II (2012) [12] при большем числе наблюдений получены похожие результаты при сравнении с нашим исследованием. Летальность после ТПАК представлена в табл. 3.
В группе трансапикального протезирования летальность оказалась выше, чем в группе трансфеморального протезирования (12% против 8,1%), однако различия не были статистически значимыми. В зарубежных исследованиях GARY (2013) [11] и FRANCE II (2012) [12] при большем числе наблюдений получены похожие результаты при сравнении с нашим исследованием. Летальность после ТПАК представлена в табл. 3.
Среди осложнений ТПАК особое место занимают НРС, обусловливающие необходимость последующей имплантации постоянного электрокардиостимулятора (ЭКС). В структуре нарушений ритма и проводимости сердца преобладают АВБ 2-й и 3-й степеней, впервые возникшая полная блокада левой ножки пучка Гиса с удлиненным интервалом PR. Частота имплантации постоянного ЭКС, по данным зарубежных источников, составила 36,1%, а в некоторых работах приближается к 45%, особенно в случаях имплантации биологического протеза CoreValve [13, 14].
В нашем исследовании частота имплантации постоянного ЭКС после трансфеморального и трансапикального протезирования АК составила 17,5 и 8% соответственно (p=0,34). В группе общей анестезии частота имплантации постоянного ЭКС оказалась выше, чем в группе местной анестезии — 19,6 и 11,1% соответственно (p≤0,5). Хотя различия оказались недостоверными, их можно объяснить преобладанием в группе трансфеморального протезирования, а также в группе общей анестезии клапанов CoreValve [15].
Кровотечение из места хирургического доступа, по данным зарубежных источников, является одним из самых частых осложнений ТПАК. Трансапикальный доступ осуществляется с помощью левосторонней торакотомии и является более травматичным. Трансфеморальный доступ выполняется путем артериотомии бедренной артерии. Частота возникновения кровотечения в этом случае составляет 12—16,5% [16—18].
В структуре осложнений в нашей работе кровопотеря, не потребовавшая дополнительного хирургического гемо-стаза, заняла второе место и составила 14,9% при использовании трансфеморального доступа. При выполнении операции из трансапикального доступа кровопотеря была самым частым осложнением — 24%. В группах местной и общей анестезии различия по частоте кровопотери, превышающей физиологичную, были статистически незначимыми (16,6% против 14,2%; p=1,0). Гемоперикард был осложнением у 6,8% пациентов при выполнении операции из трансфеморального доступа, в группе трансапикального доступа его частота составляла 4% (p=1,0). Самой частой причиной гемоперикарда явилась перфорация правого желудочка временным эндокардиальным электродом при проведении высокочастотной стимуляции сердца. В зарубежной литературе частота развития тампонады сердца колеблется от 4,3 до 13% [4, 18, 19].
 ФЖ после имплантации протеза возникла у 3 (4,1%) пациентов в группе трансфеморального протезирования АК, в группе трансапикального доступа — у 2 пациентов (8%; p=0,59). Высокая частота развития ФЖ при трансапикальном протезировании, вероятно, обусловлена не только высокочастотной стимуляцией сердца, но и хирургической травмой левого желудочка. При сравнении групп местной и общей анестезии при трансфеморальном протезировании получены достоверные различия по частоте возникновения ФЖ (3 случая против 0; p=0,012). Это можно объяснить тем, что в отсутствии эхокардиографического контроля в группе местной анестезии хирургу требовалась бо'льшая кратность высокочастотной электрокардиостимуляции (ВЧЭКС). Длительные и многократные эпизоды ВЧЭКС могут провоцировать развитие жизнеугрожающих артимий [20].
ФЖ после имплантации протеза возникла у 3 (4,1%) пациентов в группе трансфеморального протезирования АК, в группе трансапикального доступа — у 2 пациентов (8%; p=0,59). Высокая частота развития ФЖ при трансапикальном протезировании, вероятно, обусловлена не только высокочастотной стимуляцией сердца, но и хирургической травмой левого желудочка. При сравнении групп местной и общей анестезии при трансфеморальном протезировании получены достоверные различия по частоте возникновения ФЖ (3 случая против 0; p=0,012). Это можно объяснить тем, что в отсутствии эхокардиографического контроля в группе местной анестезии хирургу требовалась бо'льшая кратность высокочастотной электрокардиостимуляции (ВЧЭКС). Длительные и многократные эпизоды ВЧЭКС могут провоцировать развитие жизнеугрожающих артимий [20].
При анализе частоты развития ОНМК между группами трансфеморального и трансапикального доступов получены недостоверные различия (5,4% против 12%; p=0,36). Полученные нами данные подтверждаются данными многоцентрового рандомизированного мета-анализа, включавшего 2978 пациентов, где частота развития ОНМК достоверно не отличалась [21].
Частота возникновения послеоперационного делирия была практически одинаковой в исследуемых группах (в группе трансфеморального доступа — 10,8%, в группе трансапикального доступа — 8%, в группе местной анестезии —11,1%, в группе общей анестезии — 10,7%) и, вероятно, не связана с хирургическим доступом и видом анестезии. Наши результаты сопоставимы с данными зарубежных исследователей, в работе которых делирий развился у 11,5% из 508 пациентов [22].
ОПН после ТПАК является предметом обсуждения многих авторов. Частота развития этого осложнения колеблется в широких пределах — 8,3—57% [23, 24]. По нашим данным, ОПН развилась у 6,8% пациентов после трансфеморального ТПАК и у 12% пациентов после трансапикального ТПАК (p=0,41). Хотя различия и были недостоверными, бо'льшую частоту развития ОПН в группе трансапикального протезирования можно объяснить большей частотой кровотечения в одноименной группе. При трансфеморальном протезировании в группе местной анестезии случаев ОПН не наблюдали, в группе общей анестезии ОПН выявлена у 8,9% пациентов. Различия оказались недостоверными (p=0,32) и, таким образом, развитие ОПН не связано с видом анестезии.
Продленная ИВЛ в данном исследовании расценивалась как ИВЛ длительностью более 1 сут. После трансапикального протезирования потребность в длительной ИВЛ возникала чаще и составила 16%, в то время как в группе трансфеморального доступа потребность в длительной ИВЛ составила 4,1% (p=0,06). Различия в группах приближались к достоверным. Увеличение длительности ИВЛ в группе трансапикального протезирования объясняется большим количеством осложнений в данной группе, торакотомией у больных пожилого и старческого возраста. При проведении общей анестезии в группе трансфеморального протезирования необходимость в длительной ИВЛ составила 5,3%. В группе местной анестезии ИВЛ не проводилась, однако в раннем послеоперационном периоде у 1 (5,6%) пациента развился делирий, потребовавший респираторной поддержки.
Заключение
Операция транскатетерного протезирования аортального клапана является оптимальным методом лечения больных пожилого и старческого возраста с критическим аортальным стенозом и высоким хирургическим риском. Операция транскатетерного протезирования является менее травматичной, чем операция с использованием искусственного кровообращения, но все-таки имеет ряд осложнений. Согласно полученным данным, нет зависимости между видом хирургического доступа (трансапикального, трансфеморального) при протезировании аортального клапана и частотой осложнений.
В группе трансфеморального протезирования установлена статистически значимая связь между видом анестезии и частотой возникновения фибрилляции желудочков. В условиях местной анестезии фибрилляция желудочков возникает чаще.



