Интерес к такому относительно редкому заболеванию, как гипертрофическая кардиомиопатия (ГКМП) в последние годы достаточно велик. Особое внимание уделяется генетической детерминации идентичных нарушений, имеющих различную нозологическую принадлежность. Лучшему пониманию носящего мультифакторный характер механизма развития гипертрофии левого желудочка (ГЛЖ) может служить сочетанное клинико-генетическое обследование больных гипертонической болезнью (ГБ) с ГЛЖ и гипертрофической кардиомиопатией.
Известно, что полиморфизм генов-модификаторов способен в значительной мере влиять на фенотипические проявления сердечно-сосудистых заболеваний, в том числе на ГКМП и ГБ. Идентифицирован ряд генов, претендующих на эту роль. Один из них — ген рецепторов 1-го типа ангиотензина II (АТР1) — ATR1.
Ген ATR1 локализуется в 3-й хромосоме, ген АТ2-рецептора — в хромосоме Х. В 3-нетранслируемой области гена ATR1, находящегося на хромосоме 3q21—q25, расположен полиморфный маркер А1166С, основанный на вариабельности оснований А (аденина) и С (цитидина) в 1166-м положении нуклеотидной последовательности гена. Следует отметить, что ни один из аллелей не является в строгом смысле патологическим. Речь идет не о мутации, а именно о варианте, встречающемся в здоровой популяции. Наиболее часто в здоровой популяции встречается генотип гомозиготный по А аллелю (АА). Этот вариант и принято считать нормальным, что подразумевает стандартный ответ рецептора на воздействие ангиотензина II. По разным данным, доля АА составляет от 71 до 62% [1, 2]. Причем данные различаются в зависимости от места проживания популяции, ее национального и расового состава. Так, в новосибирской популяции распространенность генотипа АА составляет 55,4%, АС — 42,9%, СС — 2,7% [3], тогда как в Ростове этот показатель составляет соответственно 40, 50 и 10% [4]. Из этого следует, что российская здоровая популяция отличается от здоровой популяции в целом, или например, от австралийской. Данные об ассоциации этого полиморфизма с риском развития сердечно-сосудистых заболеваний, в частности ГЛЖ, также неоднозначны.
Имеется информация о существенном увеличении распространенности аллеля, несущего цитидин в положении 1166, у больных ГБ [2, 5, 6]. Получены данные о наличии ассоциации между полиморфизмом A/C гена ATR1 и ГБ в московской популяции, причем аллель А и генотип АА ослабляют риск раннего развития ГБ, а аллель С и остальные варианты генотипов, напротив, способствуют этому [7]. Японскими исследователями была выявлена достоверная корреляция аллеля С с индексом массы тела у нормотензивной популяции [8].
В исследовании A. Osterop и соавт. [9] показано влияние полиморфизма гена АТ II рецептора 1-го типа (полиморфизм AT1-R A/C1166) на степень ГЛЖ при ГКМП. Масса миокарда левого желудочка (ММЛЖ), толщина межжелудочковой перегородки (ТМЖП), а также уровень ренина в плазме у носителей аллелей С были достоверно выше, чем у гомозигот АА. При многофакторном анализе доказано, что модулирующее влияние полиморфизма A/C гена AT1-R не зависит ни от уровня ренина, ни от полиморфизма ACE I/D. Однако в другом исследовании [10] получены несколько иные данные. Сам этот тип полиморфизма не влиял на размеры сердца, в то время как его сочетание с аллелем Т гена ангиотензиногена увеличивало риск ГЛЖ. В то же время в ряде других работ вообще отрицается ассоциация этого полиморфизма с сердечно-сосудистыми заболеваниями [11].
Целью данного исследования явился анализ зависимости клинической картины и степени выраженности ГЛЖ от полиморфизма А1166С гена ATR1 у пациентов с ГКМП и ГБ.
Материал и методы
В исследование включены 68 пациентов: 1-я группа — 35 пациентов с ГКМП (18 мужчин и 17 женщин, средний возраст 46,7±15,7 года), в том числе 16 больных с присоединившейся артериальной гипертонией (АГ); 2-я группа — 33 пациента с ГЛЖ, развившейся на фоне длительно протекающей ГБ (ГБ + ГЛЖ; 17 мужчин и 18 женщин, средний возраст 60,0±11,7 года).
У всех пациентов оценивали данные анамнеза, клиническую картину заболевания (наличие стенокардии, признаки недостаточности кровообращения — НК, определяли офисное артериальное давление — АД). При выполнении стандартной ЭКГ оценивали вольтажные критерии ГЛЖ (индекс Соколова—Лайона), глубину депрессии сегмента ST в левых грудных отведениях. Оценивали следующие эхокардиографические показатели: толщину миокарда задней стенки (ТЗС) левого желудочка и ТМЖП, конечный систолический размер и конечный диастолический размер левого желудочка (ЛЖ), величину левого предсердия и правого желудочка, наличие обструкции выносящего тракта ЛЖ. Индекс ММЛЖ рассчитывали как отношение ММЛЖ, определенной по Simpson, к площади поверхности тела.
Изучение генетических маркеров гипертрофии миокарда проведено у всех пациентов. Исследовали полиморфизм А/С гена рецептора АТII1 (АТР1). Выделение ДНК проводили из лейкоцитов периферической крови стандартными методами. Амплификацию полиморфного участка изучаемых генов осуществляли методом полимеразной цепной реакции. Полиморфизм A/C гена ATR1 изучали путем рестрикции амплифицированного участка ДНК эндонуклеазой с последующим электрофорезом на агарозном геле.
Статистический анализ полученных данных выполняли с помощью пакета программ Statistica 6.0 for Windows. Сравнение групп по количественным признакам проводили с использованием t-критерия Стьюдента с раздельными оценками дисперсий. Сравнение групп с распределением признаков, отличным от нормального (НК, степень депрессии сегмента ST, ТЗС, коэффициент асимметрии, количество экстрасистол и пробежек желудочковой и наджелудочковой тахикардии), осуществляли с помощью U-критерия Манна—Уитни. Сравнение распределения качественных признаков в обследованных группах проводили с использованием точного критерия Фишера. Различия считали статистически значимыми при p<0,05. Данные представлены в виде M±SD или Me (-95% ДИ;+95% ДИ).
Результаты и обсуждение
Отягощенный семейный анамнез отмечен у 62,4% больных 1-й группы (25,7% — ГКМП, 22,9% — ГБ, 14,3% —ГБ+ГЛЖ) и у 37,8% больных 2-й группы (21,6% — ГБ и 16,2% ГБ+ГЛЖ). Распределение генотипов в исследованных группах представлено в табл. 1. При сравнительном анализе частот распределения генотипов выявлено отсутствие достоверных различий между группами. Взаимосвязь клинических признаков и данных ЭКГ с полиморфизмом A/C гена ATR1представлена в табл. 2 и 3. При ГКМП отмечены более высокий функциональный класс НК (1,7±0,6 против 0,8±0,6; р<0,05) и большая выраженность ГЛЖ по данным ЭКГ (индекс Соколова—Лайона 35,2±16,6 мм против 20,9±16,5 мм; р<0,05). Кроме того, в этой группе прослежена тенденция к более раннему присоединению АГ и более высоким АД.
Таблица 1. Частота выявления генотипов ATR1 у больных с ГКМП и ГБ с ГЛЖ
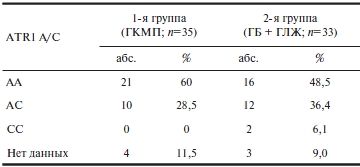
Примечание. ГКМП — гипертрофическая кардиомиопатия; ГБ — гипертоническая болезнь; ГЛЖ — гипертрофия левого желудочка.
Таблица 2. Ассоциация клинической картины и данных ЭКГ с полиморфизмом ATR1 A/C у больных с ГКМП (n=35)
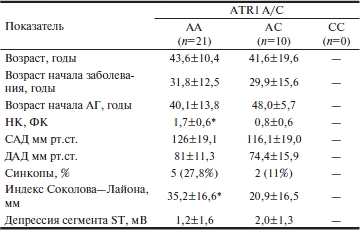
Примечание. ЭКГ — электрокардиография; ГКМП — гипертрофическая кардиомиопатия; здесь и в табл. 3: АГ — артериальная гипертония; НК — недостаточность кровообращения; ФК — функциональный класс; САД — систолическое артериальное давление; ДАД — диастолическое артериальное давление.*— p<0,05 для различий между генотипами АА и АС.
Таблица 3. Ассоциация клинической картины и данных ЭКГ с полиморфизмом ATR1 A/C у больных с ГБ+ГЛЖ (n=333)
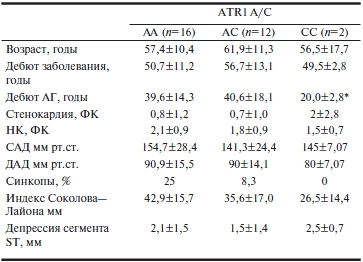
Примечание. * — р<0,005 для отличия от генотипов АА и АС.
Частота сопутствующей АГ у больных ГКМП с генотипом АА составляла 68,4%, а при генотипе A/C 3 20% (p<0,05), т.е. существует ассоциация генотипа АА гена ATR1 с присоединением АГ при ГКМП. В то же время у больных ГБ, имевших генотип СС, отмечено достоверно более раннее начало АГ (20±2,8 года против 39,6±14,3 года при генотипе АА и 40,6±18,1 года при генотипе АС; р<0,05). Этот генотип не встречался у больных ГКМП и, по данным ряда исследований, ассоциируется с развитием АГ в молодом возрасте [12, 13].
Среди пациентов с ГКМП достоверных различий между носителями полиморфизмов АА и АС не обнаружено. Обструкция выносящего тракта ЛЖ выявлена у 8 (43%) больных с генотипом АА и у одного (10%) с генотипом АС (р=0,007). У больных с ГБ+ГЛЖ влияние данного полиморфизма на эхокардиографические показатели оказалось более выраженным (табл. 4). Обращает внимание достоверное различие размеров левого предсердия между генотипами ААи СС (4,7±0,5 см против 4,4±0,07 см соответственно; p<0,05) и правого желудочка (2,8±0,5 см против 2,6±0,07 соответственно; p<0,05). ТМЖП у гетерозигот была достоверно меньше, чем у гомозигот АА(1,8±0,2 смАС против 2,1±0,4 см АА; p<0,05).
Таблица 4. Эхокардиографические показатели и полиморфизм A/C гена ATR1 при ГБ+ГЛЖ (n=33)
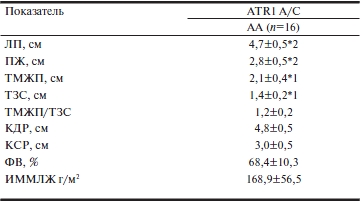
Примечание. ГБ — гипертоническая болезнь; ГЛЖ — гипертрофия левого желудочка; ЛП — левое предсердие; ПЖ — правый желудочек; ТМЖП — толщина межжелудочковой перегородки; ТЗС — толщина задней стенки левого желудочка; КДР — конечный диастолический размер; КСР — конечный систолический размер; ФВ — фракция выброса; ИММЛЖ — индекс массы миокарда левого желудочка. * — p<0,05; 1 — разница с АС; 2 — разница с СС.
Сопоставление клинико-морфологических показателей больных ГКМП и ГБ с ГЛЖ — носителей различных вариантов гена ATR1 позволило выявить следующие закономерности. Полиморфизм генов, влияющий на тяжесть клинических проявлений, в том числе обструкцию выносящего тракта ЛЖ, не ассоциируется с выраженностью собственно ГЛЖ. При этом необходимо принять во внимание отсутствие четкой зависимости тяжести клинического течения и прогноза ГКМП от степени увеличения ММЛЖ или ТМЖП [13]. Вероятно, разные патогенетические факторы влияют на разные проявления заболевания. В то же время мы получили еще одно подтверждение различного патогенеза этих нозологий. Полиморфизм A/C гена ATR1, а, следовательно, сам рецептор ангиотензина II играет роль в развитии обоих заболеваний. Вероятно, ответ на терапию блокаторами ангиотензиновых рецепторов при ГКМП в большей степени будет проявляться в улучшении клинического течения заболевания и в меньшем в регрессе ГЛЖ.
Несмотря на то что роль генетических модифицирующих факторов в процессе ремоделирования миокарда несомненна, имеющиеся данные об их связи с клиническими фенотипами носят противоречивый характер. Возможно, это связано с тем, что исследуемые заболевания носят полигенный характер или проявляются при сочетании генетических и средовых факторов. Многие авторы отмечают, что при интерпретации данных следует иметь в виду возможность различий в распределении аллелей в разных популяциях [11]. Важно также то, что в большинство исследований, в том числе наше, были включены больные, получающие антигипертензивную терапию, что само по себе могло существенно сказаться на распространенности ГЛЖ и маскировать роль генетических детерминант в ее развитии.
Выводы
При гипертрофической кардиомиопатии тип АА гена ATR1 ассоциируется с присоединением артериальной гипертонии, наличием обструкции выносящего тракта левого желудочка, с большей частотой желудочковых нарушений ритма, с большей выраженностью недостаточности кровообращения. При сочетании гипертонической болезни с гипертрофией левого желудочка тип АА гена ATR1 ассоциируется с более выраженной гипертрофией левого желудочка.



