У пациентов, перенесших острый инфаркт миокарда (ОИМ), потеря участка сердечной мышцы инициирует изменение размеров, геометрии и функции сердца, в первую очередь левого желудочка (ЛЖ). Эти процессы, обычно обозначаемые термином «постинфарктное ремоделирование» [1—4], являются изначально компенсаторными и у ряда пациентов параметры ЛЖ вскоре стабилизируются, что сопровождается достаточно благоприятным прогнозом. Вместе с тем у других больных постинфарктное ремоделирование становится дезадаптивным, сопровождаясь гемодинамически невыгодным, чрезмерно выраженным и/или прогрессирующим увеличением диастолического и систолического объемов и снижением глобальной сократимости ЛЖ [5]. В случае такого неблагоприятного течения постинфарктного ремоделирования повышается риск кардиальной смерти, повторного ОИМ, эмболического инсульта, развития застойной сердечной недостаточности [6—9]. В связи с этим оценка риска неблагоприятного ремоделирования представляется одной из важных задач обследования пациента, перенесшего ОИМ. Если такой риск существует, то особенно актуально решение вопроса о целесообразности коронарной реваскуляризации, необходима более агрессивная медикаментозная терапия, способная препятствовать дезадаптивному ремоделированию [10—12]. Несмотря на то, что исследования корреляций показателей острого периода инфаркта с течением постинфарктного ремоделирования выполнялись не один раз [13—15], прогнозирование характера ремоделирования ЛЖ после ОИМ, тем не менее, регулярно не проводится, а общепринятых алгоритмов для него не существует [16]. В связи с этим разработка критериев прогноза неблагоприятного ремоделирования ЛЖ на основании анализа показателей, доступных клиницисту в остром периоде инфаркта миокарда, представляет значительный интерес.
Материал и методы
В исследование включали пациентов, поступавших в Покровскую больницу Санкт-Петербурга в период с 2003 по 2006 г. с ОИМ с подъемом сегмента ST на электрокардиограмме (ЭКГ) и давностью эпизода ишемической боли в грудной клетке не более 12 ч, которым планировалось проведение тромболизиса. Критериями исключения были: 1) наличие противопоказаний к системному тромболизису [17]; 2) полная блокада левой ножки пучка Гиса на ЭКГ; 3) кардиогенный шок; 4) гемодинамически значимые клапанные пороки; 5) неудовлетворительное качество изображения при эхокардиографии (ЭхоКГ). В качестве тромболитического средства использовали алтеплазу и стрептокиназу в стандартных режимах. Выбор осуществлял лечащий врач с учетом имеющихся рекомендаций. Помимо тромболизиса всем больным проводили медикаментозную терапию в соответствии со стандартами, опубликованными на момент выполнения исследования [17]. Наблюдение продолжалось в течение 12 мес после ОИМ. Пациентов, перенесших коронарную реваскуляризацию, потерянных для контакта и умерших из наблюдения исключали.
При поступлении оценивали клинические показатели и основные (согласованные) факторы риска развития сердечно-сосудистых осложнений. ЭКГ регистрировали перед началом и через 3 ч после тромболизиса (ЭКГ-1 и ЭКГ-2 соответственно). Определяли максимальную активность креатинкиназы (КKmax) и ее фракции МВ (МВmax) в венозной крови в течение первых суток: анализ выполняли до начала тромболизиса и еще 4 раза с 6-часовыми интервалами.
ЭхоКГ выполняли на приборах Sonoline G60S (Siemens, Германия) и Vivid-3 Expert (GE HC, США). Исследования проводили до тромболизиса, при выписке (8,8±0,2 сут от поступления), через 6 и 12 мес после ОИМ (ЭхоКГ-1, ЭхоКГ-2, ЭхоКГ-6 и ЭхоКГ-12, соответственно). Протокол ЭхоКГ включал: 1) выполнение стандартных измерений в М-, В- и D-режимах; 2) 4-балльную оценку локальной сократимости ЛЖ по 16 сегментам [18] и расчет индекса локальной сократимости (ИЛС) по формуле (сумма баллов, присвоенных сегментам) / 16; 3) при ЭхоКГ-2 выполняли тканевое допплеровское исследование (ТДИ) в импульсноволновом режиме [19, 20]. Продольные скорости движения 12 базальных и срединных сегментов миокарда ЛЖ записывали и затем оценивали в режиме off-line. Измеряли максимальные систолические (Sm) и диастолические (Em) скорости всех сегментов. Скорости суммировали отдельно для непораженного миокарда и для сегментов с нарушенной сократимостью, затем рассчитывали индексы этих суммарных скоростей, т.е. их отношение к числу сегментов с нарушенной сократимостью. Аналогичным способом подсчитывали индекс числа сегментов с нарушенной сократимостью, в которых регистрировался положительный пик изоволюметрического сокращения (IVC).
В ходе наблюдения была исследована динамика важнейших показателей, связанных с ремоделированием ЛЖ, а именно, его конечного диастолического объема (КДО), конечного систолического объема (КСО) и фракции выброса (ФВ) ЛЖ. Критериями неблагоприятного ремоделирования, с точки зрения изменений КДО ЛЖ, служили его увеличение через 12 мес более чем на 20% по сравнению с исходным и/или прогрессирующее увеличение в динамике при ЭхоКГ-6 и ЭхоКГ-12. К группе неблагоприятной динамики КСО были отнесены пациенты, у которых этот показатель через 12 мес составлял 35 мл/м2 и более. Наконец, критерием неблагоприятных изменений ФВ ЛЖ через 12 мес после ОИМ было ее значение ≤40% [14, 21, 22].
Статистический анализ данных проводили с помощью программ Statistica 6.0 (StatSoft, Inc. 1984-2001) и SAS 8.2 (SAS Institutes Inc., Cary, NC). Значения непрерывных переменных представлены как среднее ± стандартная ошибка среднего. Сравнение средних значений переменных между двумя группами проводили с помощью теста Стьюдента. Выявление независимых влияний на исход ремоделирования среди переменных, продемонстрировавших достоверные различия между группами, выполняли с помощью логистической регрессии. Степень влияния предиктора выражали в виде отношения шансов (ОШ) с указанием 95% доверительного интервала (ДИ). Достоверными считали различия при p<0,05. Поиск «точек разделения» для найденных независимых предикторов осуществляли с помощью функции «регрессионного дерева» (C&RT) программы Statistica.
Для оценки (в баллах) риска неблагоприятного ремоделирования использовали расчет отношения правдоподобия (ОП) для наличия и отсутствия каждого предиктора (ОП+ и ОП– соответственно) (см. табл. 4) [23]. В целях облегчения использования во втором и третьем столбцах табл. 4 они представлены в форме десятичных логарифмов (lgОП+) и (lgОП–). Показатель послетестового ОШ, используемый для расчета вероятности неблагоприятного ремоделирования (см. табл. 5), вычисляли исходя из предтестового ОШ развития неблагоприятного ремоделирования, равного 0,25 [5].
Таблица 4. Данные для оценки риска (в баллах) на основании анализа предикторов ремоделирования
Примечание. ЭхоКГ — эхокардиография; ind-ΣЕm sokr — индекс суммарной скорости непораженного миокарда; ind-IVC — индекс изоволюмического сокращения.
Таблица 5. Расчет вероятности неблагоприятного ремоделирования на основании оценки риска (в баллах)
Результаты и обсуждение
Общая характеристика пациентов. В исследование были включены 187 пациентов (146 мужчин и 41 женщина), средний возраст которых составлял 59±1 год (от 35 до 80 лет). У 60 (32%) пациентов в анамнезе имелась стенокардия напряжения длительностью более 1 мес. У 24 (13%) пациентов настоящий ОИМ был повторным. На момент поступления 153 (82%) пациента были отнесены к I классу по Killip. У 165 (88%) больных был диагностирован ИМ c зубцом Q, у 118 (63%) — передний инфаркт миокарда. У 166 (89%) пациентов системный тромболизис был выполнен алтеплазой, у 21 — стрептокиназой. Период от начала болей в грудной клетке до начала реперфузии составлял 224±6 мин (20—555 мин).
Увеличения исходных объемов ЛЖ у обследованных больных не наблюдалось: КДО составил 57,0±0,8 мл/м2 у мужчин и 55,8±1,7 мл/м2 у женщин; КСО соответственно — 30,0±0,7 мл/м2 (верхняя граница нормы) и 26,1±1,8 мл/м2 [24]. Показатель ИЛС, отражающий размер зоны сократительной дисфункции ЛЖ, был существенно увеличен (1,75±0,03). Исходное снижение показателей глобальной сократимости было умеренным: средняя ФВ ЛЖ составляла 49,4±0,9% (22,6—73,4%), митрально-септальная сепарация (EPSS) — 9,6±0,4 мм.
В связи с исключением из наблюдения ряда пациентов (см. выше) анализ факторов, влияющих на 12-месячную динамику КДО, был выполнен у 102 пациентов, анализ динамики КСО и ФВ — у 115. Анализ прогностического значения тканевых допплеровских параметров был выполнен у 55 из обследованных больных.
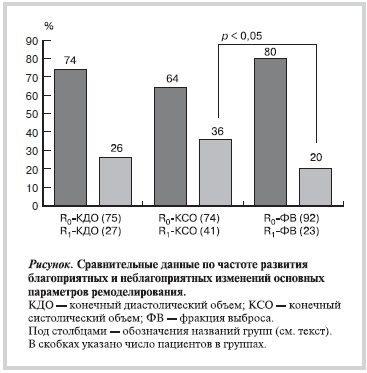
Варианты изменений важнейших параметров ЛЖ в пост инфарктном периоде. Характер изменений КДО ЛЖ. Через год после ОИМ увеличение КДО <20% наблюдалось у 75 больных (группа R0-КДО). У 11 из них в течение первого полугодия, а у 8 — в течение второго полугодия наблюдалось увеличение КДО >10%. Пациентов с неблагоприятным вариантом динамики КДО было 27 (26%, группа R1-КДО). У 12 из них увеличение ЛЖ в основном происходило в течение первого полугодия, и лишь у 2 — в течение второго. У 13 больных увеличение КДО было прогрессирующим, т.е. происходило в течение обоих полугодий.
Характер изменений КСО ЛЖ. Группу R0-КСО составили 74 пациента, у которых КCО через 12 мес был меньше 35 мл/м2. Неблагоприятная динамика КСО (группа R1-КСО) наблюдалась у 41 пациента. Число пациентов, соответствующих критерию неблагоприятного прогноза на основании величины КСО при ЭхоКГ-12 (41 из 115; 36%), было достоверно больше, чем при исходной ЭхоКГ-1 (27 из 125; 22%; р=0,015).
Динамика ФВ ЛЖ. В конце наблюдения пациенты были разделены на группы R0-ФВ (ФВ>40%, благоприятная динамика; n=92) и R1-ФВ (ФВ≤40%, неблагоприятный прогноз; n=23). Характер изменений ФВ ЛЖ в постинфарктном периоде был различным: у 49 пациентов отмечалось ее увеличение >5%, у 38 — уменьшение >5%, у 12 ФВ осталась в пределах ±5% от исходной. Такие разнонаправленные изменения ФВ после ОИМ отмечались и ранее — ее улучшение, в частности, связывают с наличием жизнеспособного миокарда [25]. В результате в группу R1-ФВ вошли 19 пациентов с исходной ФВ >40%, а в группу R0-ФВ — 15 больных с исходной ФВ ≤40%. Таким образом, группы, соответствующие критерию неблагоприятного прогноза на основании ФВ ЛЖ исходно и через год, были не сопоставимы.
Прогностически неблагоприятные изменения ФВ наблюдались реже, чем других параметров ЛЖ, — КДО (27 из 102) и КСО (41 из 115; p<0,05) (см. рисунок). Чаще всего отмечалась отрицательная динамика КСО ЛЖ. Отметим также, что изучение показателей объема и функции ЛЖ через год после ОИМ давало новую существенную прогностическую информацию по сравнению с результатами оценки этих же показателей в остром периоде.
Взаимосвязь показателей острого периода инфаркта миокарда и характера ремоделирования ЛЖ. Клинические показатели в целом продемонстрировали невысокую прогностическую ценность. Следует отметить достоверно большую частоту сердечных сокращений при поступлении в группе R1-КСО (81±2 против 75±1 уд/мин у больных группы R0-КСО; p<0,05). Кроме того, в группе R1-ФВ по сравнению с группой R0-ФВ было больше пациентов с ОИМ в анамнезе: 22 и 6% соответственно (р=0,015). В отношении приема препаратов основных классов, способных влиять на процессы ремоделирования, достоверных различий между группами благоприятных и неблагоприятных изменений каждого из показателей не было.
Кардиоспецифичные маркеры. В качестве ферментных предикторов ремоделирования изучали максимальную активность креатинкиназы (КК) и ее фракции МВ. Несмотря на недостаточную кардиоспецифичность первой, ее использование с прогностической целью практиковалось достаточно широко, и у пациентов с ОИМ, верифицированным с помощью других методик, представлялось оправданным. Неблагоприятные изменения всех трех исследуемых параметров ремоделирования служили предикторами более высоких уровней обоих кардиоспецифичных ферментов (табл. 1).
Таблица 1. Максимальная активность кардиоспецифичных ферментов в группах благоприятной и неблагоприятной динамики КДО, КСО и ФВ ЛЖ
Примечание. * — p<0,05 по сравнению с соответствующей группой R0. КДО — конечный диастолический объем; КСО — конечный систолический объем; ФВ — фракция выброса; ЛЖ — левый желудочек; КК — креатинкиназа; МВ — фракция МВ креатинкиназы.
Оптимальные для разделения по прогнозу пороговые уровни обоих ферментов и их прогностическая ценность в отношении каждого из показателей ремоделирования представлены в табл. 3. Наибольшие уровни КKmax (и размеры инфаркта) были необходимы для развития неблагоприятных изменений КДО.
Таблица 3. Прогностическая ценность предикторов неблагоприятного ремоделирования
Примечание. Здесь и в табл. 4: ИЛС — индекс локальной сократимости; EPSS — митрально-септальная сепарация.
Электрокардиографические показатели. Неблагоприятное ремоделирование отмечалось при выявлении на ЭКГ признаков более обширного поражения ЛЖ (табл. 2).
Таблица 2. Электрокардиографические показатели в группах благоприятной и неблагоприятной динамики КДО, КСО и ФВ ЛЖ
Примечание. STmax — мaксимальный подъем сегмента SТ по одному отведению; STsum —суммарный подъем сегмента SТ; * — p<0,05 по сравнению с группой R0-КДО; ** — p<0,05 по сравнению с группой R0-КСО; § — p<0,05 по сравнению с группой R0-ФВ; здесь и в табл. 3, 4: КДО — конечный диастолический объем; КСО — конечный систолический объем; ФВ — фракция выброса; ЛЖ — левый желудочек; ЭКГ — электрокардиограмма.
С помощью логистической регрессии были найдены важнейшие среди указанных показателей. Наибольшее влияние на постинфарктную динамику КДО оказывала величина максимального подъема сегмента ST до реперфузии (STmax на ЭКГ-1, ОШ 1,73 при 95% ДИ от 1,05 до 2,86). КСО и ФВ в наибольшей степени зависели от постреперфузионных показателей ЭКГ — числа отведений с зубцом Q (ОШ 1,68 при 95% ДИ от 1,02 до 2,77) и суммарного подъема сегмента ST (ОШ 1,13 при 95% ДИ от 1,01 до 1,27) на ЭКГ-2. Для всех показателей были определены оптимальные разделяющие значения и рассчитана прогностическая ценность полученных предикторов (табл. 3).
Подъем сегмента ST на исходной ЭКГ отражает размер зоны ЛЖ «под угрозой», а на постреперфузионной ЭКГ характеризует эффективность реперфузии [26], поэтому связь этих показателей с исходом ремоделирования не удивительна. Большое число отведений с патологическим зубцом Q указывает на распространенный инфаркт с низкой вероятностью жизнеспособности в зоне повреждения [27]. Развитие неблагоприятного ремоделирования у такого пациента представляется вполне закономерным.
Эхокардиографические показатели. Наибольшее число достоверных различий между группами благоприятного и неблагоприятного ремоделирования было продемонстрировано в отношении показателей ЭхоКГ. Для выявления важнейших предикторов ремоделирования проводили регрессионный анализ. На неблагоприятную динамику диастолического и систолического объемов ЛЖ независимо влияли одни и те же показатели — исходный ИЛС, а также величины КДО и КСО при выписке.
Наиболее мощным прогностическим фактором оказался ИЛС при ЭхоКГ-1 в отношении динамики КСО (ОШ 33,5 при 95% ДИ от 3,62 до 308,9). Это согласуется с результатами J.E. Moller и соавт. [28], показавшими превосходство ИЛС над ФВ в прогнозировании кардиальных исходов ОИМ. При выписке ИЛС имел меньшее прогностическое значение. Действительно, ИЛС после реперфузии может быть одинаковым как при необратимом повреждении, так и при наличии жизнеспособного миокарда в инфарктной зоне. Между тем прогноз ремоделирования в этих двух случаях будет различным [29], чем, вероятно, объясняется полученный результат.
Для всех показателей были найдены пороговые значения, указывавшие на высокую вероятность неблагоприятного ремоделирования. Полученные эхокардиографические предикторы ремоделирования продемонстрировали наибольшую прогностическую ценность (см. табл. 3). Согласно представленным данным негативные изменения КСО по сравнению с изменениями КДО происходили при меньшей площади инфаркта и меньших исходных объемах ЛЖ — закономерность, отмечавшаяся и при анализе кардиоспецифичных маркеров.
Независимое влияние исходных объемов ЛЖ, а также исходной ФВ на значение ФВ в конце периода наблюдения не выявлены. Конечная ФВ была связана с величиной зоны поражения (ИЛС, ОШ 24,92 при 95% ДИ от 2,97 до 208,96) и показателем EPSS, относящимися к острому периоду инфаркта (ОШ 1,36 при 95% ДИ от 1,07 до 1,73). Полученные предикторы приведены в табл. 3.
Показатели тканевого допплеровского исследования в нашей работе продемонстрировали наибольшее влияние на динамику КСО ЛЖ — по-видимому, наиболее «чувствительного» среди изучавшихся параметров ремоделирования. По показателям, способным влиять на результаты ТДИ [30] — локализация поражения и возраст пациентов — группы R0-КСО и R1-КСО были сопоставимы.
Независимая связь с динамикой КСО ЛЖ было выявлено для двух показателей — индекса изоволюметрического сокращения зоны дисфункции (ind-IVC, ОШ 0,045 при 95% ДИ от 0,002 до 0,822) и индекса суммарной скорости Em непораженного миокарда (ind-ΣЕm sokr, ОШ 0,867 при 95% ДИ от 0,789 до 0,953). Отметим, что оба индекса не являются стандартными показателями ТДИ. Они были введены, чтобы обеспечить корректное сравнение между пациентами с разным количеством нефункционирующих сегментов. Чувствительность и специфичность показателя ind-IVC ≤0,31 в прогнозировании неблагоприятной динамики КСО составили 68%, показателя ind-ΣЕm sokr ≤16 см/с — 75 и 78% соответственно.
Таким образом, ТДИ показало более благоприятное течение ремоделирования в случае регистрации положительного пика IVC в зоне дисфункции, который рассматривается в качестве маркера жизнеспособного миокарда [27]. Кроме того, было показано, что диастолические скорости здоровых сегментов имеют более высокую, чем диастолические скорости миокарда в зоне дисфункции, значимость для прогноза ремоделирования. Это представляется особенно интересным с учетом роли в процессе ремоделирования изменений неповрежденного миокарда [1].
Прогнозирование характера ремоделирования ЛЖ в целом на основании анализа выявленных предикторов. Как показал проведенный анализ, предикторы неблагоприятной динамики КДО, КСО и ФВ ЛЖ через 12 мес оказались сходными, что, очевидно, указывает на значительное сходство прогнозируемых исходов. Действительно, известно отрицательное влияние всех трех рассматриваемых вариантов изменений ЛЖ на кардиальный прогноз. В связи с этим мы составили алгоритм, позволяющий прогнозировать наступление любого из рассмотренных неблагоприятных вариантов ремоделирования ЛЖ. Для расчета были использованы наиболее диагностически ценные предикторы (табл. 4, 5).
Пользуясь табл. 4, можно рассчитать оценку риска (в баллах) для конкретного пациента, выбрав соответствующие значения столбца 2 при наличии предиктора и столбца 3 в его отсутствие, и суммировав выбранные значения. В табл. 5 представлены вероятности неблагоприятного ремоделирования в целом, соответствующие различным оценкам риска (в баллах). Поскольку при оценках риска меньше 0 вероятность неблагоприятного ремоделирования была чрезвычайно мала (<20%), а при оценках более 2,0 балла превышала 96%, практический смысл имел расчет вероятности неблагоприятного ремоделирования в диапазоне оценок риска от 0 до 2,0 балла, которые и представлены в табл. 5. Отметим, что для конечного расчета можно использовать любое количество предикторов в зависимости от того, какие из них удалось оценить.
Заключение
Избыточное постинфарктное увеличение конечного систолического объема — наиболее частый вариант изменений левого желудочка, связанных с неблагоприятным ремоделированием; он наблюдается при наименьшей степени изменения показателей-предикторов. Фракция выброса левого желудочка после острого инфаркта миокарда может претерпевать разнонаправленные изменения, в связи с чем ее оценка в остром периоде с прогностической целью недостаточно надежна.
Анализ ряда ферментных, электрокардиографических и, в первую очередь, эхокардиографических показателей острого периода инфаркта миокарда позволяет прогнозировать характер постинфарктного ремоделирования. Предикторы на основе тканевого допплеровского исследования также обладают достаточно высокой ценностью. Созданный на основе полученных показателей алгоритм прогноза может способствовать оптимизации тактики ведения больных, перенесших инфаркт миокарда.



