Ишемическая болезнь сердца (ИБС) продолжает оставаться основной причиной смерти населения в экономически развитых странах, несмотря на достижения современной медицины. По развитию инвалидности болезни сердца стоят на пятом месте среди всех заболеваний и к 2020 г. могут выйти на первое место. Особенно значима данная проблема для России, где заболеваемость и смертность от ИБС среди трудоспособного населения в несколько раз выше, чем в экономически развитых странах [1]. У больных сахарным диабетом (СД) ИБС развивается в 2—4 раза чаще, а прогноз жизни хуже, чем у пациентов без СД [2]. В 40% случаев ИБС служит основной причиной смерти больных СД [3]. Атеросклеротическое поражение сосудов при СД часто носит диффузный характер, что затрудняет проведение процедур по реваскуляризации. Одной из причин худшего прогноза при СД является дисфункция миокарда, ведущая к застойной сердечной недостаточности. Причинами диабетической кардиомиопатии могут быть также свойственные этой группе больных артериальная гипертензия (АГ), хроническая гипергликемия, микроангиопатия, гликозилирование миокардиальных белков, автономная невропатия [4]. У большинства больных СД 2-го типа имеется инсулинорезистентность, которая индуцирует ряд метаболических отклонений — атерогенную дислипидемию, АГ, протромботические изменения. Больные с инсулинорезистентностью подвержены изменениям коагуляционного каскада, предрасполагающим к артериальным тромбозам. У них повышен уровень фибриногена [5], ингибитора-1 активатора плазминогена [6], имеются различные изменения тромбоцитов, такие как усиление адгезии и агрегации, уменьшение выживаемости, уменьшение образования в тромбоцитах простациклина [7]. Современные медикаментозные средства позволяют эффективно контролировать гликемию и снижать частоту развития микрососудистых осложнений. К сожалению, в отношении влияния медикаментозного лечения на развитие макрососудистых осложнений пока не получено достоверных результатов [8].
В связи с высокими распространенностью СД среди населения и смертностью больных, связанной с сердечно-сосудистой патологией, представляет интерес изучение различных подходов к лечению ИБС в сочетании с СД. Хирургическое вмешательство значительно улучшает качество и прогноз жизни у больных ИБС [9]. Основным методом хирургического лечения ввиду многососудистого характера поражения является коронарное шунтирование (КШ). Оно выполняется уже более 50 лет. По данным рандомизированного исследования BARI, среди больных, направленных на КШ, значительное число составляют пациенты с СД. По данным российских клиник, доля пациентов с СД составляет 15—30% от общего числа перенесших КШ и имеет тенденцию к дальнейшему росту [1]. По данным исследования, проведенного в США в 2010 г., среди прооперированных по поводу ИБС доля больных СД составила 40% [10]. Было выявлено неблагоприятное влияние СД на отдаленный прогноз у пациентов, перенесших открытое вмешательство на сердце [11]. Это заставляет исследователей разрабатывать и внедрять новые подходы к технике выполнения КШ, методы, позволяющие предотвратить осложнения в послеоперационном периоде. При диффузном атеросклерозе коронарного русла и поражении дистальных отделов коронарных артерий (КА) полная реваскуляризация миокарда без процедуры коронарной эндартерэктомии (ЭАЭ) бывает невозможна.
Так как число пациентов с диффузным поражением КА и СД 2-го типа неуклонно растет, изучение ближайших и отдаленных результатов реваскуляризации миокарда у больных ИБС и СД является актуальным в настоящее время.
Цель исследования — оценка результатов КШ в сочетании с коронарной ЭАЭ у больных ИБС и СД и влияния СД на исходы.
Материал и методы
В период с 2003 по 2010 г. в кардиохирургическом отделении №2 ГБУЗ «Краевая клиническая больница №1 им. проф. С.В. Очаповского» оперированы более 8200 больных ИБС. У 152 пациентов выполнено КШ в сочетании с ЭАЭ из передней нисходящей артерии (ПНА), из них у 43 (28,2%) имелся сопутствующий СД. Эти пациенты составили основную (1-ю) группу исследования, в то время как оставшиеся 109 (71,7%) больных вошли во 2-ю (контрольную) группу. Характер течения СД определял эндокринолог, исходя из данных объективного обследования, результатов определения суточного гликемического профиля. По результатам обследования решался вопрос о необходимости назначения инсулинотерапии либо других сахароснижающих препаратов. СД считали компенсированным, если уровень глюкозы в крови натощак был менее 6,7 ммоль/л, а через 2 ч после еды — менее 9 ммоль/л; субкомпенсированным при уровне глюкозы в крови натощак 6,8—7,8 ммоль/л, а через 2 ч после еды — 9—10 ммоль/л. В послеоперационном периоде контроль гликемии осуществляли дробным внутривенным, а затем подкожным введением инсулинов короткой продолжительности действия. После перевода в палату коррекцию гликемии проводил эндокринолог согласно результатам суточного профиля глюкозы. В послеоперационном периоде всем больным назначали эноксапарин натрий в дозе 40 мг один раз в сутки до удаления дренажей. После удаления дренажей назначали клопидогрел по 75 мг в течение 6 мес, а также ацетилсалициловую кислоту постоянно.
Результаты операции оценивали в ближайшем (до 30 дней) и отдаленном периодах после операции. Все операции выполняли стандартно. Доступ осуществляли посредством срединной стернотомии. Подключение аппарата искусственного кровообращения (ИК) осуществляли по схеме аорта — правое предсердие. Основной этап происходил в условиях умеренной гипотермии 32 °С и фармакохолодовой кардио-плегии раствором кустодиола. Длительность ИК (в группе ИБС и СД 99,0±38,2 мин; ИБС без СД 98,0±27,8 мин) и длительность ишемии миокарда (67,0±24,5 и 69,0±20,9 мин соответственно) не различались. В отдаленном периоде (в среднем 4,6±1,2 года) удалось оценить результаты лечения у 127 (87,6%) больных.
Статистический анализ данных проводили с помощью программ Statistica 6.0 (StatSoft, США). Обработку результатов исследования выполняли методами параметрической и непараметрической статистики. Характер распределения данных оценивали с помощью критерия Колмогорова—Смирнова и Шапиро—Уилкса. Для сравнения групп использовали t-критерий Стьюдента (в случае нормального распределения значений признака) и критерий Колмогорова—Смирнова (при распределении, отличном от нормального). Различия показателей считали статистически значимыми при p<0,05.
Результаты
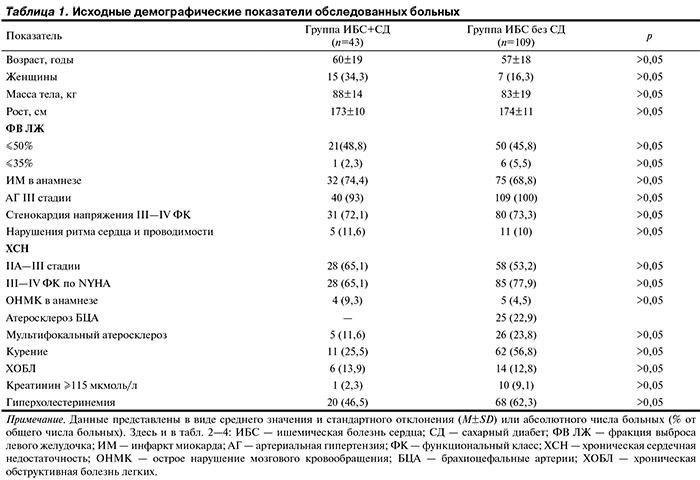
Группы были сопоставимы по основным характеристикам. Возрастной и половой параметры статистически значимо не различались. У всех больных имелись клинические признаки стенокардии напряжения высокого функционального класса. У большинства пациентов имелась избыточная масса тела, большинство страдали АГ, мультифокальным атеросклерозом. Общая характеристика больных представлена в табл. 1.
Больные СД 2-го типа имели более тяжелый предоперационный статус, трехсосудистое поражение выявлено у 74,4% пациентов, а в группе изолированной ИБС — у 63,3%.
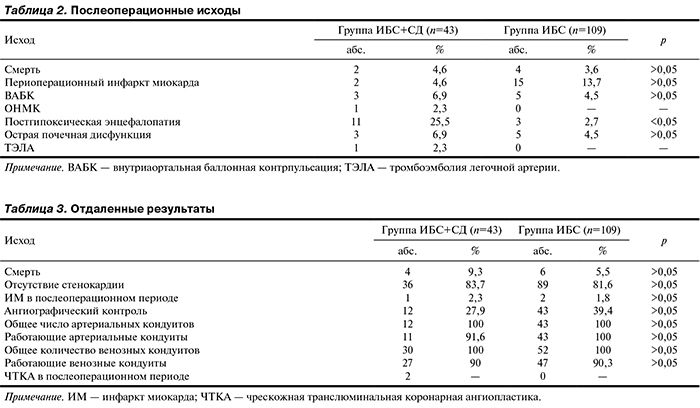
В ближайшем (до 30 дней) периоде после операции в группе ИБС и СД наблюдались 2 (4,6%) летальных исхода. В одном случае причиной смерти была острая левожелудочковая недостаточность. Больной до операции страдал нестабильной стенокардией с признаками ишемической кардиомиопатии, диабетической нефропатии и хронической почечной недостаточности. При аутопсии выявлен перенесенный инфаркт миокарда (ИМ). Во втором случае причиной смерти стала массивная тромбоэмболия легочной артерии на 16-е сутки после операции. У данного больного послеоперационный период протекал гладко. Однако на 16-е сутки возник пароксизм мерцательной аритмии с прогрессирующими явлениями гемодинамической нестабильности, приведший к остановке сердечной деятельности. В обоих случаях первично была отмечена декомпенсация углеводного обмена.
В группе изолированной ИБС 4 (3,6%) летальных исхода были следствием синдрома малого выброса, развившегося на фоне периоперационного ИМ (табл. 2).
В отдаленном периоде нам удалось отследить результат лечения 127 (87,6%) человек, 19 больных не являлись на контрольные осмотры в поликлинику. Средний период наблюдения составил 4,6±1,2 года, за этот период умерли 10 пациентов. Отдаленные результаты представлены в табл. 3.
Выживаемость в группе СД составила 90,7%, в группе ИБС — 94,5%. Коронарошунтографию выполнили 12 (27,9%) пациентам с СД и 43 (39,4%) без СД. Работающие артериальные кондуиты составили 91,6% в основной группе и 100% в контрольной группе, работающие венозные кондуиты — 90 и 90,3% соответственно. Клинически значимый рецидив стенокардии возник в группе с сопутствующим СД у 16,3 и 18,4% больных в контрольной группе, что связано с прогрессированием атеросклеротического процесса в ранее интактных КА. ИМ за исследуемый период перенесли 2,3% в группе ИБС и СД и 1,8% в группе ИБС без СД. Причиной было нарастание атеросклеротического поражения в нешунтированной правой КА. В группе СД 2-го типа больным выполнена чрескожная транслюминальная коронарная ангиопластика с имплантацией стентов.
Обсуждение
Хирургическое лечение значительно улучшает качество и прогноз жизни больных ИБС [9]. Основным методом хирургического лечения ИБС у больных СД ввиду многососудистого характера поражения является КШ. Оно позволяет в течение длительного времени обеспечивать адекватную перфузию миокарда через венозные и артериальные шунты.
Наше исследование показало, что больные ИБС и СД 2-го типа имеют более тяжелый предоперационный статус, чаще страдают трехсосудистым поражением КА (74,4 и 63,3% в основной группе и в группе контроля соответственно; p<0,05), с вовлечением дистальных сегментов КА. Кроме того, в группе ИБС с СД значительно чаще отмечены неврологические осложнения — 27,8% по сравнению с 2,7% в группе без СД. В связи с этим больные СД имеют менее благоприятный прогноз и после открытых операций на сердце. В исследовании B.J. Leavitt и соавт. (2004) 10-летняя выживаемость больных СД, перенесших КШ, составила 60%, что статистически значимо ниже аналогичного показателя у пациентов без СД — 75% [8]. По результатам нашего исследования, выживаемость в группе СД составила 90,7%, а в группе ИБС — 94,5% (р<0,05). По нашим данным, рецидив стенокардии после КШ зафиксирован у 18,4% больных изолированной ИБС и у 16,3% пациентов с сочетанным СД. Это может свидетельствовать об одинаковой эффективности реваскуляризации миокарда в сочетании с ЭАЭ у больных с СД и без него, что бесспорно свидетельствует о целесообразности реконструктивных операций на коронарном русле.
При диффузном атеросклерозе коронарного русла и поражении дистальных отделов КА полная реваскуляризация бывает невозможна. В этом случае предварительное выполнение ЭАЭ из пораженного участка КА с последующим ее шунтированием позволяет достичь более полной реваскуляризации. Однако, по данным различных авторов, в первый год после операции КШ наблюдается окклюзия 15—20% венозных шунтов, а в каждый последующий год дополнительно закрываются от 1 до 4% шунтов [12] и может возникнуть необходимость в повторной операции. В первую очередь в группе риска развития осложнений после операции КШ находятся больные с СД. По данным наших шунтографий, работающие артериальные кондуиты составили 91,6% в основной группе и 100% в контрольной группе, работающие венозные кондуиты — 90 и 90,3% соответственно.
Полученные нами данные позволяют сделать вывод, что прямая реваскуляризация миокарда в сочетании с ЭАЭ из КА может быть операцией выбора для лечения пациентов с диффузным атеросклеротическим поражением КА при СД. При этом важную роль играют грамотная предоперационная оценка и подготовка больных, внимательное послеоперационное ведение, тщательный контроль и коррекция гликемии и адекватная антитромботическая терапия.
Заключение
Сахарный диабет значительно ухудшает течение ишемической болезни сердца, особенно при многососудистом поражении коронарного русла. Больные сахарным диабетом имеют более тяжелый предоперационный статус и высокий риск развития послеоперационных осложнений. Однако при строгом контроле и коррекции гликемии коронарное шунтирование с эндартерэктомией из коронарных артерий у таких пациентов сопровождается приемлемыми показателями летальности, выживаемости, умеренным риском развития отдаленных сердечно-сосудистых осложнений, а также удовлетворительной работоспособностью шунтов. Операция прямой реваскуляризации миокарда в сочетании с эндартерэктомией и реконструкцией передней нисходящей артерии может быть рекомендована для лечения больных сахарным диабетом с диффузным атеросклеротическим поражением коронарных артерий.



