Старение населения происходит чрезвычайно быстро — ежедневно 1 млн человек в мире достигают 60-летнего возраста. Лица пенсионного возраста составляют пятую часть населения нашей страны и являются основным контингентом медицинских учреждений и социальных служб. С возрастом увеличивается частота развития многих заболеваний, в том числе угрожающих жизни, особенно сердечно-сосудистых заболеваний (ССЗ), что связано с особенностями образа жизни и факторами риска (курение, низкий уровень физической активности, избыточная масса тела, артериальная гипертензия — АГ и др.) [1]. Старение ассоциировано с развитием инволютивных изменений в организме, социально-психологической дезадаптацией, функциональными нарушениями и рядом клинических гериатрических синдромов.
В настоящее время недостаточно информации о связи гериатрических синдромов с традиционными факторами высокого риска развития сердечно-сосудистых осложнений (ССО). В частности, это касается основного гериатрического синдрома «frailty» — «хрупкость» (старческая астения, уязвимость), характеризующегося ассоциированным с возрастом снижением физиологического резерва и функций многих систем, что приводит к повышенной уязвимости, ограниченной способности отвечать на внешние и внутренние провоцирующие факторы, к негативным медицинским и функциональным исходам [2, 3].
Неблагоприятный прогноз преимущественно определяется наличием и тяжестью ССЗ, а в более старшей возрастной группе существенно возрастает и значение «хрупкости». Предотвращение «хрупкости» потенциально способно отсрочить до 5% случаев летального исхода у пациентов пожилого возраста [4, 5].
Изучение проблемы взаимосвязи «хрупкости» и риска развития ССО поможет разработать комплекс мер превентивного, лечебного и восстанавливающего характера у женщин старшей возрастной группы.
Цель исследования: определить распространенность некоторых гериатрических синдромов и их взаимосвязи с высоким риском развития ССО.
Материал и методы
В открытое проспективное исследование были включены 72 женщины в возрасте от 65 до 88 лет, медиана возраста 74 (69—77) года. Критерии включения в исследование: возраст 65 лет и старше, наличие ССЗ; отсутствие госпитализаций в течение предшествующих 3 мес по любой причине; согласие на добровольное участие в исследовании.
Критерии отказа от включения: психические заболевания или недееспособность; уровень образования менее среднего или среднего специального; наличие в анамнезе перенесенного нарушения мозгового кровообращения, острого инфаркта миокарда (ИМ), нестабильной стенокардии в течение 6 мес, предшествующих включению в исследование; наличие хронических заболеваний, воздействующих на метаболизм костной ткани: аутоиммунные и онкологические заболевания, миеломная болезнь и другие гематологические заболевания; тяжелая печеночная недостаточность, хроническая обструктивная болезнь легких, бронхиальная астма, ревматоидный артрит и другие заболевания, при которых требуется назначение системных или ингаляционных глюкокортикостероидных препаратов; заболевания опорно-двигательного аппарата с клинически значимыми нарушениями функции.
Исследование проводилось на базе кафедры поликлинической терапии №1 лечебного факультета ГБОУ ВПО РНИМУ им. Н.И. Пирогова — ГБУЗ «Диагностический клинический центр №1» ДЗ г. Москвы в период с ноября 2014 г. по май 2015 г. и соответствовало положениям Хельсинкской декларации.
У всех женщин, включенных в исследование, при опросе уделяли внимание состоянию костной системы: наличие остеопоретических переломов костей и диагноза остеопороза (ОП) в анамнезе; сведения о падениях в течение предшествующего года; переломе позвонков, шейки бедренной кости (ШБК) и лучевой кости.
Психоэмоциональный статус оценивали с помощью краткой шкалы оценки психического статуса Mini-mental State Examination (MMSE) [6], содержащего 30 вопросов. За правильный ответ начислялся 1 балл. Оценка 28—30 баллов свидетельствовала о нормальном когнитивном статусе, 26—27 баллов — о легком когнитивном нарушении, 24—25 — об умеренном когнитивном нарушении, 23 и менее — о выраженном когнитивном нарушении.
Способность к удержанию баланса оценивали при помощи теста на подъем со стула (ТПС) у 42 женщин [7]. Пациентка должна была 5 раз встать и сесть на стул обычной высоты без помощи рук (руки скрещены на уровне груди) с максимально возможной скоростью. При невозможности подняться и сесть 5 раз или выполнении теста более чем за 10 с пациентка рассматривалась как имеющая высокий риск нарушения двигательных функций.
Переносимость физической нагрузки определяли с помощью теста с 6-минутной ходьбой (ТШХ) [8].
Женщины с диагностированными ССЗ атеросклеротической природы (перенесенные ИМ, аортокоронарное шунтирование, периферический атеросклероз), сахарным диабетом при наличии микроальбуминурии и с хронической болезнью почек (ХБП) были отнесены в группу очень высокого риска развития ССО [1].
Наличие 3 из следующих показателей свидетельствовало о наличии синдрома «хрупкость»:
- беспричинное снижение массы тела;
- снижение функциональной активности (медленная скорость при ходьбе по результатам ТШХ);
- нарушение психоэмоционального статуса (оценка по MMSE 23 балла и менее);
- ТПС более 10 с;
- неоднократные локомоторные падения в анамнезе.
Всем женщинам проведено комплексное лабораторное обследование на базе клинико-диагностической лаборатории ГБУЗ «ДКЦ № 1» ДЗ г. Москвы. Скорость клубочковой фильтрации (СКФ) рассчитывали по формуле CKD-EPI [9]. Уровень 25-ОН витамина D определяли на иммунохимическом анализаторе Cobas 6000, иммунохимический модуль E 601 («Roche», Германия) по стандартной методике с использованием реагентов производителя.
 С целью определения плотности кости выполнено денситометрическое исследование методом двухэнергетической рентгеновской абсорбциометрии. Исследовали минеральную плотность костной ткани (МПКТ) в поясничном отделе позвоночника (LII—LIV) и ШБК. Костную массу оценивали по содержанию минералов на единицу площади костной ткани (в г/см2), а также от среднего показателя пиковой костной массы у молодых женщин (Т-критерий) в стандартных отклонениях (СО). Остеопенический синдром определяли в соответствии с рекомендациями Всемирной организации здравоохранения: Т-критерий в диапазоне от –1 до –2,4 СО расценивали как остеопению, Т-критерий ≤ –2,5 — как ОП. При установлении диагноза ОП учитывали анамнестические данные и сопутствующие заболевания, способные влиять на МПКТ.
С целью определения плотности кости выполнено денситометрическое исследование методом двухэнергетической рентгеновской абсорбциометрии. Исследовали минеральную плотность костной ткани (МПКТ) в поясничном отделе позвоночника (LII—LIV) и ШБК. Костную массу оценивали по содержанию минералов на единицу площади костной ткани (в г/см2), а также от среднего показателя пиковой костной массы у молодых женщин (Т-критерий) в стандартных отклонениях (СО). Остеопенический синдром определяли в соответствии с рекомендациями Всемирной организации здравоохранения: Т-критерий в диапазоне от –1 до –2,4 СО расценивали как остеопению, Т-критерий ≤ –2,5 — как ОП. При установлении диагноза ОП учитывали анамнестические данные и сопутствующие заболевания, способные влиять на МПКТ.
Эхокардиографию выполняли в одномерном (М-режиме), двухмерном (В-режиме) и допплеровских (импульсноволновом и постоянноволновом) режимах. Фракцию выброса (ФВ) левого желудочка (ЛЖ) определяли методом дисков Симпсона. Критерием гипертрофии ЛЖ явилось наличие 2 из 3 критериев: гипертрофия стенок ЛЖ (толщина межжелудочковой перегородки — МЖП в диастолу и/или толщина задней стенки ЛЖ в диастолу ≥1,1 см; масса миокарда ЛЖ ≥ 210 г; индекс массы миокарда ЛЖ >123 г/м2 для мужчин и 110 г/м2 для женщин). ХБП диагностировали при СКФ ниже 60 мл/мин/1,73 м2, которая сохранялась на протяжении 3 мес и более, даже в отсутствие других маркеров повреждения почек [10].
Больным проводили коррекцию медикаментозной терапии согласно рекомендациям Российского кардиологического общества по лечению АГ и хронической сердечной недостаточности (ХСН). В составе комбинированной терапии использовали в индивидуально подобранных дозах ингибиторы ангиотензинпревращающего фермента, антагонисты рецепторов ангиотензина II, β1-селективные β-адреноблокаторы, антагонисты минералокортикоидных рецепторов, диуретики. В комплексной терапии по показаниям также использовали антагонисты медленных кальциевых каналов, дигоксин, антиагреганты, гиполипидемические препараты.
Статистическую обработку данных проводили с использованием пакетов программ SPSS 16.0 и Statistica 6.0. Распределение анализируемых показателей отличалось от нормального. Данные представлены в виде медианы и процентилей — Me (25-й процентиль; 75-й процентиль) или абсолютных и относительных частот — n (%). Ассоциации между переменными выявляли с помощью коэффициента корреляции (r) Спирмена. Для оценки взаимосвязи показателей определяли отношение шансов (ОШ) и его 95% доверительный интервал (ДИ) при однофакторном анализе в модели логистической регрессии. Различие считали статистически значимым при двустороннем p<0,05.
Результаты
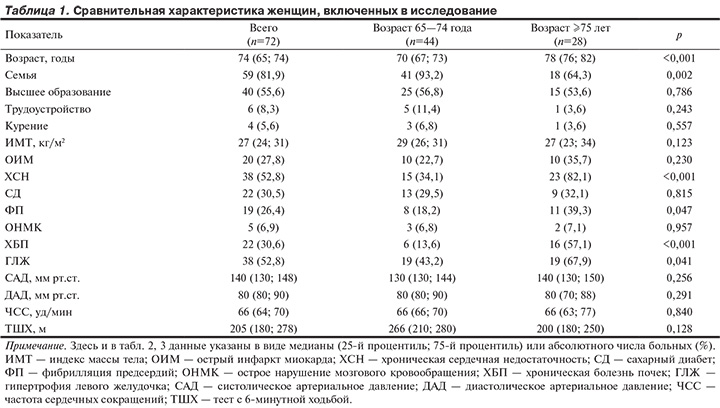
Характеристика наблюдавшихся женщин разного возраста представлена в табл. 1.
Женщины двух групп были сопоставимы по индексу массы тела, уровню образования, трудоустройству, гемодинамическим показателям, времени выполнения ТШХ. Женщины в возрасте 65—74 лет ТПС выполняли за 13 (10; 15) с, в возрасте 75 лет и старше — за 13 (12; 16) с (р=0,580). Однако ТПС в течение 10 с выполняли 8 (30,8%) из 26 женщин в возрасте 65—74 лет и 1 (6,3%) из 16 женщин ≥75 лет (р=0,006).
При опросе и оценке индивидуального анамнеза, а также состояния костной системы выявлено, что среди двух возрастных групп с одинаковой частотой встречались женщины, ведущие активный образ жизни (р=0,133). ОП имелся у 20 (51,3%) из 39 женщин в возрасте 65—74 лет и у 19 (90,5%) из 21 — в возрасте старше 74 лет (р=0,024).
Женщины в возрасте 65—74 лет и 75 лет и старше имели сопоставимую частоту локомоторных падений в течение предшествующего года — у 21 (47,7%) и у 11 (39,3%) соответственно (р=0,482); переломы костей скелета разной локализации имелись у 17 (38,6%) и у 13 (46,4%) женщин соответственно (р=0,513). В течение последнего года у 3 женщин 65—74 лет был диагностирован перелом лучевой кости и у 1 — компрессионный перелом позвонков. У 1 женщины в возрасте 75 лет и старше был диагностирован перелом ШБК, у 1 — компрессионный перелом позвонков и у 3 — лучевой кости.
Медиана оценки по шкале MMSE у женщин в возрасте 65—74 лет составила 27 (24—28) баллов, в возрасте 75 лет и старше — 24 (20—26) баллов (р=0,008). Выраженные когнитивные нарушения (оценка по шкале MMSE 23 балла и менее) у женщин в возрасте 75 лет и старше встречались статистически значимо чаще, чем у женщин более молодого возраста (рисунок).
МПКТ как в области ШБК, так и позвоночника, а также большинство лабораторных показателей были сопоставимы у женщин двух групп (табл. 2). Однако у женщин более старшего возраста СКФ и уровень 25-ОН витамина D были ниже, чем у женщин более молодого возраста.

Женщины в возрасте 75 лет и старше имели более низкую ФВ ЛЖ. Размер левого предсердия, конечный систолический размер (КСР) ЛЖ и толщина МЖП у женщин этой группы также были больше, чем у женщин в возрасте 65—74 лет (табл. 3).
Высокий риск развития ССО выявлен у 51 (70,8%) из 72 женщин: у 26 (59,1%) из 44 женщин в возрасте 65—74 лет и у 25 (89,3%) из 28 в возрасте 75 лет и старше (р=0,006).
Синдром «хрупкость» имелся у 24 (33,3%) наблюдавшихся женщин: у 6 (13,6%) в возрасте 65—74 лет и у 18 (64,3%) — в возрасте 75 лет и старше (р<0,001). Наблюдалась положительная корреляция между высоким риском развития ССО и синдромом «хрупкость» (r=0,32; p=0,017), ОП (r=0,36; p=0,002) и отрицательная корреляция с уровнем 25-ОН витамина D (r=–0,46; p=0,017).
Синдром «хрупкость» положительно коррелировал с возрастом пациенток (r=0,48; p<0,001), ОП (r=0,31; p=0,014), ИМ в анамнезе (r=0,42; p<0,001), ХБП (r=0,37; p=0,009), Т-критерием ШБК (r=0,28; p=0,040), Т-критерием позвоночника (r=0,29; p=0,036), конечным диастолическим размером ЛЖ (r=0,34; p=0,007), КСР ЛЖ (r=0,33; p=0,010) и отрицательно — с наличием семьи у пациентки (r=–0,32; p=0,007), 25-ОН витамина D (r=–0,51; p<0,001), ФВ ЛЖ (r=–0,25; p=0,048).
Возраст старше 74 лет (ОШ 6,0 при 95% ДИ от 2,1 до 17,5; р=0,001), высокий риск развития ССО (ОШ 7,2 при 95% ДИ от 1,5 до 34,2; р=0,013), ХБП (ОШ 18,9 при 95% ДИ от 5,2 до 20,2; р<0,001), ОП (ОШ 4,5 при 95% ДИ от 1,3 до 15,8; р=0,019), ИМ в анамнезе (ОШ 6,8 при 95% ДИ от 2,2 до 20,8; р=0,001) ассоциировались с синдромом «хрупкость» при однофакторном регрессионном анализе.
Обсуждение
Женщины двух возрастных групп были сопоставимы по уровню образования, трудоустройству, гемодинамическим показателям, показателям индекса массы тела, времени выполнения ТШХ, большинству лабораторных показателей, за исключением СКФ и уровня витамина D, которые у женщин старческого возраста были значительно ниже, чем у женщин более молодого возраста.
Высокий риск развития ССО у женщин в возрасте 75 лет и старше выявлялся чаще, чем в более молодом возрасте (р=0,006). Наличие в анамнезе ХСН, фибрилляции предсердий, ХБП, гипертрофии ЛЖ объясняет распространенность высокого риска развития ССО у женщин старческого возраста.
ТПС в течение 10 с выполняли 30,8% женщин в возрасте 65—74 лет и всего 6,3% женщин в возрасте 75 лет и старше (р=0,006), что свидетельствовало о более высоком риске падений у женщин более старшего возраста. Склонность к повторным падениям рассматривается как один из компонентов синдрома «хрупкость», диагностика которого базируется на совокупности 3 и более критериев, ассоциируемых с возрастом: беспричинное снижение массы тела, слабость, недостаток сил, медленная скорость при ходьбе и низкая физическая активность [11]. Синдром «хрупкость» на популяционном и клиническом уровнях характеризует функциональный статус и состояние здоровья, а не болезнь, и позволяет выявлять пожилых людей, находящихся в группе риска развития инвалидности и неблагоприятных исходов [12, 13].
Показано, что падения, снижение функциональной активности, нарушение зрения, слуха, психоэмоционального статуса, питания, физической активности, увеличение числа госпитализаций возможно предотвратить при своевременном выявлении пациентов пожилого и старческого возраста, нуждающихся в посторонней помощи, реабилитации, и снизить их уязвимость к воздействию неблагоприятных факторов [14], поскольку «хрупкость» — это динамический и потенциально обратимый процесс [15].
Доказано участие в патогенезе этого синдрома молекулярных маркеров хронического воспаления и иммунной активации (интерлейкин-6, провоспалительные цитокины, С-реактивный белок, неоптерин и др.), клеточных компонентов воспаления и иммунной системы (лейкоциты, моноциты, Т-лимфоциты, увеличение графы кластера дифференцировки (CD)8+/CD28-Т-клеток и CCR5+), cоматотропных гормонов, гипоталамо-гипофизарно-надпочечниковой оси, недостаточности витамина D, уровней циркулирующего полового гормона дегидроэпиандростерон-сульфата и IGF-1 и других гормонов [16, 17]. Быстрое снижение содержания эстрогенов у женщин в постменопаузе также вносит вклад в формирование синдрома «хрупкость» за счет снижения мышечной массы и силы. Распространенность данного клинического синдрома колеблется от 8,8 до 20% в возрасте 65—79 лет [18—20], достигая 36,5% в возрасте 80 лет и старше [21].
По данным систематического обзора литературы, изучавшего результаты 21 исследования с участием 61 500 мужчин и женщин в возрасте 65 лет и старше, распространенность синдрома «хрупкость» составила 10,7%, а развитие этого синдрома увеличивается с возрастом и чаще наблюдается у женщин, чем у мужчин [22].
Согласно нашим данным, синдром «хрупкость» имелся у 33,3% наблюдавшихся женщин: у 13,6% в возрасте 65—74 лет и у 64,3% — в возрасте 75 лет и старше (р<0,001) и ассоциировался с более старшим возрастом (ОШ 6,0). Возможным объяснением высокой частоты развития синдрома «хрупкость» у женщин старческого возраста по сравнению с данными других авторов может быть наличие у большинства из них ОП (90,5%) и очень высокого риска развития ССО (89,3%), что подтверждается тесной связью «хрупкости» с высоким риском развития ССО и ОП в однофакторном регрессионном анализе. Большая роль принадлежит и сопутствующей патологии, которая чаще имелась у женщин 75 лет и старше. Наступление менопаузы и связанное с ней снижение уровня эстрогенов усугубляет течение ССЗ, что способствует быстрому поражению органов-мишеней и повышению индивидуального риска развития ССО. Согласно нашим данным, факторами, независимо связанными с синдромом «хрупкость», наряду с ОП оказались перенесенный ИМ и ХБП.
Дефицит эстрогенов нарушает электролитный баланс во внутри- и внеклеточной среде, изменяет равновесие между вазоактивными гормонами, функционированием гладких мышечных клеток сосудов [23]. АГ, особенно плохо контролируемая, оказывает повреждающее воздействие на церебральный кровоток и ответственна за изменения функционального и структурного характера, происходящие в микроциркуляторном русле. Зависящие от возраста нейродегенеративные и цереброваскулярные заболевания привлекают внимание специалистов, занимающихся ведением больных старшей возрастной группы. Достигнуты успехи в понимании патохимических и молекулярных механизмов формирования когнитивных расстройств. В частности, показана связь когнитивного дефицита со снижением дофаминергической активности в префронтальной коре, сенсорных ассоциативных корковых центрах и ряда других отделов головного мозга [24]. Подтверждены взаимосвязь между уровнем бодрствования и активности и содержанием норадреналина в мозге, а также участие норадренергических нейронов голубоватого пятна, связанных с гиппокампом, в консолидации памяти. Доказана идентичность изменений в головном мозге при «сенильных» заболеваниях и физиологическом старении [25]. Не вызывает сомнений, что когнитивный дефицит является неотъемлемым компонентом синдрома «хрупкости», а у пациентов с выраженными когнитивными нарушениями чаще развивается и прогрессирует «хрупкость». Cоциальная изоляция, одиночество, отсутствие поддержки семьи, близкого окружения, недостаток общения также способствуют усугублению когнитивных нарушений в пожилом и старческом возрасте [26].
По нашему мнению, немаловажным является также то, что женщины в возрасте 75 лет и старше чаще были одинокими, чем женщины в возрасте 65—74 лет, и это вносит вклад в формирование синдрома «хрупкость». Зависимость и уязвимость пациенток старческого возраста усугубляются развитием выраженных когнитивных нарушений, частота которых достигала 48% в наблюдаемой нами группе женщин. Становится очевидной необходимость организации превентивных мер и проведения скрининга для раннего выявления легких когнитивных нарушений, которые существенно не влияют на бытовую, профессиональную и социальную деятельность, и нередко обозначаются терминами «возрастная когнитивная дисфункция», «связанное с возрастом ухудшение памяти и внимания» и «доброкачественная старческая забывчивость» [27].
Полученные результаты свидетельствуют о наличии общих патогенетических звеньев нарушения функционирования сердечно-сосудистой системы, в том числе цереброваскулярной, почек и формирования синдрома «хрупкости». В данном случае можно предположить наличие у женщин с высоким риском развития ССО «цереброкардиоренального синдрома», что свидетельствует о необходимости мультидисплинарного подхода к таким пациенткам [28]. В результате комплексного междисциплинарного сотрудничества врачей разных специальностей совместно с гериатрами и работниками социальной службы возможно улучшение своевременной диагностики и лечения данного синдрома, что приведет к сохранению качества жизни и независимости пациенток пожилого и старческого возраста.
Заключение
Высокий риск развития сердечно-сосудистых осложнений у женщин в возрасте 75 лет и старше выявлялся чаще, чем в более молодом возрасте, что обусловлено высокой распространенностью хронической сердечной недостаточности, фибрилляции предсердий, хронической болезни почек и гипертрофии левого желудочка. Синдром «хрупкость» имелся у 13,6% женщин в возрасте 65—74 лет и у 64,3% в возрасте 75 лет и старше и тесно ассоциировался с возрастом и высоким риском развития сердечно-сосудистых осложнений. Факторами, независимо связанными с синдромом «хрупкость», оказались остеопороз, инфаркт миокарда в анамнезе и хроническая болезнь почек.
Полученные результаты свидетельствуют о наличии общих патогенетических звеньев нарушения функционирования сердечно-сосудистой системы, цереброваскулярной системы, почек и формирования синдрома «хрупкость». Необходимы комплексный междисциплинарный подход к таким пациенткам с участием гериатра, а также своевременная диагностика и лечение синдрома «хрупкость» с целью сохранения качества жизни и независимости пациенток пожилого и старческого возраста.
Ограничения исследования. В настоящее время в нашей стране отсутствуют конкретные унифицированные рекомендации для оценки синдрома «хрупкость» у пациентов старшей возрастной группы. Мы использовали обобщенные критерии данного синдрома, в связи с чем полученные нами результаты не могут распространяться на всю популяцию женщин в возрасте 65 лет и старше. В настоящей статье целенаправленно не представлен подробный анализ медикаментозной терапии: количество принимаемых препаратов, их связь с показателями здоровья, полипрагмазия, распространенность гериатрического синдрома, что будет отражено в дальнейших работах.



