Проведение одномоментной коррекции порока митрального клапана (МК) и радиочастотной процедуры «Лабиринт» позволяет в 65—80% случаев устранить фибрилляцию предсердий (ФП) [1—5] или в дальнейшем обеспечить успешность электроимпульсной терапии (ЭИТ) [6]. Восстановление синусового ритма (СР) после протезирования МК и процедуры «Лабиринт» способствует сохранению нормальной функции левого желудочка и, соответственно, ведет к уменьшению частоты возникновения сердечно-сосудистых осложнений [7]. После одномоментной коррекции порока сердца и ФП уменьшается риск возникновения тромботических и тромбоэмболических осложнений [8], что является одним из главных факторов, определяющих эффективность антикоагулянтной терапии (АКТ). Отмена варфарина через 3 мес после операции на сердце при наличии биологических протезов и снижение уровня гипокоагуляции до нижней границы целевого диапазона после имплантации механических протезов [9—11] обеспечивает безопасность АКТ, так как снижает частоту возникновения геморрагических осложнений.
На настоящий момент отсутствует единое мнение о сроках проведения ЭИТ после кардиохирургического лечения [12, 13]. Встречаются единичные данные о возможности проведения катетерной радиочастотной абляции (РЧА) в случае неуспешной процедуры «Лабиринт» [14, 15].
Поэтому определение последовательной стратегии восстановления СР, включающей проведение хирургического лечения, наружную ЭИТ и катетерную РЧА, является актуальным.
Цель исследования — оценить клиническую эффективность последовательной стратегии восстановления СР после одномоментной коррекции порока МК и процедуры «Лабиринт» с позиции повышения эффективности и безопасности АКТ.
Материал и методы
С учетом показаний к проведению одномоментной коррекции порока МК и процедуры «Лабиринт» [10] в исследовании приняли участие 118 пациентов (сплошная выборка), из них 62 (52,5%) женщины и 56 (47,5%) мужчин, средний возраст 49,5±10,5 года. Все пациенты имели клинические проявления хронической сердечной недостаточности (ХСН), средний функциональный класс (ФК) по классификации Нью-Йоркской ассоциации сердца (NYHA) составил 3,3±0,3. До хирургического лечения во всех случаях регистрировалась длительно персистирующая ФП, подтвержденная результатами электрокардиографии и суточного мониторирования электрокардиограммы (ЭКГ). Чреспищеводное или внутрисердечное электрофизиологическое исследование (ЭФИ) для верификации тахиаритмии не проводили, поскольку тактика АКТ после протезирования клапанов сердца одинакова как при ФП, так и при других внутрипредсердных тахиаритмиях, прежде всего трепетании предсердий (ТП) и мультифокальной предсердной тахикардии [16, 17].
Как известно, отсутствие любых внутрипредсердных тахиаритмий обеспечивает отмену АКТ при наличии биологических клапанов сердца и уменьшение уровня целевого диапазона гипокоагуляции при механических протезах.
Среди обследуемых длительность «аритмического» анамнеза составила 5,3±2,8 года. Заболеваниями, ставшими причиной порока сердца, явились ревматическая болезнь сердца у 85 (72%) больных, инфекционный эндокардит — у 19 (16%) и синдром соединительно-тканной дисплазии — у 14 (12%). Практически в равном соотношении были имплантированы биологические и механические клапаны сердца: 56 (47,5%) и 62 (52,5%) соответственно. Протезирование МК сопровождалось пластикой трикуспидального клапана с применением опорных биологических колец у 58 (48%) пациентов, протезированием аортального клапана биологическим протезом — у 18 (15%) и механическим — у 12 (10%).
 У 46 (38,9%) пациентов регистрировались желудочковые нарушения ритма I—II градации по Лауну, которые принципиально не меняли антиаритмическую терапию (ААТ). На протяжении всего периода наблюдения назначали амиодарон в дозе 200—400 мг/сут, который в отсутствие ФП по данным клинического обследования и трехсуточного мониторирования ЭКГ отменяли в среднем через 3—6 мес после кардиохирургического лечения. Для контроля частоты сердечных сокращений дополнительно назначали β-адреноблокаторы. Проводилась АКТ варфарином с учетом вида протезированного клапана сердца и наличия факторов риска тромбоэмболических осложнений [11].
У 46 (38,9%) пациентов регистрировались желудочковые нарушения ритма I—II градации по Лауну, которые принципиально не меняли антиаритмическую терапию (ААТ). На протяжении всего периода наблюдения назначали амиодарон в дозе 200—400 мг/сут, который в отсутствие ФП по данным клинического обследования и трехсуточного мониторирования ЭКГ отменяли в среднем через 3—6 мес после кардиохирургического лечения. Для контроля частоты сердечных сокращений дополнительно назначали β-адреноблокаторы. Проводилась АКТ варфарином с учетом вида протезированного клапана сердца и наличия факторов риска тромбоэмболических осложнений [11].
Оценивали клинико-анамнестические данные, наличие ФП документировали методом ЭКГ в 12 общепринятых отведениях и/или суточного мониторирования ЭКГ. Проводили синхронизированную с ЭКГ эхокардиографию (ЭхоКГ) сердца на ультразвуковом сканере Vivid 7 Dimеnsion с датчиком 2,5 МГц.
Кардиохирургическое лечение выполняли в условиях искусственного кровообращения (ИК), при нормо- или поверхностной (при длительных операциях) гипотермии и кровяной или фармакохолодовой кардиоплегии с использованием раствора кустодиол. Среднее время ИК при одноклапанной коррекции составило 88,5±13,5 мин, при многоклапанной — 116,5±18,5 мин. Время пережатия аорты при одноклапанной коррекции — 64,0±9,5 мин, при многоклапанной — 91,5±15,0 мин. Радиочастотную процедуру «Лабиринт» выполняли в условиях ИК до этапа протезирования клапана с использованием аппарата Cardioblate («Medtronic», США) при помощи монополярного электрода («Medtronic», США) с мощностью 25 Вт и скоростью орошения 5 мл/мин. Использовали левопредсердную и биатриальную схемы процедуры «Лабиринт» у 68 (58%) и 50 (42%) соответственно, при этом у 71 (60%) пациента применяли транссептальный доступ, у 47 (40%) — доступ по Guiraudon. В ходе левопредсердного этапа производили изоляцию правых и левых легочных вен (ЛВ) попарно или единым блоком, создавали линию по крыше (верхней стенке) левого предсердия (ЛП) между изолированными венами, линию между левой нижней ЛВ и кольцом МК, линию между левой верхней ЛВ и основанием ушка ЛП, изоляцию ушка ЛП с его последующим лигированием. В правом предсердии выполняли линии по кавотрикуспидальному истмусу (перешейку) и между устьями полых вен.
Наружную ЭИТ выполняли разрядом 150—200 Дж при переднебоковом расположении электродов с помощью синхронизированных с R-волной биполярных импульсов на фоне адекватной седации и анестезии с использованием пропофола. Для исключения внутрисердечных тромбов и эффекта спонтанного контрастирования проводили чреспищеводную ЭхоКГ сердца. В условиях рентгеноперационной под эндотрахеальным наркозом пациентам проводили катетерную процедуру ЭФИ с последующей РЧА.
В 3 случаях исследование проведено на навигационном комплексе SpaceVision, в 7 — Carto 3. Орошаемую РЧА выполняли электродами EZ Steer Thermocool NAV со скоростью орошения 17 мл/мин при температуре 45 °С и мощности 30—40 Вт.
Статистический анализ данных проводили при помощи пакета программ Statistica 6.0. При анализе количественных показателей рассчитывали среднее значение и стандартное отклонение. Количественные показатели оценивали с помощью критерия Вилкоксона, при оценке различий качественных показателей использовали критерий χ2 Пирсона. Различия считали статистически значимыми при р<0,05.
Результаты
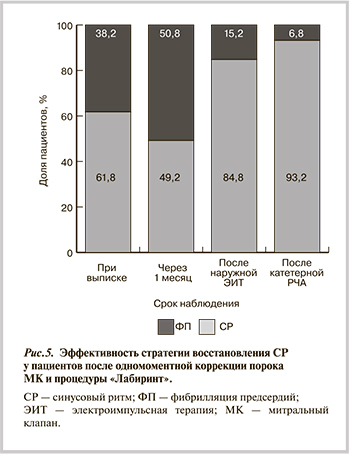
После одномоментной коррекции порока МК и процедуры «Лабиринт» при выписке из кардиохирургического отделения у пациентов уменьшился ФК ХСН по классификации NYHA с 3,3±0,3 до 2,3±0,8 (p=0,03). Восстановление СР после хирургического лечения регистрировалось у 73 (61,8%) больных, при этом у 26 (22%) из них в дальнейшем сохранялся СР на фоне ААТ.
У 47 (39,8%) пациентов в срок от 2 до 6 дней после операции рецидивировали пароксизмы ФП, купируемые внутривенным введением амиодарона в дозе 450—600 мг/сут. При динамическом осмотре на амбулаторном этапе через 1 мес после хирургического лечения уменьшилось число пациентов с СР до 58 (49,2%; p=0,05). С учетом общепринятых показаний [18] в условиях стационара 60 (50,8%) пациентам проводилась ЭИТ, которая была эффективной у 42 (35,6%) больных (p=0,04), при этом у 18 обследуемых (15,2% от всей группы наблюдения) сохранялась ФП.
В первые дни после успешной ЭИТ по шкале Santa Cruz [19] у всех пациентов отсутствовали сокращения предсердий, через 1 мес имелась положительная динамика, а через 2 мес регистрировался СР с признаками сокращения обоих предсердий (таблица).
При неэффективной ЭИТ 10 (8,3%) пациентам с биологическими протезами клапанов сердца проводили катетерную РЧА. При эндокардиальном картировании во всех случаях подтвержден рецидив ФП. Наиболее частой находкой было восстановление проведения через линии изоляции ЛВ (рис. 1, см. цв. вклейку). Если после реизоляции ЛВ ритм не восстанавливался, процедуру дополняли РЧА ганглионарных сплетений (рис. 2, см. цв. вклейку).
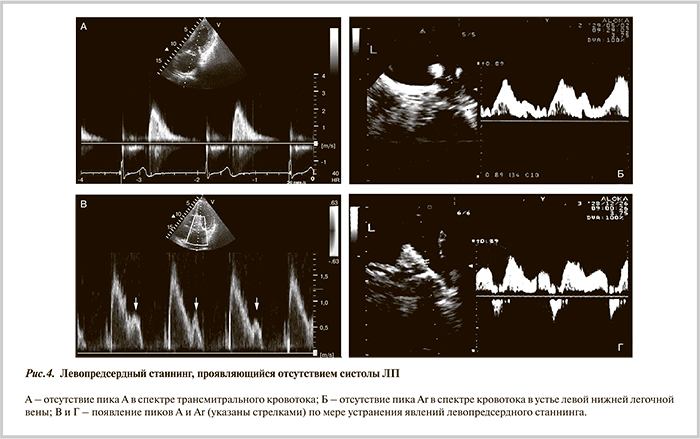
В 4 случаях индуцировалось ТП или наблюдалась интраоперационная конверсия ФП в ТП. Путем электроанатомического картирования и вхождения в цикл тахикардии во всех случаях подтвердился механизм перимитрального re-entry или re-entry вокруг попарно изолированных ЛВ. В этом случае создавали дополнительные линейные повреждения по крыше ЛП и от правой верхней ЛВ к кольцу МК (рис. 3, см. цв. вклейку). Восстановление СР непосредственно во время процедуры произошло у 6 из 10 пациентов. На фоне ААТ через 6 мес у всех пациентов регистрировался СР, по данным ЭКГ и трехсуточного мониторирования ЭКГ. В первые дни после катетерной процедуры у большинства пациентов регистрировались явления оглушения («станнинга») ЛП, что проявлялось отсутствием предсердной систолы в спектре трансмитрального кровотока. В динамике отмечалось восстановление сократительной функции ЛП: через 1 мес у 4 пациентов, через 3 и 6 мес — у 6 и 8 соответственно, через 1 год у всех пациентов регистрировалась эффективная систола ЛП со средней скоростью волны А трансмитрального кровотока 0,68±0,11 м/с (рис. 4). Это позволило отменить варфарин пациентам с протезированными биологическими клапанами сердца и снизить уровень гипокоагуляции до нижней границы целевого диапазона при механических протезах.
Таким образом, первым этапом восстановления СР рассматривалось само кардиохирургическое лечение в сочетании с процедурой «Лабиринт», вторым — наружная ЭИТ, третьим этапом являлась катетерная РЧА у пациентов с протезированными биологическими клапанами сердца. Эффективность каждого этапа оценивали по числу пациентов с СР среди обследуемых (рис. 5).
Обсуждение
Хирургическая коррекция порока МК в 30—40% случаев приводит к восстановлению СР, в то же время одновременное выполнение операции на сердце — протезирование МК и процедуры «Лабиринт» в 65—80% устраняет ФП [1—5]. При этом нельзя недооценивать положительного антиаритмического влияния амиодарона на эффективность восстановления СР [20].
Отмена АКТ предопределяет преимущество биологических клапанов сердца [21]. Вместе с тем у пациентов с механическими протезами проведение процедуры «Лабиринт» оправдано, поскольку уменьшаются клинические проявления сердечной недостаточности, хотя и продолжается пожизненная АКТ [22, 23]. Кроме того, выполнение процедуры «Лабиринт» у пациентов с механическими клапанами улучшает внутрисердечную гемодинамику и, соответственно, способствует профилактике тромботических осложнений [23]. Это позволяет снизить уровень гипокоагуляции до нижней границы целевого диапазона [11, 24], уменьшая тем самым риск кровотечений.
На эффективность одномоментной коррекции порока МК и процедуры «Лабиринт» влияет ряд факторов, таких как продолжительность ФП, размер ЛП и состояние сократительной функции сердца [25]. Поэтому после интраоперационного устранения ФП сохраняется вероятность рецидива тахикардии, как правило, в течение 1 нед после кардиохирургического лечения [26]. Это согласуется с нашими данными. Так, у 47 (39,8%) пациентов на 2—6-й день послеоперационного периода рецидивировали пароксизмы ФП, несмотря на ААТ, способствующую снижению частоты возникновения послеоперационной ФП [27, 28].
 На консультативном приеме кардиолога через 1 мес после операции, по результатам обследования с учетом стандартов ведения данной категории больных [10, 24, 29], принималось решение о возможности восстановления СР методом ЭИТ, которая выполнялась через 1—1,5 мес после кардиохирургического лечения. В ряде работ представлены противоречивые данные, свидетельствующие о целесообразности проведения ЭИТ как перед выпиской из стационара [12], так и через 5—8 мес после операции на сердце [13].
На консультативном приеме кардиолога через 1 мес после операции, по результатам обследования с учетом стандартов ведения данной категории больных [10, 24, 29], принималось решение о возможности восстановления СР методом ЭИТ, которая выполнялась через 1—1,5 мес после кардиохирургического лечения. В ряде работ представлены противоречивые данные, свидетельствующие о целесообразности проведения ЭИТ как перед выпиской из стационара [12], так и через 5—8 мес после операции на сердце [13].
По нашему мнению, проведение ЭИТ через 1—1,5 мес после кардиохирургического лечения является оптимальным с точки зрения эффективности восстановления СР в результате стабилизации процессов электрического ремоделирования миокарда ЛП, а также возможной отмены варфарина через 3 мес после операции при биологических протезах [10, 24, 29]. Выполнение ЭИТ в более поздние сроки увеличивает длительность применения АКТ.
Завершающим этапом стратегии являлась катетерная РЧА у пациентов с биологическими протезами после неуспешного лечения ФП на открытом сердце. Как показано в описанной серии случаев, основной причиной неуспешности процедуры «Лабиринт» явилось восстановление проведения между ЛВ и ЛП. Подобные наблюдения описаны как при проведении модифицированных процедур «Лабиринт» (радиочастотных, крио- и микроволновых), так и при классических операциях «cut and sew» (шить и кроить) [30, 31].
Необходимо подчеркнуть важность сохранения механической функции ЛП, страдающей у пациентов после процедуры «Лабиринт» из-за большого объема повреждаемого предсердного миокарда. В нашей серии вмешательств непосредственно после выполнения катетерной РЧА во всех случаях регистрировались явления левопредсердного станнинга. Однако в отдаленные сроки более чем у 50% пациентов наблюдалась адекватная сократимость ЛП при сохранении СР, что позволило отменить варфарин. Данные ЭхоКГ подкреплялись отсутствием клинической симптоматики и данными трехсуточного мониторирования ЭКГ.
Известно, что повторное выполнение процедуры «Лабиринт» связано с высоким риском. Проведение катетерной РЧА при механических клапанах в митральной позиции сопряжено с риском заклинивания катетеров в запирательных элементах протезов [14]. Использование биологических протезов в митральной позиции — альтернатива,при которой возможно не только безопасно выполнять катетерные РЧА в ЛП, но и полностью освободить пациентов от приема непрямых антикоагулянтов, сопровождающегося высоким риском развития геморрагических и тромботических осложнений [9, 11]. Кроме того, ФП способствует прогрессированию ХСН, ухудшает качество и прогноз жизни. Устранение ФП является первоочередной задачей в ведении пациентов с протезированными клапанами сердца.
Заключение
Продемонстрирована высокая клиническая эффектив-ность и безопасность последовательной стратегии восстановления синусового ритма у пациентов с протезированными клапанами сердца. Первый этап стратегии включал кардиохирургическое лечение и радиочастотную процедуру «Лабиринт», которая в 61,8 % случаев обеспечивала возможность восстановления синусового ритма. При сохранении фибрилляции предсердий вторым этапом стратегии являлась плановая электроимпульсная терапия через 1—1,5 мес после операции на сердце и третьим этапом —катетерная радиочастотная абляция при биологических протезах. Второй этап способствовал восстановлению синусового ритма у 84,8% больных, третий — у 93,2% (p<0,05), при этом обеспечивалась 100% эффективность восстановления синусового ритма при биологических клапанах сердца. Наличие синусного ритма при биологических протезах позволило отменить варфарин и снизить уровень гипокоагуляции при механических клапанах. Таким образом, предложенную стратегию восстановления синусового ритма следует рассматривать как один из путей повышения эффективности и безопасности антикоагулянтной терапии у больных данной категории.



