В отделении хирургии аорты и ее ветвей Российского научного центра хирургии им. акад. Б.В. Петровского РАМН (РНЦХ РАМН) с 1989 г. оперированы 1995 пациентов с мультифокальным атеросклерозом (МФА). За этот период были внедрены протоколы обследования больных и успешно выполнены первые операции одномоментной реваскуляризации 2 и 3 сосудистых бассейнов (сердца, головного мозга и брюшной аорты).
Аневризмы брюшного отдела аорты (АБОА), сочетающиеся с ишемической болезнью сердца (ИБС), относятся к одной из самых тяжелых комбинаций атеросклеротического поражения. Частота сочетания ИБС с АБОА превышает 50%. У больных этой группы имеется неблагоприятный прогноз, который еще более усугубляется наличием сочетанной и сопутствующей патологии. Несмотря на достижения в профилактике и лечении атеросклеротических поражений сосудов, основным методом восстановления кровообращения остается хирургический [1—9]. Успешно выполненная реконструкция брюшной аорты при ИБС не полностью излечивает больного, если не была произведена коррекция коронарного кровообращения. При этом послеоперационная 5-летняя выживаемость снижается до 70%, причем в структуре летальности в отдаленном послеоперационном периоде инфаркт миокарда (ИМ) занимает первое место [10—12].
В связи с этим особую актуальность приобретает решение вопроса о правильном подходе в лечении больных ИБС с АБОА. В решении проблемы лечения этой патологии все чаще применяются хирургические мини-доступы [13, 14], рентгенохирургические методы, менее травматичные по сравнению с открытыми операциями [15—17].
Цель настоящего исследования — выработать оптимальную тактику хирургического лечения больных с аневризмами брюшной аорты в сочетании с ишемической болезнью сердца при мультифокальном атеросклерозе на основании полученных результатов.
Материал и методы
С января 2003 г. по апрель 2013 г. в отделении хирургии аорты и ее ветвей РНЦХ РАМН выполнено 409 хирургических реконструкций по поводу АБОА. У 137 больных с АБОА в сочетании с ИБС выполнено вмешательство на 2 сосудистых регионах. У всех оперированных больных ведущим этиологическим фактором являлся атеросклероз. Большинство составили мужчины — 124 (90,5%). Возраст пациентов колебался от 62 до 82 лет.
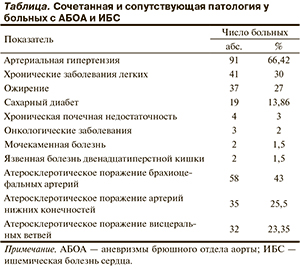
Кардиальные жалобы предъявляли 120 (87,6%) больных со стенокардией II и III функционального класса (ФК), у остальных 17 (12,4%) больных поражение коронарных артерий (КА) протекало бессимптомно. Из наиболее часто встречающейся сопутствующей патологии следует отметить артериальную гипертензию, хронические заболевания легких, ожирение и сахарный диабет. Часто встречалось сочетанное атеросклеротическое поражение брахиоцефальных артерий, нижних конечностей и висцеральных ветвей (см. таблицу).
Диаметр АБОА колебался от 5 до 12 см. Диаметр аневризмы 5—7 см был у 110 (80,3%) пациентов и только у 27 (19,7%) размеры аневризмы превышали 8 см. Острой клинической картины надрывов аневризм в этой группе больных не отмечалось. У 129 (94,16%) пациентов по результатам обследования, подтвержденного интраоперационными данными, имелись выраженные деструктивные изменения стенок аневризмы, в том числе у аневризм с небольшими размерами. У больных с аневризмами более 8 см периодически возникали боли в пояснице и брюшной полости, склонность к задержке стула и ощущение пульсации в животе.
Предоперационное обследование пациентов включало детальный анализ жалоб, факторов, вызывающих приступ стенокардии, и физикальное обследование. У всех пациентов с атеросклеротической АБОА выявляли ИБС сначала с помощью неинвазивных методов обследования. Проводили анализ данных рентгенографии органов грудной клетки, электрокардиографии, ультразвукового исследования (УЗИ) органов брюшной полости и забрюшинного пространства, эхокардиографии, ультразвуковой допплерографии магистральных сосудов. Мультиспиральную компьютерную томографию (МСКТ) и коронарографию (КГ) проводили с целью постановки окончательного диагноза.
 Вмешательство на КА первым этапом произведено у 130 (94,9%) больных. Из них у 38 выполнено стентирование КА и у 92 — открытые вмешательства на КА.
Вмешательство на КА первым этапом произведено у 130 (94,9%) больных. Из них у 38 выполнено стентирование КА и у 92 — открытые вмешательства на КА.
В 11 случаях больным со значимыми стенозами внутренних сонных артерий (ВСА) одномоментно с реваскуляризацией миокарда была сделана каротидная эндартерэктомия. У 126 пациентов выполнена реконструктивная операция на брюшной аорте вторым этапом. У 4 больных вторым этапом выполнено стентирование брюшной аорты. Полностью стентирование двух сосудистых бассейнов не было сделано ни одному больному. У 7 больных произвели реваскуляризацию миокарда одновременно с реконструкцией брюшной аорты из мини-доступа. Такой доступ при операциях на брюшной аорте при этапном и одномоментном вмешательстве использовали всего у 29 (21,8%) больных.
Интервал между вмешательствами на КА и аорте составлял от 1 нед до 5 мес. После стентирования КА операцию на брюшной аорте проводили через минимальные сроки, несмотря на антикоагулянтную терапию, без ее отмены.
Открытые операции на КА выполняли при множественном их поражении, особенно при оценке по шкале SYNTAX >32 баллов. Всегда наряду с аутовенозными трансплантатами использовали внутреннюю грудную артерию (ВГА) в отсутствие в ней патологических изменений и значимого стенотического поражения в соответствующей подключичной артерии.
Из 38 стентирований КА в 17 случаях выполнено вмешательство на одном сосуде и у 21 пациента произведено стентирование 2 и 3 КА.
Пациентам с АБОА и ИБС были произведены 3 вида реконструкции аорты: линейное протезирование, бифуркационное аортоподвздошное и бифуркационное аортобедренное протезирование. У 5 больных сочетанно выполнены операции на магистральных артериях нижних конечностей в связи с выраженной ишемией.
Статистическая обработка полученных данных производилась при помощи программного пакета Microsoft Offic Excel 2007 и MedCalc. Для оценки достоверности различий использовались парный коэффициент Стьюдента и тест Фишера для малых выборок. Различия считали статистически значимыми при р <0,05. Данные представлены в виде средняя ± ошибка средней.
Результаты и обсуждение
В ближайшем послеоперационном периоде у больных с АБОА в сочетании с ИБС при этапном лечении наблюдались следующие осложнения: пневмонии — у 10 (7,6%), гнойно-септические осложнения — у 4 (3%), острая почечная недостаточность — у 2 (1,5%). Осложнения при одномоментном лечении: пневмонии — у 4 (57,2%), сепсис — у 1 (14,3%), тромбоэмболия легочной артерии — у 1(14,3%). Продолжительность госпитального послеоперационного периода при этапных операциях составила – 7±2,3 дня, а при одномоментных – 32±7,65. При этапном лечении был 1 (0,76%) летальный исход у пациента с протезированием брюшной аорты по поводу АБОА. Причина – острая почечная недостаточность. При одномоментном лечении в ближайшем послеоперационном было 2 (28,6%) летальных исхода. Причинами явились тромбоэмболия легочной артерии и сепсис. Между первым и вторым этапами операций не было острых состояний, обусловленных надрывами аневризмы аорты и внутренними кровотечениями. Не наблюдалось также осложнений, связанных с выполненной первым этапом реваскуляризацией миокарда.
Выполненные одномоментно на сосудах сердца и брюшной аорте 7 операций были перенесены пациентами значительно тяжелее, с более продолжительным послеоперационным периодом (р <0,05), и достоверно большей послеоперационной летальностью (<0,05). Общая летальность при лечении больных с данной патологией за последние 10 лет составила 2,1%.
Занимаясь этой проблемой в течение многих лет, мы сначала превышали показания к одномоментной коррекции нескольких артериальных бассейнов. В настоящее время наше отношение к одномоментным реконструкциям изменилось. Особенно это касается больных пенсионного возраста с МФА с сопутствующими заболеваниями и явным ограничением резервных возможностей организма. Для этих пациентов методом выбора являются короткие этапные малотравматичные вмешательства, выполненные с минимальным перерывом. Это подтверждают результаты лечения наших больных.
Приводим клинический пример одномоментного хирургического вмешательства у больного с АБОА и ИБС.
Клиническое наблюдение №1. Больной В., 73 года, поступил в РНЦХ РАМН 14 марта 2006 г. с диагнозом: МФА. АБОА. ИБС. Стенокардия напряжения, ФК 3. Частая предсердная экстрасистолия. Гипертоническая болезнь III стадии. Хронический панкреатит. Хронический гастродуоденит. Хронический колит.
При поступлении пациент предъявлял жалобы на непостоянные боли тупого характера в левой половине живота и поясничной области, загрудинные боли с иррадиацией в плечи, шею, возникающие при физических нагрузках; повышение артериального давления (АД) максимально до 190/100 мм рт.ст., перебои в работе сердца.
Из анамнеза известно, что при плановом УЗИ в ноябре 2005 г. выявлена АБОА. С 1997 г. страдает стенокардией напряжения, постоянно принимает нитраты. Тогда же диагностированы нарушения ритма.
При осмотре состояние тяжелое. Кожные покровы бледные, на кистях рук псориатические высыпания, отеков нет. Частота дыхательных движений (ЧДД) 16 в минуту. Тоны сердца приглушены, выслушиваются экстрасистолы, частота сердечных сокращений (ЧСС) 70—80 уд/мин. Пульсация на артериях верхних и нижних конечностей отчетливая, симметричная с обеих сторон, определяется на всех уровнях. Отмечается пульсация в эпигастрии, в этой же области аускультативно выслушивается систолический шум.
На электрокардиограмме (ЭКГ) синусовый неправильный ритм, ЧСС 69 уд/мин, регистрируются наджелудочковые экстрасистолы, временами по типу квадригеминии. Изменения миокарда левого желудочка (ЛЖ).
МСКТ: ниже отхождения почечных артерий определяется веретенообразное расширение аорты максимально до 50 мм, протяженностью 60 мм, признаки расслоения задней стенки брюшной аорты.
КГ: сбалансированный тип кровоснабжения сердца. Ствол левой КА (ЛКА) имеет неровности контуров в проксимальном отделе, терминальная часть стенозирована на 40% с переходом на устье передней нисходящей артерии (ПНА). ПНА имеет субтотальный стеноз устья, 50% стеноз в среднем сегменте на уровне отхождения 2-й диагональной артерии. Огибающая артерия (ОА) стенозирована в среднем сегменте на 50%. Правая коронарная артерия (ПКА) имеет 40% стеноз в среднем сегменте и 70% стеноз перед отхождением задней нисходящей артерии.
06.04.06 пациенту выполнена одномоментная операция на двух артериальных бассейнах: маммарокоронарное шунтирование (МКШ) ПНА, аортокоронарное шунтирование (АКШ) заднебоковой ветви ОА и ПКА и линейное протезирование инфраренального отдела аорты протезом васкутек 20 мм из мини-доступа (рис. 1, см. цветную вклейку).
Операция начата со срединной мини-лапаротомии 10 см и одновременным забором большой подкожной вены с левой нижней конечности. Ниже почечных артерий определяется АБОА диаметром 5 см. Выполнена срединная стернотомия, выделена левая ВГА. В условиях искусственного кровообращения (ИК) и гипотермии (32 °С) выполнили МКШ и АКШ. После завершения ИК и нейтрализации гепарина установлен «мини-ассистент». Выделена АБОА. Стенка аорты деструктивно изменена по заднебоковой стенке шейки аневризмы, видна отслоенная интима с образованием нескольких карманов и тромбированием ложного канала, удалены массивные тромботические массы. Выполнено линейное протезирование брюшной аорты частичным иссечением и ушиванием аневризматического мешка над протезом. Послеоперационный период протекал с медленным восстановлением больного и заживлением ран. На момент выписки на 32-е сутки состояние больного удовлетворительное. При контрольном УЗИ визуализируется протез с четкими контурами, в брюшной полости и полости малого таза свободной жидкости нет. Гемодинамика стабильная. ЧСС 76 уд/мин. АД 115/70 мм рт.ст. Швы сняты на 14-е сутки, заживление первичным натяжением.
Второй клинический пример демонстрирует этапное лечение больной с сочетанной патологией.
Клиническое наблюдение №2. Больная Х., 73 года, поступила в РНЦХ РАМН 16.01.13 с диагнозом: МФА. АБОА. ИБС. Стенокардия напряжения, ФК 2. Постинфарктный кардиосклероз. Хроническая ишемия нижних конечностей 2 степени о Фонтену. Хронический гастрит с явлениями атрофии. Рубцовая деформация стенки желудка. Хроническая анемия. Артериальная гипертензия 3-й степени.
При поступлении больная жаловалась на быструю утомляемость, одышку, возникающую при нагрузках, проходящую в покое, на эпизодические давящие боли за грудиной, возникающие при физической нагрузке, купирующиеся в покое или после приема изокета, на боли в нижних конечностях, возникающие при физической нагрузке.
На момент осмотра состояние больной средней тяжести. Кожные покровы бледные, пониженного питания (45 кг), отеков нет. Тоны сердца приглушены, ЧСС 72 уд/мин, АД 140/60 мм рт.ст. Пульсация на магистральных артериях верхних и нижних конечностях удовлетворительного наполнения, определяется на всех уровнях. Систолический шум на сосудах шеи. В мезогастрии пульсирующее образование без четких границ, в эпигастрии выслушивается систолический шум. Неврологический статус без особенностей.
Из анамнеза известно, что в течение 30 лет отмечает повышение АД с максимальными цифрами до 220/110 мм рт.ст. На фоне регулярно принимаемой гипотензивной терапии АД 120—130/70—80 мм рт.ст. Признаки стенокардии напряжения с 2006 г. после перенесенного Q-образующего ИМ передней стенки.
На ЭКГ синусовая брадикардия. Крупноочаговые рубцовые изменения миокарда переднесептальной и верхушечной области ЛЖ.
КГ: ствол ЛКА не изменен, ПНА стенозирована на 70% в среднем сегменте, ОА не изменена, ПКА окклюзирована.
МСКТ: определяется аневризма инфраренального отдела аорты диаметром до 6,5 см на протяжении 8 см с наличием циркулярного тромба, проксимальной шейки 15 мм от устьев почечных артерий. Отмечаются 50% стенозы левой и правой почечных артерий (см. рис. 2, Д, см. цветную вклейку).
Ультразвуковое дуплексное сканирование брахиоцефальных ветвей: умеренно выраженные диффузные изменения экстракраниальных сосудов (стенозы ВСА до 50%, деформация хода ВСА).
Больной было проведено этапное лечение. Первым этапом 28.01.13 выполнены коронарная ангиопластика и стентирование ПНА стентом с лекарственным покрытием Promus Element 3,0—32 мм. В результате проведенного вмешательства проходимость ПНА была полностью восстановлена (рис. 2, А, Б, см. цветную вклейку). Пациентке назначен клопидогрель в суточной дозе 75 мг.
Вторым этапом после полной стабилизации общего состояния была выполнена операция по поводу АБОА. 26.07.13 из левостороннего торакофренолапаротомного доступа по десятому межреберью произведено бифуркационное аортоподвздошное протезирование бифуркационным протезом Васкутек 20×10×10 (рис. 2, В, Г, см. цветную вклейку). Атеросклеротическая аневризма инфраренальной аорты диаметром около 7 см. Атеросклероз в стадии атероматоза и атерокальциноза с разрушенной задней стенкой аневризмы.
В послеоперационном периоде у больной отмечалась анемия — Hb 7,9 г/дл (исходно Hb 8,4 г/дл ). АД 124/52 мм рт.ст., ЧCC 49 уд/мин. На ЭКГ по сравнению с исходной снижение вольтажа комплексов QRS и отрицательные зубцы Т в отведениях V4—V6. Проводилась инфузия изосорбида динитрата в дозе 100 нг/кг/мин, выполнена трансфузия одногруппной эритроцитной массы в количестве 650 мл. Состояние оставалось стабильным. На фоне инфузии нитратов на ЭКГ отмечена положительная динамика — зубцы Т вернулись к исходной картине. Учитывая исходную железодефицитную анемию, пациентке провели внутривенную инфузию железа (III) гидроксид сахарозного комплекса в дозе 800 мг. Показатели коагулограммы, кислотно-щелочного состояния и электролиты в пределах нормы. Живот мягкий, не вздут, перистальтика ослаблена. Диурез по мочевому катетеру соответствовал водной нагрузке. Проводились плановая терапия, мониторинг кардиореспираторных и метаболических показателей. Выписана на 14-е сутки после операции в удовлетворительном состоянии. АД 125/80 мм рт.ст., ЧСС 73 уд/мин, ЧДД 17 в минуту. Живот не вздут, перистальтика отчетливая, стул ежедневный, оформленный. Швы без воспалительных проявлений, сняты в срок. По данным контрольного УЗИ брюшной полости, в брюшной полости и полости малого таза свободной жидкости не определяется. При контрольной МСКТ хорошо виден бифуркационный аортоподвздошный протез без признаков стенозов (рис. 2. Е, см. цветную вклейку).
Идеальными для группы больных с атеросклеротическими АБОА в сочетании с ИБС являются рентгенэндоваскулярные вмешательства как на КА, так и на аорте, которые обладают минимальной травматичностью по сравнению с открытыми операциями. Однако, к сожалению, они не всегда выполнимы. Существуют определенные показания и ограничения для рентгенохирургических операций.
В настоящее время показания к коронарной ангиопластике и стентированию КА у пациентов со стабильным течением ИБС можно разделить на 2 большие группы: для улучшения качества жизни пациентов и для увеличения ее продолжительности. При этом последнее показание имеет весьма ограниченную доказательную базу в этой группе больных. Основными показаниями с точки зрения улучшения качества жизни являются ангиографически значимые поражения коронарного русла (>70%), подтвержденные данными функциональных тестов о наличии ишемии миокарда. Кроме того, с прогностической точки зрения эффективность чрескожных вмешательств у больных ИБС оправдана при распространенности поражений, соответствующих низкой (<22 баллов) и средней (22—32 балла) оценкам по шкале SYNTAX. В большинстве других случаев АКШ остается методом выбора реваскуляризации миокарда у данных пациентов.
Эндоваскулярное протезирование при инфраренальных аневризмах аорты также имеет ограничения. Отбор пациентов осуществляется на основании данных МСКТ, при которой определяются анатомические особенности пациента, влияющие на подбор графта. Идеальными кандидатами для эндоваскулярного протезирования являются пациенты с малоизмененной инфраренальной шейкой (минимум 10—15 мм), а также с анатомией подвздошно-бедренного сегмента, позволяющей осуществить доставку графтов. Наличие выраженных ангуляций, кальциноза, пристеночного тромбоза инфраренальной шейки, недостаточный диаметр подвздошно-бедренного сегмента или распространенное стенозирование существенно уменьшают число кандидатов, которым возможно выполнить эндоваскулярное протезировние аорты. Остальным пациентам выполняются реконструктивные операции на аорте.
Таким образом, больным с МФА, АБОА и ИБС показано хирургическое лечение. Этапные вмешательства более безопасны для этих пациентов, ввиду ограниченных резервных возможностей организма в связи с возрастом и сопутствующими заболеваниями. В качестве щадящей формы вмешательства, в первую очередь, следует рассматривать рентгенэндоваскулярные методы, применительно как к КА, так и к брюшной аорте. В случае необходимости проведения открытых хирургических операций следует стараться избегать кровопотерь, сокращать продолжительность операции и использовать по показаниям хирургические мини-доступы.



