С учетом сохраняющейся высокой сердечно-сосудистой заболеваемости и смертности, несмотря на широкое внедрение профилактических мероприятий, существует необходимость разработки патофизиологических моделей высокого риска развития сердечно-сосудистых заболеваний (ССЗ), основанных на новых концепциях [1]. Одной из таких концепций в последнее десятилетие становится раннее сосудистое старение, ядром которого служат жесткость артериальной стенки (ЖАС), соотнесенная с хронологическим возрастом пациента, гипертрофия сосудистой стенки и дисфункция эндотелия (ДЭ) [2]. Эти параметры, которые можно рассматривать как «тканевые» биомаркеры состояния артериальной стенки, являются более информативными, чем «циркулирующие» биомаркеры крови, и способны обеспечить более точное прогнозирование риска развития ССЗ в сочетании с классическими «рискометрами» [3].
Возрастные изменения архитектоники крупных эластических артерий, выражающиеся в фиброзно-склеротическом утолщении интимы и медии, увеличении количества внеклеточного матрикса, гладких мышечных клеток, разнонаправленных изменениях в количестве коллагена и эластина в сторону преобладания первого, в результате чего градиент ЖАС инвертируется от периферии к центру [4], известны при нормальном процессе старения [5]. Результаты самого крупного исследования позволили установить нормальные и референсные значения показателя каротидно-феморальной скорости пульсовой волны (СПВ) для каждого возрастного диапазона лиц без факторов риска (ФР) развития ССЗ и без симптомов ССЗ [6].
В то же время при воздействии различных ФР развития ССЗ процессы сосудистого ремоделирования начинают развиваться в более раннем возрасте. Раннее сосудистое старение может быть верифицировано в случае превышения более чем на 2 стандартных отклонения каротидно-феморальной СПВ, определенной в качестве нормальной для соответствующей возрастной группы, или при выявлении каротидно-феморальной СПВ, превышающей значение 90-го перцентиля для данного возрастного диапазона [2, 6].
 В Консенсусе европейских экспертов по вопросам использования параметров ЖАС в процессе диагностики и лечения (2012) отмечено, что измерение каротидно-феморальной СПВ имеет существенные преимущества перед оценкой классических ФР, так как напрямую отражает существующее поражение сосудистой стенки [7]. Результаты мета-анализа 16 популяционных исследований, включивших 17 635 пациентов, показали, что каротидно-феморальная СПВ является независимым ФР смерти от всех заболеваний и от ССЗ, а использование этого показателя позволяет улучшить прогнозирование в первую очередь при исходно «невысоком» риске развития ССЗ [8].
В Консенсусе европейских экспертов по вопросам использования параметров ЖАС в процессе диагностики и лечения (2012) отмечено, что измерение каротидно-феморальной СПВ имеет существенные преимущества перед оценкой классических ФР, так как напрямую отражает существующее поражение сосудистой стенки [7]. Результаты мета-анализа 16 популяционных исследований, включивших 17 635 пациентов, показали, что каротидно-феморальная СПВ является независимым ФР смерти от всех заболеваний и от ССЗ, а использование этого показателя позволяет улучшить прогнозирование в первую очередь при исходно «невысоком» риске развития ССЗ [8].
В рекомендациях Европейского общества кардиологов по артериальной гипертензии — АГ (2013) пороговая величина каротидно-феморальной СПВ 10 м/с выбрана в качестве критерия субклинического сосудистого поражения [9].
Другие показатели также могут быть использованы в качестве суррогатного маркера ЖАС, но их прогностические уровни пока не определены. Среди них систолическое артериальное давление (САД) в аорте, которое позволяет точнее оценить истинное артериальное давление (АД), воздействующее на органы-мишени, и индекс аугментации, несущий информацию об отраженных волнах, которые приводят к увеличению центрального АД [10].
В свою очередь, висцеральное ожирение (ВО) является фактором прогрессирования фиброза сосудистой стенки, ускоряя связанное с возрастом увеличение ЖАС [11], а адипокины дисфункциональной висцеральной жировой ткани рассматриваются в качестве одного из основных патогенетических факторов ремоделирования сердечно-сосудистой системы [12].
Ранее нами были определены пороговые величины толщины эпикардиального жира (ТЭЖ), предложенные в качестве прямого критерия ВО у пациентов без симптомов ССЗ в возрасте от 31 года до 55 лет [13].
Целью настоящего исследования являлся сравнительный анализ параметров ремоделирования сосудистого русла в зависимости от наличия ВО, определяемой с помощью эхокардиографической оценки ТЭЖ.
Материал и методы
В исследование были включены 163 пациента в возрасте от 31 года до 55 лет с нормальным АД (74,8% мужчин, средний возраст 45,0±5,4 года).
Для исключения влияния АГ на процессы ремоделирования сосудов, а также возраста, по достижении которого пороговая величина каротидно-феморальной СПВ 10 м/с перестает быть критерием раннего сосудистого старения [6], в данное исследование были включены пациенты не старше 55 лет с нормальным АД, без симптомов ССЗ.
Пациентов считали не страдающими АГ, если среднесуточное САД составляло менее 130 мм рт.ст. и среднесуточное диастолическое АД (ДАД) — менее 80 мм рт.ст., по данным суточного мониторирования АД (СМАД) [9], и при этом они не получали гипотензивной терапии.
 Протокол лабораторного обследования включал оценку липидного состава крови и глюкозы, уровня мочевой кислоты и фибриногена в крови, скорости клубочковой фильтрации (СКФ). При оценке показателей липидного и углеводного обменов руководствовались диагностическими критериями для лиц без ССЗ [9]. Все пациенты характеризовались низким или умеренным риском по шкале SCORE.
Протокол лабораторного обследования включал оценку липидного состава крови и глюкозы, уровня мочевой кислоты и фибриногена в крови, скорости клубочковой фильтрации (СКФ). При оценке показателей липидного и углеводного обменов руководствовались диагностическими критериями для лиц без ССЗ [9]. Все пациенты характеризовались низким или умеренным риском по шкале SCORE.
Всем обследуемым выполняли эхокардиографию (ЭхоКГ), триплексное сканирование брахиоцефальных артерий (ТС БЦА), бифункциональное СМАД с оценкой показателей ригидности артерий.
ЭхоКГ выполняли на аппарате Logiq 5 датчиком 3,5 МГц в М-модальном и двухмерном режимах в стандартных позициях. Эпикардиальный жир, который определялся как эхонегативное пространство между стенкой миокарда и висцеральным листком перикарда, визуализировали за свободной стенкой правого желудочка в В-режиме с использованием парастернальной позиции по длинной оси левого желудочка в конце систолы по линии, максимально возможно перпендикулярной аортальному кольцу, которое использовали как анатомический ориентир [14]. ВО верифицировали при ТЭЖ≥75-го перцентиля в подгруппах пациентов 31—45 лет с абдоминальным ожирением — АО (4,8 мм) и без АО (3,5 мм), 46—55 лет с АО (5,8 мм) и без АО (4,4 мм) [13].
ТС БЦА проводили на аппарате Logiq 5 линейным датчиком 10 МГц с применением импульсно-волнового режима и режима цветового допплеровского картирования. Измеряли толщину интимы—медии (ТИМ) билатерально в дистальной трети общей сонной артерии (СА), в области бифуркации общей СА и в проксимальной трети внутренней СА. За максимальную величину ТИМ СА принимали наибольшее значение среди указанных локализаций, пороговым значением считали 0,9 мм.
Критериями наличия атеросклеротической бляшки в СА являлись локальное утолщение участка артерии более чем на 0,5 мм или на 50% по сравнению с окружающими участками или утолщение участка артерии ≥1,5 мм с протрузией его в сторону просвета сосуда [9].
СМАД проводили с помощью монитора BPlab МнСДП-3 (ООО «Петр Телегин», Россия). Анализ ригидности артерий выполняли с использованием технологии Vasotens [15], оценивали среднесуточную СПВ в аорте (м/с), индекс аугментации, среднесуточное САД в аорте. При этом определяемая данным методом величина СПВ в аорте ≥7,9 м/с соответствовала каротидно-феморальной СПВ>10 м/с [15] и в данном исследовании рассматривалась как критерий раннего сосудистого старения для выбранного возрастного диапазона пациентов.
Статистическую обработку данных осуществляли с помощью пакетов программ Statistica 7.0, SPSS 17.0. Описательная статистика выполнена с использованием средних арифметических значений и стандартных отклонений, для качественных данных определялись частоты (%). Статистическую значимость различий между группами оценивали с помощью двустороннего t-критерия Стьюдента, χ2-критерия Пирсона. Для оценки зависимости изучаемого показателя от нескольких факторов использовали многофакторный линейный регрессионный анализ. Различия считали статистически значимыми при p<0,05.
 Результаты
Результаты
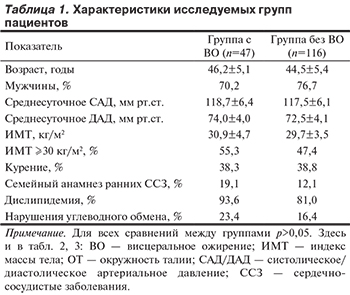
Пороговая величина ТЭЖ как прямой критерий ВО была выявлена у 47 (28,8%) пациентов. В табл. 1 отражены клинико-демографические характеристики и ФР развития ССЗ в группах пациентов с наличием/в отсутствие прямого критерия ВО.
Как представлено в табл. 1, группы были полностью сопоставимы по полу и возрастному составу, уровням среднесуточного САД и ДАД, индексу массы тела (ИМТ) и проценту лиц с ИМТ≥30 кг/м2, а также наличию ФР развития ССЗ: курения, семейного анамнеза ранних ССЗ, дислипидемии, нарушений углеводного обмена.
Нами были проанализированы параметры ремоделирования сосудов в данных группах пациентов (табл. 2).
Как показано в табл. 2, в группе пациентов с ВО были выявлены достоверно более высокие значения максимальной ТИМ СА (р<0,001), СПВ в аорте (р<0,001), индекса аугментации (р<0,001), среднесуточного САД в аорте (р<0,01), чаще выявлялась СПВ в аорте, соответствующая критерию раннего сосудистого старения для данного возрастного диапазона (р<0,001), ТИМ СА, превышающая половозрастную норму (р<0,001), ТИМ СА>0,9 мм (р<0,001).
Нами также был проведен сравнительный анализ параметров ремоделирования сосудов в группах лиц с ВО и АО, диагностированным по величине окружности талии (ОТ)>94 см у мужчин и >88 см у женщин [16] и выявленным у 132 (81%) пациентов. Результаты представлены в табл. 3.
Группу лиц с ВО по сравнению с пациентами с АО отличали более высокие значения максимальной ТИМ СА (р<0,05), СПВ в аорте (р<0,05), индекса аугментации (р<0,05), среднесуточного САД в аорте (р<0,05). Кроме того, среди лиц с ВО чаще выявлялась СПВ в аорте, соответствующая критерию раннего сосудистого старения для данного возрастного диапазона (р<0,01), ТИМ СА, превышающая половозрастную норму (р<0,05), ТИМ СА>0,9 мм (р<0,01).
У лиц с ВО при наличии критерия раннего сосудистого старения в 66,7% случаев был выявлен субклинический атеросклероз СА, у лиц с АО — в 36% случаев (р<0,01).
Для количественного определения зависимости СПВ в аорте от нескольких предикторов был выполнен многофакторный линейный регрессионный анализ с пошаговым выведением уравнения прогностической оценки СПВ в аорте. В качестве возможных предикторов были выбраны возраст пациентов, ИМТ, ОТ и ТЭЖ, значения метаболических ФР (уровни глюкозы, липидов, мочевой кислоты, фибриногена крови), СКФ, уровни среднесуточного САД и ДАД. Значения итоговых коэффициентов пошаговой многофакторной линейной регрессии представлены в табл. 4. Полученное регрессионное уравнение прогностической оценки величины СПВ в аорте выглядит следующим образом:
СПВ в аорте=САД×0,023+ДАД×0,036+возраст×0,021+[«сахар»]×0,134+ТЭЖ×0,139,
где САД/ДАД — систолическое/диастолическое АД (мм рт.ст.), [«сахар»] — концентрация глюкозы крови натощак (ммоль/л), ТЭЖ — толщина эпикардиального жира (мм).
 Уровень значимости каждого предиктора, включенного в прогностическую модель оценки величины СПВ в аорте, составил менее 0,01. Для данной регрессионной модели коэффициент детерминации составил 0,9, что свидетельствует о ее соответствии фактическим данным. Для практического применения предлагаемой математической модели создан вероятностный калькулятор расчета СПВ в аорте на базе табличного редактора MS Exсel в составе стандартного пакета программ MS Office 2007, использующий указанное выше уравнение, в которое вносятся числовые характеристики предикторов, а прогнозируемая величина СПВ в аорте отображается в числовом выражении автоматически.
Уровень значимости каждого предиктора, включенного в прогностическую модель оценки величины СПВ в аорте, составил менее 0,01. Для данной регрессионной модели коэффициент детерминации составил 0,9, что свидетельствует о ее соответствии фактическим данным. Для практического применения предлагаемой математической модели создан вероятностный калькулятор расчета СПВ в аорте на базе табличного редактора MS Exсel в составе стандартного пакета программ MS Office 2007, использующий указанное выше уравнение, в которое вносятся числовые характеристики предикторов, а прогнозируемая величина СПВ в аорте отображается в числовом выражении автоматически.
Обсуждение
ЖАС рассматривается как центральный критерий сосудистого старения, как один из недостающих факторов в глобальной стратификации риска развития ССЗ [1]. Возраст наряду с уровнем АД является одним из основных предикторов ЖАС [6]. При этом вклад других ФР в величину параметров жесткости сосудов недостаточно изучен.
Поскольку ЖАС является кумулятивной мерой повреждающего воздействия ФР и старения на артериальную стенку, концепция раннего сосудистого старения представляет собой рабочую модель для лучшего понимания процессов, приводящих к увеличению риска развития ССЗ, объединяя долгосрочные последствия всех выявленных и неидентифицированных факторов [17].
Дисфункциональная висцеральная жировая ткань при ВО, в том числе в составе эктопических жировых депо, характеризующаяся увеличением секреции проатерогенных, провоспалительных и протромботических адипокинов, является одним из факторов, приводящих к раннему ремоделированию сосудов. В данном исследовании мы показали, что без статистически значимых различий по половозрастному составу, уровням АД и частоте ФР развития ССЗ пациенты с эпикардиальным ожирением отличались более высокой частотой выявления основного критерия раннего сосудистого старения — повышенной СПВ в аорте (63,8% против 24,1%; р<0,001), а также более высокими индексом аугментации, среднесуточным САД в аорте, ТИМ СА, что согласуется с результатами ранее проведенных исследований, показавших наличие ассоциации эпикардиальной жировой ткани с параметрами ЖАС [18, 19].
Сравнительный анализ параметров ремоделирования сосудов в группах лиц с прямым критерием ВО (ТЭЖ) и косвенным критерием ВО (АО, ОТ) показал, что оценка эктопических жировых депо, в частности эпикардиального, как метод прямого определения висцеральной жировой ткани является более точным по сравнению с показателем ОТ– предиктором нарушенной морфологии сердечно-сосудистой системы и высокого риска развития ССЗ. Это может объясняться большей ассоциацией показателя ОТ с количеством метаболически нейтральной подкожно-жировой клетчатки и свидетельствовать о его более низкой чувствительности при выделении лиц высокого риска развития ССЗ [13].
В связи с тем что ЭхоКГ является широко доступной методикой и имеет меньшую стоимость по сравнению с другими методами определения висцеральной жировой ткани, хорошую воспроизводимость результатов, а также обеспечивает клинициста информацией об анатомических и функциональных параметрах сердца, она является привлекательным инструментом оценки истинной выраженности ВО, в первую очередь у пациентов с АО, а вместе с тем прогнозирования наличия субклинических сосудистых поражений и высокого риска развития ССЗ.
В ходе многофакторного линейного регрессионного анализа нами было показано, что для прогностической оценки СПВ в аорте, кроме возраста и АД, имеют значение уровень глюкозы крови натощак и ТЭЖ как прямой критерий выраженности ВО.
Таким образом, наличие прямых критериев ВО, в частности пороговой величины ТЭЖ, должно стать основанием для скрининга сосудистых поражений, являющихся критериями высокого риска развития ССЗ. В свою очередь, при наличии показаний к СМАД проведение бифункционального СМАД с оценкой показателей жесткости сосудов у пациентов с ВО является более предпочтительным методом, позволяющим получить дополнительную информацию, необходимую для последующей стратификации риска развития ССЗ.
Заключение
У пациентов с висцеральным ожирением, диагностированным с помощью эхокардиографической оценки толщины эпикардиального жира, частота выявления параметров раннего сосудистого старения оказалась выше, в том числе по сравнению с лицами с абдоминальным ожирением, что подчеркивает преимущество прямого определения висцеральной жировой ткани. Для прогностической оценки величины скорости пульсовой волны в аорте наибольшее значение имеют возраст, уровни артериального давления, глюкозы в крови натощак и оценка толщины эпикардиального жира как индикатора выраженности висцерального ожирения. Наличие прямых критериев висцерального ожирения, в частности пороговой величины толщины эпикардиального жира, должно стать основанием для скрининга сосудистых поражений.
Работа выполнена в рамках Программы стратегического развития ФГБОУ ВПО «Петрозаводский государственный университет».



