Совершенствование подходов к профилактике и лечению сердечно-сосудистых заболеваний (ССЗ) остается наиболее актуальной проблемой современной медицины. Продолжается поиск новых ориентиров для стратификации риска и выбора адекватных целей для терапевтических вмешательств. В целях оценки риска все чаще предлагается ориентироваться на поражение органов-мишеней [1, 2].
Накапливается все больше информации об участии гликации в процессах развития и атеросклероза. Гликация обусловлена способностью глюкозы создавать с аминогруппами различных белков и, возможно, с ДНК, различные соединения, которые служат исходным материалом для образования необратимых в химических реакциях веществ, названных конечными продуктами гликации (КПГ) [3]. КПГ могут запускать множество аномальных процессов в клетках и тканях, приводящих к морфофункциональным изменениям сосудистой стенки (дисфункции эндотелия, снижению эластичности и др.) и способствующих ускоренному развитию атеросклероза [4, 5].
Значение гликации очевидно при состояниях, сопровождающихся повышением уровня глюкозы в крови (сахарный диабет, метаболический синдром) [6—8]. Однако полученные к настоящему времени экспериментальные и клинические данные свидетельствуют о ключевой роли этого патофизиологического процесса в развитии сосудистых осложнений не только при нарушениях углеводного обмена, но и при других состояниях: хронической почечной недостаточности (ХПН) [9], периферическом атеросклерозе [10]. С учетом важного вклада гликации в изменение структуры и функции сосудистой стенки определение КПГ представляется перспективным методом оценки ее состояния.
Ранее в арсенале специалистов имелись лишь сложные и малоприменимые методы определения КПГ в плазме и кожном биоптате, что ограничивало использование КПГ в исследованиях и повседневной практике. В настоящее время появилось доступное диагностическое устройство, которое неинвазивно измеряет содержание КПГ в тканях — AGE-reader [11]. В основе действия прибора лежит метод флюоресценции в ультрафиолетовом свете. Прибор прошел клиническую валидацию: показатели кожной аутофлюоресценции (АФ), полученные с помощью AGE-reader, продемонстрировали тесную корреляцию с количеством КПГ, которое определено в биоптате, взятом на том же участке кожи у здоровых лиц [11], больных сахарным диабетом (СД) [11], ХПН [12].
Имеются доказательства независимого прогностического значения показателей кожной АФ у больных СД [6, 13, 14], ХПН [15, 16], периферическим атеросклерозом [10] и инфарктом миокарда [17]. В то же время общепризнанным независимым предиктором сердечно-сосудистых осложнений (ССО) у больных ССЗ является повышение скорости пульсовой волны (СПВ) — «золотого стандарта» определения жесткости артерий [18, 19]. Однако имеются лишь единичные работы, посвященные исследованию взаимосвязи уровня КПГ (в плазме и определенного методом кожной АФ) с жесткостью артерий у больных без СД [20—23].
Целью настоящего исследования явилось изучение взаимосвязи между уровнем КПГ, определенным методом кожной АФ (КПГаф), и жесткостью сосудистой стенки, оцененной по СПВ, у больных ССЗ без СД.
Материал и методы
В исследование были включены 93 пациента, наблюдавшихся в научно-диспансерном отделе Института клинической кардиологии им. А.Л. Мясникова РКНПК МЗ РФ: 28 больных ишемической болезнью сердца (ИБС) и 65 больных без ИБС с умеренным или высоким риском ССО. Риск развития ССО определяли по принятой международной системе SCORЕ. Клинико-демографическая характеристика больных представлена в табл. 1.
Критериями исключения являлись СД, острый коронарный синдром, хроническая сердечная недостаточность III—IV функционального класса, ХПН и хроническая печеночная недостаточность, острые воспалительные и инфекционные заболевания.
Всем больным проводили комплексное обследование, включающее осмотр, сбор анамнеза, измерение артериального давления (АД), биохимический анализ крови, включающий определение общего холестерина (ОХС), триглицеридов (ТГ), глюкозы, креатинина.
Содержание КПГ измеряли методом определения АФ кожи с использованием анализатора КПГ (AGE-reader, «DiagnOptic», Голландия) и выражали в условных единицах (усл. ед.).
Жесткость магистральных артерий изучали посредством определения скорости распространения пульсовой волны «плечелодыжечным» методом (СПВпл) с помощью объемной сфигмографии на приборе Vasera VS-1000 («Fukuda Denshi», Япония) после 10-минутного отдыха в горизонтальном положении [24, 25].
Статистическую обработку данных проводили с использованием пакета программы Statistica 8.0. Данные представляли как М±SD и как Mе (-95%ДИ; 95%ДИ) в зависимости от типа распределения исследуемой величины. При сравнении групп пациентов использовали критерий t Стьюдента или критерий U Манна—Уитни в зависимости от характера распределений. Статистически значимыми считали различия при p<0,05. Для статистического описания связи между различными параметрами вычисляли коэффициент корреляции Спирмена. Независимый характер связи изученных клинико-инструментальных показателей оценивали в регрессионной модели с использованием многофакторного пошагового анализа.
Результаты
Группы больных с ИБС и без нее были сопоставимы по полу, доле больных артериальной гипертензией (АГ), курящих и некурящих, изучаемым гемодинамическим и биохимическим показателям. Не было различий между группами по частоте приема ингибиторов ангиотензинпревращающего фермента (АПФ) или блокаторов рецепторов ангиотензина II (БРА), антагонистов кальциевых каналов, диуретиков (см. табл. 1). Как и следовало ожидать, больные ИБС были старше, чаще получали терапию статинами и дезагрегантами, чем больные без ИБС.
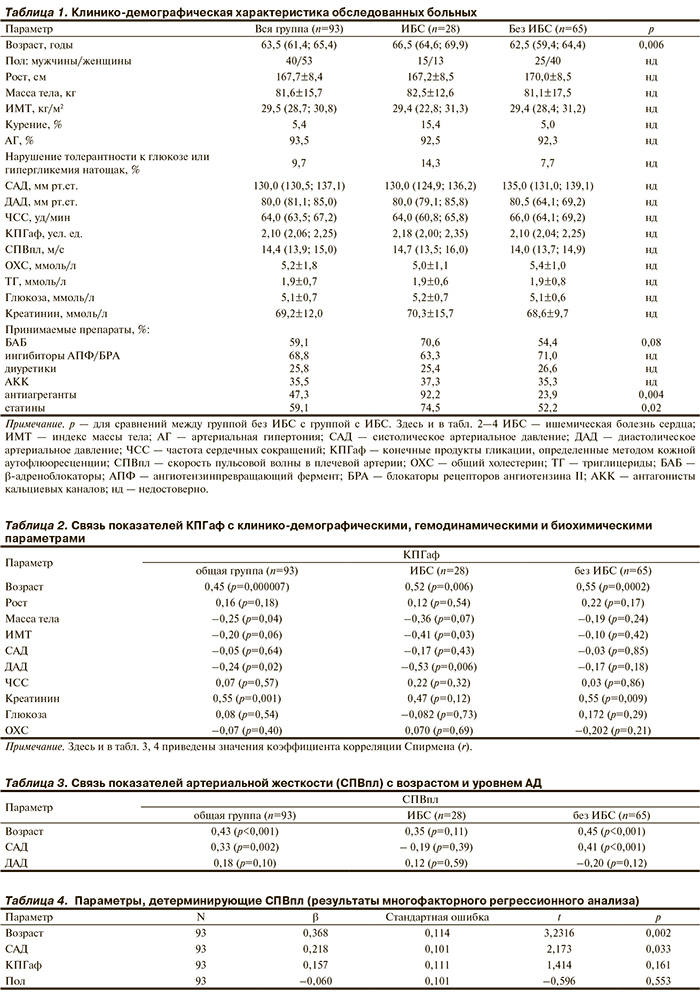
Большинство пациентов получали адекватную гипотензивную терапию, что объясняет не превышающий норму уровень АД в исследованных группах. В то же время СПВпл составила 14,4 (13,9; 15,0) м/с в общей группе. Не выявлено статистически значимых различий по СПВпл между группами больных с ИБС и без ИБС. Уровень КПГаф в общей группе составил 2,10 (2,06; 2,25) усл. ед. (см. табл. 1). Выявлена статистически значимая положительная корреляция между КПГаф и СПВпл (r=0,32; p=0,003).
Кроме того, продемонстрирована положительная ассоциация показателей КПГаф с возрастом (r=0,46; p<0,0001) и уровнем креатинина плазмы (r=0,55; p=0,001) и отрицательная — с уровнем диастолического артериального давления — ДАД (r=–0,24; p=0,02) и массой тела (r=–0,25; p=0,04). Не выявлено связи с уровнем систолического артериального давления (САД) и биохимическими параметрами (табл. 2).
У больных без ИБС обнаружена тесная позитивная корреляция КПГаф с СПВпл (r=0,44; p=0,0003), а также с возрастом (r=0,55; p=0,0002) и концентрацией креатинина в крови (r=0,50; p=0,009). Напротив, в группе больных ИБС корреляция КПГаф и СПВпл не прослеживалась (r=–0,04; p=0,861). Продемонстрирована прямая взаимосвязь КПГаф с возрастом (r=0,52; p=0,006) и обратная с ИМТ (r=–0,41; p=0,03) и ДАД (r=–0,53; p=0,006; см. табл. 2).
Помимо ассоциации с показателями КПГаф проведенный корреляционный анализ выявил связь СПВпл с возрастом (r=0,43; p<0,001) и величиной САД (r=0,33; p=0,002). При анализе в группах данные закономерности прослеживались только у больных с умеренным и высоким риском развития ССО без ИБС (табл. 3). Затем для определения характера влияния КПГаф на СПВпл был проведен многофакторный анализ. В математическую модель помимо КПГаф, возраста и САД, имевших положительную корреляцию с СПВпл в однофакторном анализе, был включен пол пациентов. Показатели КПГаф не продемонстрировали независимого статистически значимого влияния на СПВпл, в то время как уровень САД и возраст пациентов оказались независимыми детерминантами СПВпл (табл. 4).
Обсуждение
Эластичность сосудистой стенки зависит от комплекса внутренних и внешних факторов и определяется не только величиной внешнего давления, функцией эндотелия, сосудистым тонусом, но и собственной структурой [26]. Среди структурных факторов большое значение придается повреждению матриксных белков сосудистой стенки путем образования неферментных сшивок между глюкозой (или другими сахарами) и аминогруппами, в результате чего образуются КПГ. Последние накапливаются на длительно живущих белках — коллагене и эластине, нарушая их функциональное состояние и способствуя тем самым возрастанию ригидности сосудистой стенки [5, 26—28]. Кроме того, КПГ негативно влияют на функцию эндотелия, могут увеличивать образование окисленных молекул, стимулировать воспалительные реакции [29, 30].
Таким образом, полученная в нашем исследовании связь уровня КПГ, оцененного методом кожной АФ, и СПВ была ожидаемой и закономерной. В литературе описана ассоциация между содержанием КПГ в плазме и СПВ у пациентов молодого возраста, страдающих АГ [20]. Аналогичные данные получены при обследовании здоровых лиц [22]. В настоящее время опубликованы результаты единичных работ, посвященных исследованию взаимосвязи аккумуляции КПГ в коже, определяемой методом АФ, со СПВ. В исследовании G. Watfa и соавт. [23], включавшем 116 пациентов без СД, продемонстрирована положительная корреляция между СПВ и показателями кожной АФ. Важно отметить, что эта зависимость была достоверной только в группе пациентов моложе 65 лет (средний возраст 49,1±10,4 года) и отсутствовала у более пожилых лиц (средний возраст 77,5±8,4 года). Как и в нашем исследовании, показатель КПГаф не проявил себя независимым предиктором величины СПВ. В работе H. Ueno и соавт. [21] ассоциация между жесткостью артериальной стенки и показателями КПГаф изучалась у 120 пациентов с терминальной стадией ХПН без СД в сравнении с контрольной группой, включавшей 110 человек, сопоставимых по возрасту и полу, без СД и почечных заболеваний. В контрольной группе получены результаты, аналогичные изложенным выше, — умеренная корреляция СПВ и КПГаф при однофакторном анализе, исчезающая при внесении в математическую модель поправки на возраст, уровень АД и других параметров. Таким образом, оба исследования подтверждают взаимосвязь жесткости сосудистой стенки с накоплением КПГ в тканях, причем именно у относительно здоровых лиц (без ИБС, СД, ХПН), не достигших пожилого возраста.
Накопление КПГ и потеря сосудами эластичности являются неотъемлемой частью процесса естественного старения организма [28, 31]. В настоящее время убедительно доказано, что СПВ как показатель ригидности артерий кардинально зависит от возраста и уровня АД [24, 32]. В упомянутой работе G. Watfa и соавт. выявлены высоко достоверные различия показателей КПГаф в разных возрастных группах больных. Подтверждение повышенного накопления КПГ, определенного методом КПГаф, с возрастом мы находим и в работах других авторов [33, 34].
В нашем исследовании продемонстрирована тесная корреляция КПГаф с возрастом пациентов, значимая в группах больных с ИБС и без ИБС. В то же время возраст и уровень САД пациентов проявились как независимые детерминанты СПВпл. Характерное для лиц пожилого возраста снижение ДАД и увеличение пульсового давления являются суррогатными индикаторами повышения ригидности центральных артерий [35]. Это объясняет полученную в нашем исследовании отрицательную корреляцию КПГаф с ДАД, особенно тесную в группе больных ИБС.
Заключение
Нами выявлена ассоциация между уровнем конечных продуктов гликации, определенных методом кожной аутофлюоресценции, и показателем сосудистой жесткости — скоростью пульсовой волны на плечелодыжечном сегменте у больных из группы умеренного и высокого риска без сахарного диабета. Однако уровень конечных продуктов гликации, определенных методом измерения кожной аутофлюоресценции, не является независимой детерминантой скорости пульсовой волны на плечелодыжечном сегменте в отличие от возраста и систолического артериального давления. Наше исследование является пилотным. Для оценки возможности использования метода аутофлюоресценции для уточнения степени индивидуального риска развития сердечно-сосудистых осложнений у различных категорий больных потребуются крупные проспективные исследования. Сочетание легкодоступных неинвазивных методов исследования — кожной аутофлюоресценции и сфигмографии — также может оказаться полезным в клинической практике для раннего выявления признаков старения сосудистой стенки.



