Псориаз — одно из наиболее распространенных заболеваний кожи, распространенность которого в общей популяции составляет 1,5—3% и почти 20% — среди пациентов дерматологических стационаров [1, 2]. Предполагают, что псориаз является аутоиммунным заболеванием, при котором презентация антигенов Т-хелпера запускает секрецию провоспалительных цитокинов, которые приводят к пролиферации кератиноцитов и экспрессии молекул адгезии на эндотелиальных клетках [3]. Эти изменения привлекают другие эффекторные Т-клетки из микроциркуляторного русла [4], которые в свою очередь активируются и приводят к секреции еще большего количества цитокинов [5, 6].
По данным многочисленных исследований, при псориазе поражаются не только кожа, но и ряд других органов и систем организма. Одно из распространенных проявлений псориатической болезни — поражение сердечно-сосудистой системы (почти 39% пациентов) [7]. Наиболее часто при псориазе встречается артериальная гипертония — АГ (29%, что в 1,5 раза больше, чем в общей популяции) [8, 9], нарушения углеводного и липидного обмена [10, 11] и поражение клапанов сердца.
В последние годы все больше внимания уделяется применению при различных сердечно-сосудистых заболеваниях ингибиторов 3-гидрокси-3-метилглютарил коэнзим А-редуктазы (ГМГ-КоА-редуктазы) — статинов. На основании результатов многоцентровых исследований статины стали неотъемлемой составляющей первичной и вторичной профилактики ишемической болезни сердца (ИБС) [12—16]. В ряде работ отмечалось благоприятное действие аторвастатина на уровень артериального давления (АД), даже в случаях резистентной АГ [17, 18]. Вместе с тем выявляются новые независимые от липидов эффекты статинов [19, 20]. Накапливается все больше доказательств иммуномодулирующей активности статинов [21, 22]. Статины обладают способностью снижать экспрессию и действие различных молекул на поверхности лейкоцитов [23]. Кроме того, отмечено, что статины обладают способностью снижать экспрессию молекул адгезии, внутриклеточный белок адгезии (ICAM-1), белок хемотаксиса моноцитов 1-го типа (МАС-1), лейкоцитарный функциональный антиген (LFA-1), а также блокируют секрецию некоторых провоспалительных цитокинов, таких как α-фактор некроза опухоли (ФНО-α) и γ-интерферон [24, 25]. Учитывая описанные эффекты статинов, а также безопасность их использования, мы провели исследование по оценке эффективности и безопасности применения аторвастатина в комплексном лечении распространенного псориаза у больных АГ.
Материал и методы
В исследование были включены 63 мужчины с распространенным псориазом и АГ, средний возраст которых составил 55,0±11,6 года.
Средняя длительность псориаза достигала 13 (4,0; 30,0) лет. При этом сезонный фактор имел значение у 21 (33,3%) пациента. У 45 (71,4%) больных отмечались повторные госпитализации в связи с обострением псориаза в течение последних 3 лет. Средняя распространенность псориаза по шкале PASI составила 22,2 (13,4; 24,6) балла.
У 19 (30,2%) пациентов выявлена I степень АГ, у 26 (41,2%) — II, у 18 (28,6%) — III. Длительность АГ составила 7,2±4,8 года.
Степень риска развития сердечно-сосудистых осложнений оценена как очень высокая у 20 (31,75%), высокая — у 24 (38,1%) и средняя — у 19 (30,2%) больных.
Выявлены следующие факторы риска: курение — у 45 (71,4 %), ожирение — у 26 (41,3%), сопутствующие заболевания — у 77 (46,1%) больных.
Заболевания желудочно-кишечного тракта (хронический гастрит, хронический холецистит, язвенная болезнь желудка и двенадцатиперстной кишки) имелись у 18 (28,5%) больных, заболевания дыхательной системы — у 24 (38,1%), опорно-двигательного аппарата — у 20 (31,7%).
При анализе особенностей медикаментозного лечения отмечено, что ингибиторы ангиотензинпревращающего фермента получали 47 (74,6%) пациентов, β-адреноблокаторы — 20 (31,3%), антагонисты кальция — 4 (6,3%), диуретики — 20 (31,3%).
Всем пациентам проводили стандартное лечение псориаза в условиях дерматологического стационара: препараты кальция, тиосульфат натрия, АТФ, витамины группы В, гепатопротекторы, наружная терапия (2% салициловая мазь на гладкую кожу, 2% серно-салициловая мазь на волосистую часть головы). После выписки из стационара всем пациентам рекомендовали продолжение наружной терапии (нестероидные мази).
В рамках настоящего исследования оценивали эффективность и безопасность аторвастатина в комплексном лечении больных распространенным псориазом и АГ. В связи с этим все больные были рандомизированы на 2 группы: 48 больным, включенным в 1-ю группу, дополнительно к стандартной терапии был назначен аторвастатин (аторис, КРКА) в суточной дозе 20 мг; 15 больных, составивших контрольную группу, получали только базисную терапию псориаза и АГ.
Вышеописанное лечение продолжалось в течение 6 мес. Клинико-функциональное обследование проводили при включении в исследование, через 3 нед и 6 мес после начала лечения.
Для объективизации оценки выраженности псориатического процесса на коже использовали шкалу PASI (Psoriasis Area and Severity Index) — индекс тяжести поражения. КЖ больных определяли с помощью специфических опросников DLQI, PDI. Использовали также общий опросник SF-36.
Всем больным проводили стандартное лабораторное обследование.
Для определения интерлейкина-10 (ИЛ-10), α-фактора некроза опухоли (ФНО-α) и высокочувствительного С-реактивного белка (СРБ) применяли метод конкурентного иммуноферментного анализа в разбавленной сыворотке крови. Образцы крови брали в утренние часы натощак из локтевой вены в пробирки на 4 мл крови. Сыворотку крови выделяли центрифугированием в течение 15 мин при 3000 об./мин. Полученные образцы сыворотки хранили при температуре –70 °С до проведения соответствующего анализа в лаборатории НИИ ревматологии МЗ РФ.
Для изучения морфологических и иммунных изменений в псориатической бляшке выполняли биопсию кожи при включении больных в исследование и через 3 нед лечения. Морфологическое исследование проводили на кафедре патологической анатомии МГМСУ Росздрава и включало гистологический и иммуноморфологический методы. В качестве первичных специфических антител использовали моноклональные антитела производства к ФНО-α, рецепторам ФНО-α, рецептору из семейства интегринов CD11α (LFA-1).
Для исключения ИБС проводили тредмил-тест с использованием протокола Bruce. При сомнительных или положительных результатах тредмил-теста больных в дальнейшее исследование не включали.
Суточное мониторирование АД (СМАД) выполняли с использованием комплекса Pressure Trak 24-Hour ABP. Мониторирование проводили с 15-минутными интервалами в дневное время и 30-минутными — в ночные часы.
Двухмерную эхокардиографию проводили на аппарате Sonos 5500 с помощью датчика S4 в режиме второй гармоники c диапазоном частот 1,8—3,6 МГц в соответствии с рекомендациями Комитета по номенклатуре и стандартизации Американской ассоциации эхокардиографии (АSЕ). Все исследования выполняли в В- и М-режимах с использованием стандартных позиций. Массу миокарда левого желудочка (ЛЖ) рассчитывали по формуле R. Devereux и N. Reichek.
Статистическую обработку полученных данных выполняли c помощью пакета программ Statistica 7.0. При анализе нормально распределенных величин рассчитывали средние значения (М), их стандартные отклонения (SD), а в случае неравномерного распределения признака — медиану и процентили (25-й; 75-й). Для оценки достоверности различий между двумя группами на одном этапе при нормальном распределении непрерывных величин использовали непарный критерий Стьюдента (t-критерий), в остальных случаях при сравнении двух групп применяли непараметрический критерий Манна—Уитни (U-критерий). Для выявления взаимосвязи между показателями использовали метод ранговой корреляции Спирмена. Различия считали достоверными при p<0,05.
Результаты
Сформированные группы достоверно не различались по возрасту, длительности заболевания псориазом, частоте повторных госпитализаций, а также распространенности псориаза по шкале PASI. Кроме того, между группами отсутствовали различия по длительности и степени АГ, факторам риска, суммарному риску развития сердечно-сосудистых осложнений. Результаты офисных измерений АД между анализируемыми группами достоверно не различались и в обеих группах были выше целевого уровня. Кроме того, между группами не выявлено значимых различий по сопутствующим заболеваниям и инвалидности.
У большинства больных в обеих группах антигипертензивная терапия включала ингибиторы ангиотензинпревращающего фермента (74,6%). Несколько реже назначались β-адреноблокаторы (31,3%), диуретики (31,3%) и антагонисты кальция (6,3%). При этом 25 (52,1%) больных в группе аторвастатина и 10 (66,7%) в группе контроля получали комбинированную гипотензивную терапию.
На фоне 6-месячного лечения аторвастатином отмечено выраженное уменьшение тяжести псориаза по шкале PASI (рис. 1). При этом значительное улучшение было отмечено уже к 3-й неделе после начала лечения.
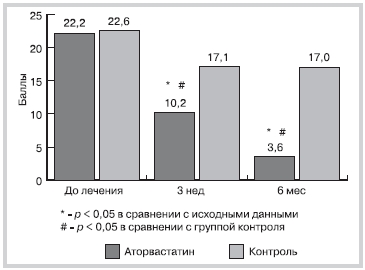
Рис. 1. Динамика тяжести псориаза в процессе 6 месячноголечения (PASI).
В группе контроля отмечено улучшение только в течение первых 3 нед лечения, однако оно было достоверно менее выраженным, чем в группе аторвастатина.
У 47,9% пациентов в группе аторвастатина достигнуто улучшение до PASI-50% уже к 3-й неделе лечения, а к окончанию 6-месячного лечения уровня PASI-50% достигли 95,8% пациентов. Более того, на фоне 6-месячной терапии уровня PASI-75% достигли 81,3% больных. При этом в группе контроля уровня PASI-50% достигли лишь 13,3% пациентов только к 6 мес после включения в исследование.
При анализе стандартных биохимических показателей и данных клинического анализа крови между группами исходно не выявлено достоверных различий. В группе аторвастатина и контрольной группе отмечено повышение уровней общего холестерина — ХС (5,5±0,9 и 5,2±0,6 ммоль/л), а также липопротеидов низкой плотности — ЛНП (3,4±1,0 и 3,3±0,7 ммоль/л соответственно).
В группе аторвастатина уже через 3 нед лечения отмечено достоверное снижение уровней общего ХС, триглицеридов и ЛНП (рис. 2). Достигнутые показатели оставались стабильными к 6 месяцам терапии. В группе контроля показатели липидного спектра в процессе наблюдения не изменялись. Остальные биохимические показатели не претерпели статистически значимых изменений.
Рис. 2. Динамика липидного состава крови у больных распространенным псориазом и АГ.
АГ — артериальная гипертония; ХС — холестерин; ЛНП — липопротеиды низкой плотности; ЛВП — липопротеиды высокой плотности.
На стационарном этапе лечения клиническое улучшение сопровождалось достоверным улучшением КЖ как в группе аторвастатина, так и в контрольной группе (рис. 3). Однако в группе аторвастатина улучшение к 3-й неделе лечения было достоверно более выражено. Динамика КЖ по опросникам DLQI и PDI носила однонаправленный характер. К 3-й неделе лечения КЖ больных в группе аторвастатина достоверно превосходило таковое в группе контроля по шкалам ежедневных ощущений (DLQI), повседневной деятельности (PDI), работы и учебы (PDI). Более того, положительная динамика КЖ по указанным шкалам, а также суммарным показателям DLQI и PDI в группе аторвастатина по сравнению с группой контроля сохранялась к 6 мес лечения.
Рис. 3. Динамика показателей КЖ (по данным опросника PDI и DLQI) у больных распространенным псориазом и АГ.
АГ — артериальная гипертония; КЖ — качество жизни.
На фоне терапии аторвастатином уже к 3-й неделе лечения было отмечено достоверное улучшение КЖ по шкалам физического функционирования, интенсивности боли и общего состояния здоровья опросника SF-36. Из интегральных показателей опросников SF-36 достоверное улучшение произошло только по шкале физического благополучия. В контрольной группе динамика КЖ носила только характер тенденций. По шкале общего состояния здоровья КЖ в группе аторвастатина достоверно превышало показатели группы контроля уже с 3-й недели лечения, а по шкале социального функционирования различия достигли достоверного уровня к окончанию 6-месячного лечения.
Для уточнения взаимосвязи показателей КЖ с выраженностью псориаза был проведен ранговый корреляционный анализ показателей опросников DLQI, PDI и шкал SF-36 с оценкой по шкале PASI на момент включения. При этом обнаружена средней силы корреляция между уровнем КЖ по данным DLQI и PDI с оценкой по шкале PASI (r=0,6; p<0,01 и r=0,49; p<0,01 соответственно).
По данным СМАД в группе аторвастатина и контрольной группе отмечена тенденция к снижению минимального и среднего систолического и диастолического АД. При этом наблюдалось достоверное снижение максимальных значений систолического и диастолического АД в обеих группах, а также достоверное снижение дневного индекса гипертензии как для систолического, так и диастолического АД. Несмотря на достижение положительной динамики в лечении АГ, показатели индекса времени гипертензии по группам свидетельствовали о недостаточном снижении АД. При этом дополнительное 6-месячное применение аторвастатина не привело к достоверному снижению показателей СМАД по сравнению с таковыми в контрольной группе.
Шестимесячная терапия аторвастатином в сочетании с антигипертензивной терапией привела к достоверному уменьшению линейного размера и объема левого предсердия — ЛП (рис. 4). При этом в контрольной группе отмечена тенденция к увеличению его размеров. В группе аторвастатина наблюдалось достоверное уменьшение толщины межжелудочковой перегородки и задней стенки ЛЖ. Уменьшение толщины стенок ЛЖ сопровождалось достоверным уменьшением массы миокарда ЛЖ. В контрольной группе структурно-функциональные показатели ЛЖ не претерпели значимых изменений.
Рис. 4. Динамика размеров ЛП и массы миокарда ЛЖ у больных псориазом и АГ.
ЛП — левое предсердие; ЛЖ — левый желудочек; АГ — артериальная гипертония; ИММЛЖ — индекс массы миокарда левого желудочка.
Для уточнения роли иммунного воспаления в патогенезе псориаза и определения степени влияния ингибитора ГМГ-КоА редуктазы аторвастатина на маркеры воспаления определяли их исходный уровень, а также динамику показателей через 3 нед и 6 мес после включения больных в исследование.
При включении в исследование группы аторвастатина и контроля были сопоставимы по уровню иммунного воспаления (рис. 5). В группе аторвастатина по сравнению с группой контроля уже к 3-й неделе терапии отмечено значимое снижение уровня СРБ.
Рис. 5. Динамика уровня маркеров воспаления у больных псориазом и АГ в процессе лечения.
ИЛ — интерлейкин; ФНО-α— α-фактор некроза опухоли; АГ — артериальная гипертония.
Данный эффект был стойким и сохранялся в течение 6-месячной терапии, в то время как в контрольной группе уровень СРБ снижался незначимо. Благоприятное действие аторвастатина на степень иммунного воспаления подтверждается достоверным снижением уровня ФНО-α к 3-й неделе терапии. Продолжение лечения аторвастатином в течение 6 мес сопровождалось дальнейшим уменьшением уровня ФНО-α. В контрольной группе уменьшение уровня ФНО-α было достоверным. При оценке динамики уровня противовоспалительного ИЛ-10 отмечено его повышение в группе аторвастатина к 3-й неделе лечения, которое, впрочем, не достигло значимого уровня. К окончанию 6-месячной терапии аторвастатином уровень ИЛ-10 вернулся к исходному и по этому показателю группы не различались.
Для определения взаимосвязи иммунных нарушений в псориатической бляшке и крови при включении в исследование и через 3 нед 12 больным из группы аторвастатина одновременно с забором крови проводили биопсию псориатической бляшки с последующим гистологическим и иммуноморфологическим исследованием. Полученные результаты сопоставляли с группой сравнения (5 образцов, взятых у пациентов в возрасте 57—69 лет без дерматологических, онкологических или иммунопатологических заболеваний). Результат реакции оценивали по общепринятой системе полуколичественным методом в баллах от 0 до 3 (отсутствие реакции, слабая, умеренная и выраженная реакция).
При оценке экспрессии ФНО-α в группе сравнения во всех случаях отмечены умеренная экспрессия в цитоплазме кератиноцитов, а также экспрессия в цитоплазме единичных эндотелиоцитов. В дерме выявлены единичные мононуклеарные клетки (макрофаги, лимфоциты) и гранулоциты с экспрессией ФНО-α.
В группе аторвастатина исходно экспрессия ФНО-α была выражена в разной степени в эпителии, особенно в базальном и шиповатом слоях, эндотелии сосудов и клетках инфильтрата.
На фоне лечения аторвастатином отмечено достоверное уменьшение экспрессии ФНО-α в клетках воспалительного инфильтрата, что подтверждает противовоспалительный эффект аторвастатина (рис. 6). Экспрессия ФНО-α в эндотелии сосудов в этой группе также снизилась, однако не достигла достоверного уровня.
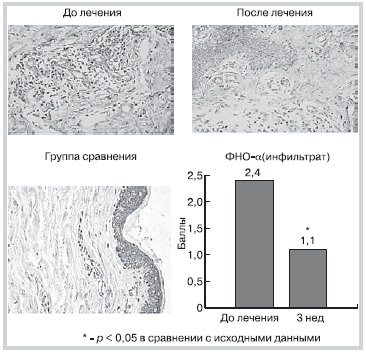
Рис. 6. Динамика экспрессии ФНО α в процессе леченияаторваcтатином.
ФНО-α — α-фактор некроза опухоли.
При оценке экспрессии рецепторов ФНО-α в группе сравнения во всех случаях отмечена крайне слабая экспрессия в мононуклеарных клетках (макрофагах, лимфоцитах), единичных клетках эндотелия сосудов — 0 баллов (рис. 7).

Рис. 7. Динамика экспрессии рецепторов к ФНО α в процесселечения аторваcтатином.
ФНО-α — α-фактор некроза опухоли.
В группе аторвастатина в исходном состоянии экспрессия рецепторов ФНО-α была выражена практически исключительно в клетках воспалительного инфильтрата. Лечение аторвастатином сопровождалось тенденцией к уменьшению экспрессии рецепторов ФНО-α в клетках воспалительного инфильтрата и эндотелия сосудов.
При оценке экспрессии лейкоцитарного функционального антигена LFA-1 в группе сравнения выявлена близкая к 0 мембранная экспрессия единичных мононуклеарных клеток. В группе аторвастатина исходно определялась положительная мембранная экспрессия мононуклеарных клеток (макрофагов и лимфоцитов), некоторых эндотелиальных клеток и клеток базального слоя эпидермиса (неспецифическое окрашивание). Лечение аторвастатином сопровождалось достоверным и выраженным снижением экспрессии LFA-1 в клетках воспалительного инфильтрата (рис. 8).
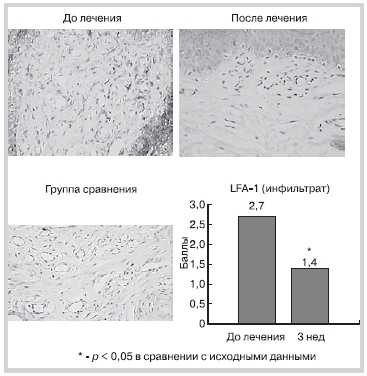
Рис. 8. Динамика экспрессии LFA-1 в процессе леченияаторваcтатином.
LFA-1 — лейкоцитарный функциональный антиген.
Для уточнения взаимосвязи распространенности псориаза и выраженности иммунных изменений в крови и псориатической бляшке был проведен корреляционный анализ с использованием метода ранговой корреляции Спирмена. Из показателей иммунного воспаления в периферической крови достоверная корреляция с оценкой по шкале PASI была найдена только для ФНО-α (r=0,26; p=0,036), однако сила связи была слабой. При этом между провоспалительными цитокинами наиболее выраженная связь была обнаружена между уровнями ФНО-α и СРБ (r=0,64; p<0,01).
Анализ показателей иммунного воспаления в псориатической бляшке позволил выявить достоверную взаимосвязь экспрессии ФНО-α в эндотелии сосудов и клетках воспалительного инфильтрата с оценкой по шкале PASI (r=0,74; p<0,01 и r=0,61; p=0,03). Достоверный характер носила также взаимосвязь оценки по шкале PASI с экспрессией LFA-1 в клетках воспалительного инфильтрата (r=0,62; p=0,03). При этом было обнаружено отсутствие зависимости между уровнем ФНО-α в периферической крови и экспрессией ФНО-α в эндотелии сосудов, а также в клетках воспалительного инфильтрата (r=0,15; p=0,65 и r=0,26; p=0,4 соответственно).
Из полученных данных следует, что выраженность псориаза в значительно большей степени зависит от экспрессии провоспалительных цитокинов в псориатической бляшке, чем от их уровня в периферической крови. В связи с этим представляется особенно важным подчеркнуть, что лечение аторвастатином способно снижать не только системный уровень провоспалительных цитокинов, но и их местную экспрессию, а это обеспечивает выраженный клинический эффект.
Обсуждение
В нашем исследовании терапия аторвастатином в дозе 20 мг/сут привела к достоверному снижению уровня общего ХС на 25% и ЛНП на 35%. При этом уровень ЛВП повысился недостоверно на 10%. Подобные результаты были получены в двойном слепом плацебо-контролируемом исследовании по изучению влияния различных доз аторвастатина на минеральную плотность костной ткани и липидный состав крови [26].
Шестимесячное применение аторвастатина в нашей работе не привело к достоверному снижению показателей СМАД по сравнению с таковыми в контрольной группе, что согласуется с результатами многоцентрового исследования ASCOT-CAFE, в котором терапия аторвастатином достоверно уменьшала риск сердечно-сосудистых событий, не влияя на гемодинамические показатели [27].
На фоне 6-месячного лечения аторвастатином нами отмечено выраженное уменьшение распространенности псориаза по шкале PASI. При этом значительное улучшение констатировано уже к 3 нед после начала лечения. У 47,9% пациентов в группе аторвастатина достигнуто улучшение до PASI-50% уже к 3-й неделе терапии, а к окончанию 6-месячного лечения уровня PASI-50% достигли 95,8% больных. Более того, на фоне 6-месячной терапии аторвастатином уровня PASI-75% достигли 81,3% больных. По нашим данным, ранее эффективность и безопасность аторвастатина в комплексном лечении псориаза не исследовалась. К настоящему времени проведены всего 2 небольших пилотных исследования с использованием статинов при псориазе. В обоих исследованиях применялся симвастатин. Терапия симвастатином в суточной дозе 40 мг у 7 пациентов в течение 8 нед привела к достоверному уменьшению PASI на 47,3% [28]. Однако небольшой объем исследования, короткая длительность лечения и отсутствие контрольной группы не позволили сделать определенные выводы.
В другом исследовании положительное влияние терапии симвастатином в суточной дозе 20 мг на клиническое течение псориаза отмечен у 45 больных с сопутствующей ИБС. Лечение псориаза на протяжении 6 мес привело к достоверному снижению оценки по шкале PASI на 35,9% (с 22,3 до 14,2 балла) [29]. В нашем исследовании через 3 нед после назначения аторвастатина снижение оценки по шкале PASI составило 44%, что сопоставимо с результатами проведенных исследований. Однако при дальнейшем лечении аторвастатином было отмечено усиление клинического эффекта. Большая эффективность аторвастатина по сравнению с симвастатином может быть обусловлена его большей противовоспалительной активностью [30]. Как и в проведенных исследованиях, в нашей работе при терапии статинами наряду с клиническим улучшением отмечено достоверное улучшение КЖ по данным опросника DLQI. Однако в проведенной ранее работе по оценке эффективности симвастатина у больных псориазом и ИБС, в отличие от нашего исследования, не изучалось влияние симвастатина на уровень местного иммунного воспаления. При этом снижение концентрации ФНО-α было достоверным, но небольшим (с 10,64 до 9,3 пг/мл).
В нашей работе аторвастатин способствовал достоверному уменьшению линейного размера, а также объема ЛП. В недавно выполненных экспериментальных и клинических исследованиях доказана способность аторвастатина уменьшать частоту развития фибрилляции предсердий, что, возможно, было обусловлено в том числе уменьшением размеров ЛП [31—33].
Японскими учеными в исследовании случай—контроль была установлена взаимосвязь между приемом статинов и снижением массы миокарда ЛЖ у больных стабильной стенокардией [34]. Аналогичные результаты были получены в небольшом проспективном исследовании у больных АГ и дислипидемией на фоне терапии правастатином [35]. В отличие от нас, немецким ученым не удалось продемонстрировать возможность снижения массы миокарда ЛЖ у больных с гипертрофической кардиомиопатией на фоне терапии аторвастатином в дозе 80 мг/сут [36]. Возможно, это обусловлено этиопатогенетическими различиями в развитии АГ и гипертрофической кардиомиопатии.
В настоящее время способность статинов снижать массу миокарда ЛЖ служит предметом активного обсуждения и целью нескольких проспективных исследований [37].
Исходно в группе аторвастатина и контроля нами был отмечен несколько более высокий уровень СРБ (5,4 и 5,9 мг/л соответственно) по сравнению с таковым в многоцентровом исследовании этанерцепта (3,2 мг/л), что может быть связано с более тяжелым течением псориаза в нашем исследовании — исходная оценка по шкале PASI 22,2 (13,3; 24,6) балла по сравнению с 18,4±8,1 балла [38]. В течение 6 мес на фоне приема этанерцепта уровень СРБ снизился на 48%, а на фоне лечения аторвастатином — на 43%. В исследовании польских ученых у 175 мужчин с псориазом при обострении (средний уровень PASI 29 баллов) уровень СРБ составил 7,1 мг/л [39]. В фазе ремиссии он снизился до 0,9 мг/л, что значительно меньше, чем на фоне терапии аторвастатином (3,1 мг/л). Последнее, по-видимому, связано с активным применением системной терапии у большинства пациентов. Несмотря на такое значительное снижение уровня СРБ, этот маркер иммунного воспаления все равно превышал референсные значения в группе контрольных пациентов без псориаза (0,3 мг/л). Данный факт подтверждает наличие иммунного воспаления у больных с псориазом даже в фазу клинической ремиссии, что предполагает постоянный прием препаратов, блокирующих иммунное воспаление.
В исследовании чешских ученых у 26 пациентов с распространенным псориазом уровень ФНО-α составил 1,86±0,71 пг/мл, что сопоставимо с нашими результатами — 1,45 (0,6—1,8) пг/мл в группе аторвастатина и 1,6 (1,47—2,08) пг/мл в контрольной группе [40]. Как и в нашем исследовании, корреляция между уровнем ФНО-α и оценкой по шкале PASI была слабой (r=0,26 и r=0,24 соответственно).
У больных АГ с псориазом не было обнаружено значимой динамики уровня ИЛ-10 на фоне терапии аторвастатином. Несмотря на то что ИЛ-10 играет важную роль в патогенезе псориаза, а рекомбинантный ИЛ-10 обладает терапевтической эффективностью при псориазе, уровень ИЛ-10 и его динамика определялись лишь в небольшом количестве работ [41]. В ряде исследований уровень ИЛ-10 у больных псориазом не отличался от такового у здоровых добровольцев [42, 43]. В 2 других исследованиях, напротив, было выявлено достоверное повышение концентрации ИЛ-10 при псориазе [44, 45]. Таким образом, необходимо констатировать, что динамика уровня ИЛ-10 у больных псориазом неоднозначна и разнонаправлена. Это обусловливает необходимость дальнейших исследований, направленных на поиск дополнительных факторов, влияющих на уровень этого противовоспалительного цитокина.
В нашем исследовании 6-месячная терапия аторвастатином привела к достоверному снижению экспрессии ФНО-α в клетках воспалительного инфильтрата. Аналогичные результаты были получены итальянскими учеными у 11 пациентов с псориазом на фоне терапии инфликсимабом [46]. Лечение химерными моноклональными антителами к ФНО-α (инфликсимабом) привело к снижению экспрессии ФНО-α с 294,7±123,5 до 194,9±67,8 пг/мл (p=0,02). Как и мы, эти авторы обнаружили высокодостоверную корреляцию между клиническим течением псориаза по шкале PASI и экспрессией ФНО-α. При этом сила связи была значительно более слабой (r=0,33), чем c в нашем исследовании (r=0,61). Полученные различия могут объясняться особенностями в использованных методиках определения экспрессии ФНО-α. В нашем исследовании проводилась полуколичественная оценка экспрессии ФНО-α в эпителии, эндотелии и в клетках воспалительного инфильтрата. При этом достоверная взаимосвязь экспрессии ФНО-α с оценкой по шкале PASI была обнаружена только в эндотелии сосудов и клетках воспалительного инфильтрата (r=0,74; p<0,01 и r=0,61; p=0,03). Напротив, в исследовании P. Cordiali-Fei и соавт. Исследовался количественный уровень ФНО-α в гомогенизированном субстрате всей толщи биопсийного материала.
В другом исследовании с инфликсимабом, как и в нашем, было обнаружено достоверное уменьшение экспрессии LFA-1-позитивных клеток [47].
В исследованиях с эфализумабом (моноклональные антитела к CD11a субъединице LFA-1), подобно нашему исследованию с аторвастатином, было выявлено уменьшение числа LFA-1-позитивных клеток воспалительного инфильтрата, а также уменьшение экспрессии ФНО-α [48, 49]. Кроме того, в нашей работе обнаружена достоверная взаимосвязь оценки по шкале PASI с экспрессией LFA-1 в клетках воспалительного инфильрата (r=0,62; p=0,03). В исследовании M.A. Lowes и соавт. также была показана достоверная взаимосвязь динамики улучшения клинического течения псориаза и числа CD11c-позитивных клеток на фоне терапии анти-LFA1 антителами (эфализумабом) (r=0,62) [49]. При этом сила взаимосвязи оказалась абсолютно одинаковой.
Заключение
Таким образом, результаты проведенного исследования позволяют сделать вывод, что лечение аторвастатином (аторис) в сочетании со стандартной терапией достоверно уменьшает выраженность псориаза по шкале PASI уже к 3-й неделе лечения. К 6-му месяцу терапии отмечено дальнейшее усиление клинического эффекта. Выявлена корреляция уровня местного иммунного воспаления с тяжестью псориаза (r=0,61 для α-фактора некроза опухоли; r=0,62 для лейкоцитарного функционального антигена LFA-1). Лечение аторвастатином сопровождается редукцией иммунного воспаления как на системном (снижение уровня С-реактивного белка на 43% и α-фактора некроза опухоли на 52%), так и на местном (снижение экспрессии α-фактора некроза опухоли на 54%, лейкоцитарного функционального антигена LFA-1 на 48%) уровне, что подтверждает патогенетическую обоснованность его применения при псориазе.
Добавление аторвастатина к комплексной терапии артериальной гипертонии не приводит к достоверному улучшению показателей суточного мониторирования артериального давления, но при этом способствует достоверному уменьшению размеров левого предсердия на 5% и массы миокарда левого желудочка на 5%. Лечение аторвастатином ведет к значимому улучшению качества жизни по данным опросников DLQI на 46%, PDI на 44% и SF-36 на 13% у больных псориазом и артериальной гипертонией.



