На прием к участковому терапевту обратился пациент К., 68 лет, с жалобами на учащенное неритмичное сердцебиение, колющие боли за грудиной, головную боль, шаткость при ходьбе. В поликлинике больной наблюдается более 10 лет, достаточно регулярно, состоит на диспансерном учете у терапевта и кардиолога. Пациент страдает артериальной гипертензией (АГ) с максимальными показателями артериального давления (АД) 180/110 мм рт. ст, привычное АД 130/80 мм рт. ст.; регулярно принимает эналаприл 10 мг/сут, бисопролол 2,5 мг/ сут. В 2007 г. перенес острый инфаркт миокарда со стационарным лечением, после чего ему был рекомендован прием антиагрегантов, статинов. С 2009 г. диагностирована постоянная форма фибрилляции предсердий (ФП), рекомендован дигоксин, который пациент принимает нерегулярно. Острых нарушений мозгового кровообращения не было, сахарным диабетом (СД) не страдает. Один раз в год – стационарное лечение. Имеет 2 группу инвалидности.
 Кроме того, пациент наблюдается урологом по поводу мочекаменной болезни (МКБ), доброкачественной гиперплазии предстательной железы (ДГПЖ), принимает тамсулозин 0,4 мг/сут. Простатспецифический антиген 6,2 нг/мл.
Кроме того, пациент наблюдается урологом по поводу мочекаменной болезни (МКБ), доброкачественной гиперплазии предстательной железы (ДГПЖ), принимает тамсулозин 0,4 мг/сут. Простатспецифический антиген 6,2 нг/мл.
Курит по половине пачки сигарет в день. Алкоголем не злоупотребляет. Перенесенные операции: аппендэктомия, холецистэктомия (желчнокаменная болезнь – ЖКБ).
При расспросе пациента оказалось, что ухудшение самочувствия отмечает в течение суток: появились учащенное сердцебиение, головная боль, головокружение, шаткость при ходьбе. СПМ не вызывал, обратился в поликлинику.
При осмотре пациента участковый терапевт отметил повышение АД до 170/90 мм рт. ст. и тахисистолию, в связи с чем была вызвана СМП, и пациент был госпитализирован.
Из приемного отделения многопрофильного стационара больной после осмотра терапевта был госпитализирован в кардиореанимационное отделение (КРО) с диагнозом: Ишемическая болезнь сердца (ИБС): постинфарктный кардиосклероз. Фон: Атеросклероз коронарных артерий. Гипертоническая болезнь 3 стадии, 3 степени, риск 4. Осложнения: Постоянная форма ФП, тахисистолия, недостаточность кровообращения 2б степени. Сопутствующие заболевания: МКБ, ДГПЖ, хроническая ишемия головного мозга, ЖКБ, холецистэктомия.
При поступлении в КРО состояние тяжелое, в сознании, дезориентирован. Частота дыхательных движений 18 в мин, дыхание жесткое, хрипов нет. Частота сердечных сокращений 150 в мин, аритмия. АД 150/100 мм рт. ст. В связи с жалобами на головную боль, головокружение, тошноту и эпизод дезориентации пациент был консультирован неврологом, который высказал предположение об инфаркте головного мозга, в связи с чем была выполнена компьютерная томография (КТ) головного мозга. По данным КТ – инфаркт головного мозга. Больной был переведен в нейрореанимационное отделение, где на 4-е сутки, несмотря на проводимое лечение, нарастала клиника отека головного мозга, и пациент умер. На аутопсии был поставлен следующий клинический диагноз:
Основной: 1. Инфаркт головного мозга в бассейне левой мозговой артерии. 2. ИБС: постинфарктный кардиосклероз.
 Фон: Атеросклероз коронарных, церебральных артерий. Гипертоническая болезнь 3 стадии, степень АГ – 3, риск сердечно-сосудистых осложнений – 4.
Фон: Атеросклероз коронарных, церебральных артерий. Гипертоническая болезнь 3 стадии, степень АГ – 3, риск сердечно-сосудистых осложнений – 4.
Осложнения: Постоянная форма ФП, тахисистолия. Недостаточность кровообращения 2 степени. Отек головного мозга.
Сопутствующие заболевания: Хроническая обструктивная болезнь легких (ХОБЛ): хронический обструктивный бронхит, вне обострения. МКБ. ДГПЖ. ЖКБ. Холецистэктомия.
При аутопсии: Инфаркт головного мозга. Постинфарктный кардиосклероз с хронической аневризмой левого желудочка. Застойная пневмония в нижней доле правого легкого. МКБ: камень левой почки. ДГПЖ. Таким образом, клинический диагноз на аутопсии был подтвержден.
Данный клинический случай является типичным примером «сосудистого» пациента с коморбидной патологией (не менее 5 заболеваний).
В структуре коморбидной патологии наиболее распространенными нозологиями являются сосудистые заболевания – АГ, ИБС, СД (рис. 1).
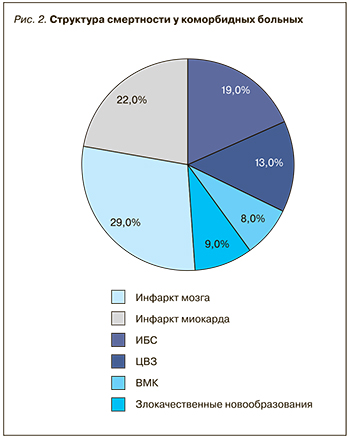
Кардио- и цереброваскулярные заболевания (ЦВЗ) также являются причиной летальных исходов у подавляющего большинства коморбидных больных. На долю их острых форм приходится 22,7 и 38,0% таких исходов соответственно (рис. 2). При этом инфаркт миокарда в 92% случаев сочетался с АГ, в 75,4% – с патологией мочевой системы, в 71% – с ХОБЛ, в 34% – с СД. Инфаркт головного мозга наиболее часто сочетался с АГ (92,2%) и патологией мочевой системы (83,3%), несколько реже с ХОБЛ (68,7%) и ИБС (68%).
Формирование любой коморбидной патологии, в т.ч. и сосудистой, начинается с факторов риска (ФР), увеличивающих вероятность возникновения того или иного заболевания. К основным ФР относятся: образ жизни (курение, злоупотребление алкоголем, несбалансированное питание, гиподинамия, плохие материально-бытовые условия и др.), генетические факторы (наследственная предрасположенность к заболеваниям), внешняя среда (загрязнение канцерогенами воды, воздуха, почвы) и несовершенство системы здравоохранения (неэффективность профилактических мероприятий, несвоевременность оказания медицинской помощи). При этом более 50% ФР приходится на образ жизни, а для сосудистых заболеваний роль ФР, обусловленных образом жизни, достигает 70%. Возможно, поэтому эти заболевания называются «болезнями цивилизации». Всемирная организация здравоохранения выделяет первичные и вторичные ФР. К первичным ФР относят курение, злоупотребление алкоголем, нерациональное питание, гиподинамию, стресс, к вторичным – СД, АГ, дислипидемию, иммунодефицит.
В 2011 г. на Европейском конгрессе кардиологов рассматривалась проблема «Острый коронарный синдром (ОКС) у лиц старше 90 лет». По данным клинического анализа, у пациентов данной возрастной группы с классической клиникой, наличием в анамнезе АГ и отсутствием других ФР сердечно-сосудистых заболеваний в 61% случаев диагностируется ОКС без подъема сегмента ST, в 25% – ОКС с подъемом сегмента ST. Примечательно, что частота осложнений, развивающихся при ОКС, в указанной группе больных не превышает 10%. К сожалению, в России такой симпозиум вряд ли бы удалось провести. Это связано с несколькими причинами: во-первых, пациентов старше 90 лет единицы, продолжительность жизни в России на 10–15 лет ниже, чем в странах Европы; во-вторых, отсутствие других ФР, кроме АГ, в нашей стране – казуистика.
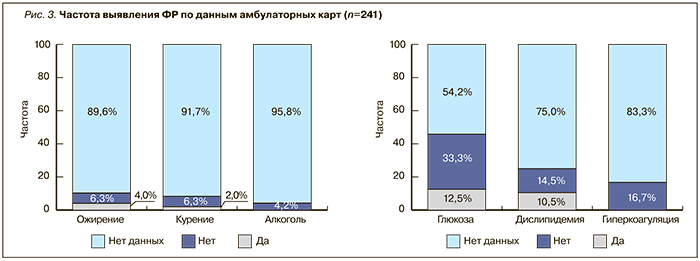
В Англии, где продолжительность жизни в среднем составляет 80–85 лет, о влиянии ФР задумываются уже в молодом возрасте. В среднем возрасте эти ФР начинают активно выявлять и корректировать: сначала немедикаментозными методами, а затем и с помощью лекарственных препаратов. В России другое отношение к ФР и их выявлению: проводится только их констатация, не предпринимаются адекватные попытки коррекции. Но и констатация проводится далеко не всегда. В 80% амбулаторных карт пациентов, имеющих ФР и сердечно-сосудистые заболевания, о них не сказано ни разу (рис. 3). А ведь первостепенной задачей первичного звена здравоохранения является первичная и вторичная профилактика социально-значимых заболеваний.
Основными звеньями в формировании сосудистой коморбидности являются АГ и атеросклероз – патологические состояния, запускающие развитие сердечно-сосудистого континуума и характеризующиеся полиорганными изменениями. АГ имеет свои органы-мишени: сердце, сосуды головного мозга, почки, сетчатка глаза. При длительном течении АГ происходит поражение этих органов с развитием гипертрофии левого желудочка миокарда, сосудистой энцефалопатии, нефропатии, ангиопатии сетчатки. А при осложненном течение АГ развиваются т.н. ассоциированные клинические состояния – сосудистые катастрофы: инфаркт миокарда, инсульт, отслойка сетчатки, почечная недостаточность. Распространенность АГ, по данным аутопсий 1566 пациентов с сосудистой коморбидностью, составляет 96%. При этом на амбулаторном этапе антигипертензивную терапию получали лишь 2/3 пациентов, причем половина из них в режиме монотерапии, в связи с чем только у 13% больных были достигнуты целевые уровни АД. Поэтому ранее выявление АГ, диспансерное наблюдение таких пациентов, а также адекватная комбинированная антигипертензивная терапия современными препаратами – важнейшая задача амбулаторного этапа медицинской помощи, направленная на прерывание патологической цепи развития сосудистой коморбидности.

Следующее звено формирования сосудистой коморбидности – это атеросклероз – хроническое системное заболевание, поражающее артерии эластического и мышечно-эластического типов с изменением всех слоев сосудистой стенки. Заболевание сопровождается локальным воспалением, отложением патологически модифицированных липидов, дисфункцией эндотелия, пролиферацией и изменением сократимости гладкомышечных клеток, развитием фиброзной ткани и кальцификацией с последующими стенозом и окклюзией, приводящими к гемодинамическим нарушениям в зоне ответственности пораженного сегмента сосуда. Можно говорить о существовании универсального механизма развития сосудистой коморбидности – дисфункции эндотелия, механизм развития которой представлен на рис. 4.
Липопротеиды низкой плотности диффундируют в кровь через эндотелий, соединяясь с атомами кислорода; далее макрофаги поглощают эти молекулы, превращаясь в пенистые клетки, осуществляющие массивный выброс провоспалительных цитокинов, которые и разрушают эндотелий. В местах разрушений образуются липидные бляшки. Таким образом, при воздействии ФР формируется «порочный круг» в виде эндотелиальной дисфункции, запускающей избыточную продукцию ряда интерлейкинов, воздействие которых приводит к потере функциональности тканей, развитию ассоциированных заболеваний и в конечном итоге коморбидности.
Мультифокальный характер атеросклеротического поражения демонстрируют данные 202 аутопсий пациентов с постинфарктным кардиосклерозом: атеросклероз коронарных артерий был выявлен в 100% случаев, почечных артерий – в 74%, церебральных сосудов – в 60%, аорты – в 58%, артерий нижних конечностей – в 9%. При этом на амбулаторном этапе статины были назначены не более чем в 10% случаев, а ежегодный контроль за уровнем холестерина осуществлялся лишь у 7% больных. Высокотехнологические методы лечения, в частности, кардиохирургические и сосудистые вмешательства, применялись в единичных случаях, что свидетельствует о неадекватном амбулаторном ведении пациентов с атеросклеротическим поражением сосудов.
Еще одним фоновым заболеванием, приводящим к эндотелиальной дисфункции, является СД 2 типа. Палитра состояний, развивающихся при наличии СД 2 типа, следующая: диабетические нейропатия, ретинопатия и нефропатия, синдром диабетической стопы, диабетическая нейроостеоартропатия, диабетические макроангиопатии (ИБС, ХСН, ЦВЗ), хронические облитерирующие заболевания артерий нижних конечностей), АГ, дислипидемия. Несмотря на столь грозные проявления СД 2 типа, участковые терапевты не акцентируют внимание на этом заболевании, не фиксируют его наличие в медицинской документации. Так, выборочный анализ 514 амбулаторных карт показал, что в клиническом диагнозе, поставленном участковым терапевтом, СД 2 типа присутствовал лишь у 16 (3%) больных, и в 2/3 случаев СД находился в стадии декомпенсации. При этом, по данным клинико-анатомической базы 1864 умерших в стационаре, СД 2 типа имели 19% пациентов. Стоит обратить внимание на то обстоятельство, что у 84% из них СД имел осложненное течение. При аутопсии были выявлены разнообразные осложнения СД 2 типа: пневмония (36,7%), хроническая почечная недостаточность (27,5%), гнойные осложнения (пиелонефрит – 8,3%, гнойный бронхит – 10%, перитонит – 5%, гнойный холецистит – 6,7%), синдром Киммельстиля–Вильсона (1,7%). Такая картина свидетельствует о поздней диагностике и неадекватном ведении пациентов с СД 2 типа на амбулаторном этапе медицинской помощи.
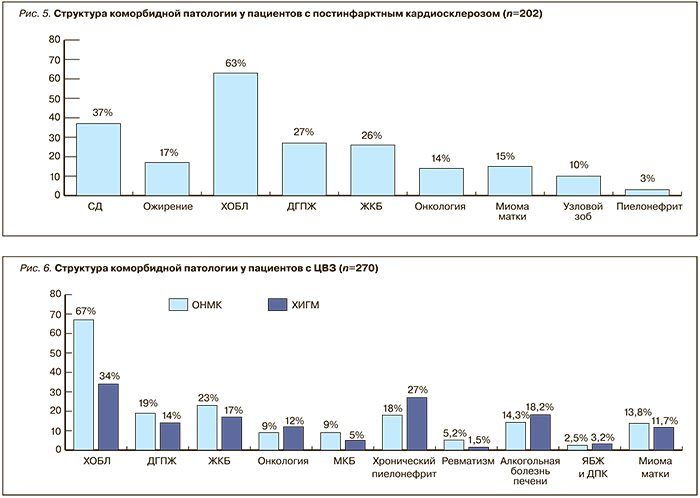
Помимо собственно кардио- и цереброваскулярных заболеваний, сосудистые больные имеют и другие нозологии. Анализ медицинской документации коморбидных больных позволил выделить наиболее распространенные из них: ХОБЛ, ДГПЖ, хронический пиелонефрит, ЖКБ (рис. 5, 6)
Если составить лекарственный минимум для коморбидного сосудистого пациента, то выбор, скорее всего, остановится на следующих препаратах: сартаны, блокаторы кальциевых каналов, β-адреноблокаторы, статины и корректоры метаболизма. Первые две группы предназначены для коррекции АГ, β-адреноблокаторы – препараты выбора у пациентов с постинфарктным кардиосклерозом, статины используются для устранения дислипидемии. Корректоры метаболизма оказывают цитопротективное действие в условиях гипоксии за счет устранения эндотелиальной дисфункции у пациентов с сосудистой коморбидностью. Одним из корректоров метаболизма является препарат Милдронат. В основе его действия – замедление транспорта жирных кислот, уменьшение их окисления, в результате чего снижается потребность клетки в кислороде. Препарат предотвращает накопление токсических промежуточных продуктов метаболизма (ацилкарнитин и ацил-КоА) и вызванные ими повреждения клеток [1]. Милдронат стимулирует аэробный гликолиз, что предупреждает накопление лактата в тканях [2]. Стимулируя рецепторы ацетилхолина, он также вызывает индукцию эндотелиальной NO-синтазы. В результате увеличивается синтез оксида азота, что приводит к миорелаксации, улучшению микроциркуляции и эндотелиальной функции [3]. Милдронат относится ко второму поколению корректоров метаболизма. Это единственное лекарственное средство, одновременно снижающее уровни карнитина и триметиламина в плазме крови и подавляющее развитие атеросклероза посредством механизма, дополняющего действие статинов [4]. Поэтому включение корректоров метаболизма в состав фармакотерапии является важным компонентом в борьбе с коморбидной патологией.
Таким образом, ранее выявление ФР, адекватное и регулярное наблюдение участковым терапевтом и своевременное комплексное лечение сосудистой коморбидности представляют собой главные цели амбулаторного этапа медицинской помощи.



