В последние годы появляется все больше данных о том, что в развитии атеросклероза принимает участие желудочно-кишечный тракт (ЖКТ). Ишемия кишечника, неизбежная при выраженном атеросклеротическом поражении брыжеечных артерий, может играть значительную роль в бактериальной транслокации вследствие повышенной кишечной проницаемости. Повреждения кишечной стенки могут вести к ускоренной транслокации бактерий и/или эндотоксина. Рассматривая роль эндотоксина кишечной микрофлоры в развитии атеросклеротического процесса, необходимо вспомнить, что эндотоксин представляет собой липополисахарид (ЛПС), постоянно образующийся из внешней мембраны клеточной стенки грамотрицательных бактерий в результате самообновления клеточного пула, обладает широким спектром различных видов биологической активности и может взаимодействовать практически со всеми клетками [1–6].
В связи с выраженным токсическим действием на организм млекопитающих, ЛПС получил также название эндотоксина. В отличие от бактериальных экзотоксинов, выделяемых живой клеткой, эндотоксин выделяется во внешнюю среду, главным образом при непрерывном самообновлении бактериальных клеток. ЛПС обладает весьма широким спектром биологической активности. Попадая в организм, эндотоксин может действовать на различные клетки и вызывать целый ряд эффектов [6–8]. Исход взаимодействия с различными клетками зависит от концентрации ЛПС [4]. При попадании в кровоток физиологических доз ЛПС имеет место т.н. физиологическая системная эндотоксинемия [9], которая при увеличении концентрации эндотоксина в кровотоке проявляет агрессивные свойства, характеризующиеся очень широким спектром патогенного действия ЛПС. С увеличением дозы эндотоксин вызывает гиперактивацию клеток и систем, что может приводить к развитию диссеминированного внутрисосудистого свертывания, эндотоксинового шока и полиорганной недостаточности.
В 1952 г. O. Westphal, O. Luderitz [10] расшифровали биохимическую формулу ЛПС. Его молекула состоит из трех фрагментов: хвоста (полисахарида), ядра и липида А [11, 12]. Первые два определяют видоспецифичность эндотоксина различных грамотрицательных бактерий (за счет высокого полиморфизма сахаров), которая лежит в основе серологической идентификации различных видов и штаммов микроорганизмов. В то же время липид А характеризуется высокой консервативностью биохимической структуры, не обладает видовой специфичностью, содержит около 200 эпитопов и независимо от своего происхождения практически идентичен для всех ЛПС. Именно липид А обусловливает весь очень широкий спектр общих биологических свойств эндотоксина. В естественных условиях синтеза ЛПС генетически дефектными (по набору полимерсинтетаз) штаммами грамотрицательных бактерий самая минимальная по массе структура эндотоксина, сохраняющая жизнеспособность микроорганизма, состоит из липида А и трех остатков кетодезоксиоктулоновой кислоты. Этот дефектный ЛПС сохраняет весь спектр общих биологических свойств эндотоксина и получил название Re-гликолипида. Именно эта гидрофобная структура ответственна за весь спектр общих для ЛПС любого происхождения свойств, который может иметь как полезную, так и патогенную направленность своего биологического действия.
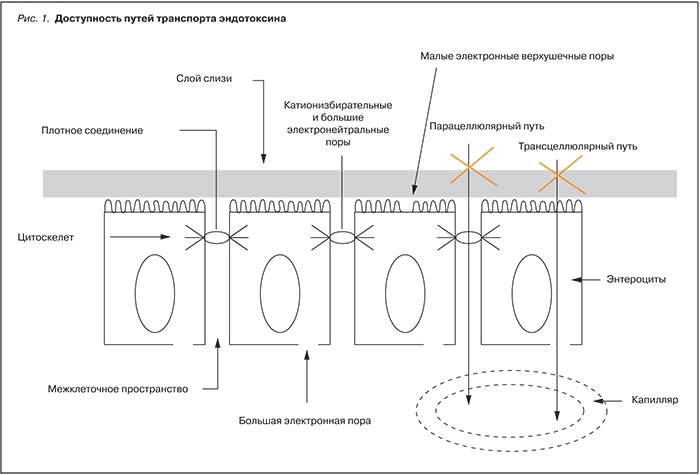
В зависимости от дозы эндотоксин вызывает повреждения клеток или стимулирует синтез ряда физиологически активных медиаторов, таких как эндогенный пироген, интерлейкины, туморнекротизирующий фактор и другие [2–5, 8, 9]. Предполагается, что эндотоксин может быть серьезным стимулом продукции цитокинов при атеросклерозе путем воздействия на мононуклеарные клетки [12, 13]. Согласно этой гипотезе, эндотоксин попадает в систему кровообращения посредством транслокации из кишечника. Различают два пути транспорта веществ в эпителии слизистой оболочки кишечника: через клетку (трансцеллюлярный) и через плотный контакт по межклеточным пространствам эпителиальных клеток (парацеллюлярный, шунтирующий) (рис. 1). Трансцеллюлярный транспорт может осуществляться посредством двух механизмов: трансмембранного переноса и эндоцитоза (пиноцитоза). Поскольку размеры молекулы эндотоксина – до 75 килодальтон, она не способна проникать в клетку парацеллюлярным путем, но и проникновение трансмембранным переносом невозможно по той же причине. Таким образом, транслокация эндотоксина через кишечный барьер возможна только путем эндоциноза. Именно эндоцитоз является тем каналом, по которому происходит перенос не только ионов и мономеров, но и большинства крупномолекулярных соединений, к коим и относится эндотоксин.
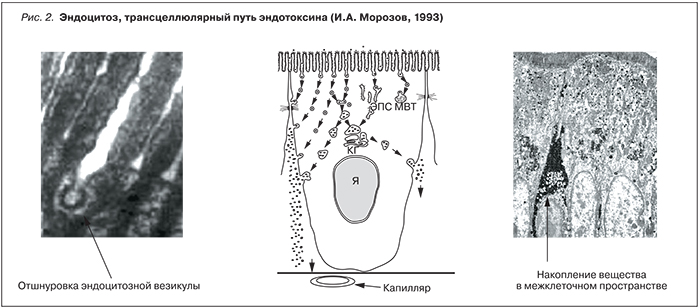
Эндоцитоз – это процесс образования эндоцитозных инвагинаций апикальной мембраны, расположенных между основаниями микроворсинок энтероцита, и транспорт крупномолекулярных веществ, попавших в эти инвагинации. При образовании пиноцитозных инвагинаций происходит локальное растяжение апикальной мембраны, затем транспорт везикулы и высвобождение ее содержимого (эндотоксина) в межклеточное пространство, а уже оттуда эндотоксин попадает в капиллярное русло (рис. 2).
В физиологических условиях эндотоксин поступает из кишечника дробно, а потому и обнаруживается в плазме периферической крови в концентрации до 1,0 Eu/мл. Средние значения не превышают 0,2 Eu/мл (16,6 пг/мл), постоянное присутствие в общей гемоциркуляции ЛПС-позитивных полиморфноядерных лейкоцитов получило название «системная эндотоксинемия» [12–14].
При хронических заболеваниях расстройство процесса всасывания в кишечнике, особенно у больных пожилого и старческого возраста, обусловлено дистрофическими, атрофическими и склеротическими изменениями слизистой оболочки кишки. При этом укорачиваются и уплощаются ворсины и крипты, уменьшается число микроворсинок, в стенке кишки разрастается фиброзная ткань, нарушается крово- и лимфообращение. Уменьшение общей всасывательной поверхности и всасывательной способности приводит к нарушению процессов кишечного всасывания. Этот патологический процесс в тонкой кишке, возникающий при хронических заболеваниях, характеризуется истончением слизистой оболочки кишки, потерей дисахаридаз щеточной каймы, нарушением всасывания моно- и дисахаридов, уменьшением переваривания и всасывания белков, увеличением времени транспорта содержимого по кишке, заселением бактериями верхних отделов тонкой кишки [15–19].
Морфологически у больных с выраженными проявлениями атеросклероза и хронической сердечной недостаточностью (ХСН) отмечаются выраженный отек и участки кровоизлияния в слизистой оболочке сигмовидной кишки (рис. 3). Изменение показателей бактериального исследования копрокультуры у больных с ХСН представлено в табл. 1. Обращает на себя внимание, что дисбиотические изменения нарастают с увеличением степени тяжести сердечной недостаточности.
 Нередко у пожилых больных недостаточно сбалансированное питание приводит к изменениям в тонкой кишке, при которых нарушаются обменные процессы и развивается нарушение микробиоценоза кишечника. Вследствие этого в организм в недостаточном количестве поступают продукты гидролиза белков, жиров, углеводов, а также минеральных солей и витаминов. Развивается картина алиментарной дистрофии. При этом проявления патологического процесса в тонкой кишке, возникающего при белковой недостаточности, напоминает таковые при заболеваниях кишечника. Часто причинами развития дисбактериоза у больных являются заболевания соединительной ткани, в основе которых лежит ее системное или локальное поражение. При системных болезнях соединительной ткани в основе поражения кишечника лежит атрофия мышечных волокон, замещение их фиброзной соединительной тканью, инфильтрация мышечного слоя стенки кишки лимфоидными элементами. Характерны также изменения сосудов: артерииты, пролиферация интимы артерий среднего и малого калибра с выраженным сужением их просвета. Наиболее часто поражаются подслизистый и мышечный слои стенки кишки. В результате этих изменений возникают нарушения двигательной, всасывательной и пищеварительной функций кишечника. Возникающие нарушения двигательной функции, лимфообразования и кровоснабжения кишечной стенки ведут к стазу содержимого кишечника, развитию синдрома нарушенного всасывания и росту бактериальной флоры с ее дисбалансом [19–21,28].
Нередко у пожилых больных недостаточно сбалансированное питание приводит к изменениям в тонкой кишке, при которых нарушаются обменные процессы и развивается нарушение микробиоценоза кишечника. Вследствие этого в организм в недостаточном количестве поступают продукты гидролиза белков, жиров, углеводов, а также минеральных солей и витаминов. Развивается картина алиментарной дистрофии. При этом проявления патологического процесса в тонкой кишке, возникающего при белковой недостаточности, напоминает таковые при заболеваниях кишечника. Часто причинами развития дисбактериоза у больных являются заболевания соединительной ткани, в основе которых лежит ее системное или локальное поражение. При системных болезнях соединительной ткани в основе поражения кишечника лежит атрофия мышечных волокон, замещение их фиброзной соединительной тканью, инфильтрация мышечного слоя стенки кишки лимфоидными элементами. Характерны также изменения сосудов: артерииты, пролиферация интимы артерий среднего и малого калибра с выраженным сужением их просвета. Наиболее часто поражаются подслизистый и мышечный слои стенки кишки. В результате этих изменений возникают нарушения двигательной, всасывательной и пищеварительной функций кишечника. Возникающие нарушения двигательной функции, лимфообразования и кровоснабжения кишечной стенки ведут к стазу содержимого кишечника, развитию синдрома нарушенного всасывания и росту бактериальной флоры с ее дисбалансом [19–21,28].
У лиц пожилого возраста наблюдается снижение желудочной секреции, уменьшение кислотности (увеличение рН) желудочного сока, снижение кровотока в кишечнике, более быстрое опорожнение желудка, снижение моторики кишечника, ослабление системы активного всасывания [22]. Указывается на снижение с возрастом количества абсорбирующих клеток, что приводит к уменьшению поверхности всасывания [22].
В данном случае лишь особенность микроэкологии ЖКТ (относительно небольшое содержание грамотрицательной флоры в 12-перстной и тощей кишке) препятствует активному поступлению эндотоксина в кровоток из этой зоны. В определенной мере всасывание эндотоксина тормозится наличием большого количества желчных кислот в полости тонкой кишки [23]. Однако даже в физиологических условиях небольшие количества ЛПС проникают в портальный кровоток [24, 25]. Возрастная инволюция кишечника характеризуется нарушением пристеночного переваривания, истончением его стенки, повышением проницаемости для экзо- и эндотоксинов.
Воспалительные цитокины, физические факторы (такие как осмотическое давление), лекарственная терапия (особенно нестероидные противовоспалительные средства) и синдром нарушенного всасывания могут значительно изменять кишечную проницаемость посредством их воздействия на непроницаемость. Более того, тип бактериальной колонизации кишечника влияет на кишечную проницаемость. Колонизация Escherichia coli, Klebsiella pneumonia и Streptococcus viridans значительно увеличивает кишечную проницаемость, в то время как колонизация Lactobacillius brevis имеет противоположное действие [26].
Из просвета кишечника человека в норме в кровоток проникает лишь незначительное количество эндотоксина, т.к. у человека имеется ряд гуморальных и клеточных факторов, связывающих эндотоксин: липопротеиды высокой удельной плотности, антитела, в частности к гликолипиду хемотипа Re, клетки Купффера, полиморфноядерные лейкоциты и макрофаги. Еще недавно считалось, что в физиологических условиях эндотоксин проникает из кишечника лишь в воротную вену, где захватывается в основном клетками Купффера. Однако исследования последних лет показали, что эндотоксин в небольших количествах обнаруживается у здоровых людей и даже у новорожденных: в системном кровотоке, в плазме крови и на поверхности полиморфноядерных лейкоцитов (ПМЛ). В физиологических условиях нормально функционирующие антиэндотоксиновые факторы обеспечивают достаточно эффективную защиту организма от вредных последствий воздействия эндотоксина. Однако ситуация существенно изменяется при стрессе, при действии проникающей радиации и других экологически вредных факторах, при различных заболеваниях инфекционного и неинфекционного генеза. В этих условиях увеличивается проникновение эндотоксина в системный кровоток, что приводит к истощению факторов антиэндотоксинового иммунитета. При этом резко снижаются титры антител к гликолипиду хемотипа Re, нейтрализующих эндотоксин, ПМЛ, связывающих эндотоксин in vivo, в кровотоке. Также практически исчезают ПМЛ, способные связывать эндотоксин in vitro. Иными словами, исчезают резервы связывания эндотоксина антителами и гранулоцитами, и организм становится почти полностью беззащитным к повторным атакам вновь поступающего в кровь эндотоксина [12, 13].
Наличие свободно циркулирующего эндотоксина в плазме квалифицировано как физиологическое явление, поскольку ЛПС, обладая широким спектром биологически полезных свойств, активирует миелоцитарный росток гемопоэза на всех этапах дифференцировки и созревания клеток. Определенные нами титры антигликолипидных антител в общем кровотоке лиц старших возрастных групп в иммуноферментном анализе составляют 3,50±0,25 у.е. и, по-видимому, являются достаточными для купирования патогенных эффектов эндотоксина в концентрациях, не превышающих 0,2 Eu/мл.
Однако механизмы повреждающего действия эндотоксина на клетки эндотелия ясны недостаточно. Не исключено, что это действие опосредуется через ПМЛ. В настоящее время известны несколько видов взаимодействия ЛПС с ПМЛ и макрофагами: а) ЛПС связывается с рецепторным белком СД18, причем такое связывание не является необходимым для активации лейкоцитов; б) ЛПС связывается сначала с белком LBP (lipopolysaccharide binding protein – липополисахарид-связывающий белок) плазмы, а затем в комплексе с этим белком реагирует с рецептором СД14, что ведет к активации лейкоцитов; в) неспецифическое взаимодействие ЛПС с мембранами клеток. К этому следует добавить также описанное Fc-зависимое связывание ЛПС армированными антиэндотоксиновыми антителами. Еще cледует отметить активирующее действие ЛПС через Toll-подобные рецепторы (Toll-like receptors, образраспознающие рецепторы) – TLR4 [3, 7–9, 33]. Вклад этих видов связывания в проективную и патогенетическую роли гранулоцитов пока еще не изучен. По-видимому, исход взаимодействия ЛПС с лейкоцитами и свойства ПМЛ, индуцированные ЛПС, зависят от концентрации эндотоксина: при относительно низких концентрациях имеет место активация и положительный (физиологический) эффект, при высоких концентрациях – гиперактивация, перегрузка лейкоцитов эндотоксином и патологический эффект (развитие органопатологии). При гиперактивации лейкоцитов и их разрушении в окружающую среду выбрасывается много ферментов, в частности эластаза и другие лизосомальные ферменты, которые могут оказывать повреждающее действие на клетки эндотелия [2, 3, 15].
Проведенные нами исследования позволили установить тот факт, что в крови лиц старших возрастных групп содержатся достаточно высокие титры антигликолипидных антител. Тот факт, что с увеличением возраста титр антител изменялся незначительно, позволяет утверждать, что и в старческом возрасте, и у долгожителей сохраняется синтез собственных антител к эндотоксину, что также косвенно подтверждает универсальное действие эндотоксина на организм человека (рис. 4).
Другим, на наш взгляд чрезвычайно интересным, фактом, является обнаруженный нами феномен ослабленности гранулоцитарного звена антиэндотоксиновой защиты. Довольно неожиданным для нас явилось (при исследовании в мазках крови с помощью ЛПС-теста) практически полное отсутствие не только резервов связывания эндотоксина гранулоцитами, но и недостаточное значение или полное отсутствие ЛПС-позитивных лейкоцитов в крови. Связывание эндотоксина гранулоцитами является очень важным звеном антиэндотоксиновой защиты и ЛПС-элиминирующей функции. Кроме того, акцепция эндотоксина гранулоцитами обусловливает активацию антимикробного потенциала этих клеток и представляет важное звено общей антибактериальной резистентности организма в целом. Снижение нативных ЛПС-позитивных ПМЛ в системном кровотоке лиц старших возрастных групп, по-видимому, является следствием определенной возрастной неполноценности этой популяции клеток, которые, как известно, выполняют функции первого антибактериального барьера. Мы допускаем, что именно этим обстоятельством объясняется подверженность организма лиц старших возрастных групп к неблагоприятному течению осложнений атеросклероза и особенности бактериальных инфекций.
Снижение ЛПС-позитивных гранулоцитов в общем кровотоке лиц старших возрастных групп, при наличии достаточно высоких титров антигликолипидных антител, свидетельствует, на наш взгляд, и о некоторой неспособности ПМЛ у лиц старшего и пожилого возраста к Fc-связыванию вообще (т.е. и иных антигенов), что, безусловно, говорит об определенной возрастной «дефектности» системы ПМЛ у лиц инволюционного периода. Под действием эндотоксина в лейкоцитах активируются и ферменты перекисного окисления липидов, конечные продукты которого также могут вызывать повреждения эндотелия [12, 14, 20, 24, 25, 27].
 В действие эндотоксина на эндотелий может вовлекаться также система комплемента.
В действие эндотоксина на эндотелий может вовлекаться также система комплемента.
В частности, с эндотоксином взаимодействует фракция комплемента С5а [13, 18, 29]. Наконец, возможен еще один механизм действия эндотоксина на эндотелий. На поверхности клеток эндотелия находится фибронектин, который играет важную роль во взаимодействии клетка–клетка и в прикреплении клетки к подслою. Фибронектин плазмы по составу антигенов идентичен фибронектину на поверхности клеток и также участвует в прикреплении клеток друг к другу и к базальной мембране. При эндотоксинемии фибронектин плазмы может разрушаться лейкоцитарными протеазами и расходоваться в качестве опсонина, что может приводить к его вымыванию с поверхности клеток эндотелия и их слущиванию. После введения эндотоксина клетки эндотелия обнаруживаются в кровотоке у 88% подопытных животных, тогда как до введения эндотоксина они обнаруживались лишь у 12% здоровых животных [30–32].
Возможно, что при эндотоксинемии реализуются все перечисленные выше механизмы, вследствие чего могут возникать более или менее множественные повреждения сосудистой стенки. Очень важно отметить, что эндотоксин, вызывая повреждения эндотелия, стимулирует затем репарацию этих повреждений путем активации синтеза ДНК и деления клеток эндотелия в пораженных участках. Например, повреждения стенки аорты при слущивании 1–2 эндотелиальных клеток могут быстро, в течение 8 ч, закрываться. Исследования с помощью ауторадиографии выявили ярко выраженное увеличение репликации клеток эндотелия в период до 96 ч после инъекции эндотоксина. При этом меченый тимидин неравномерно распределялся по эндотелию сосудов. Наибольшее количество метки после введения эндотоксина наблюдалось в дуге аорты (в 8 раз выше относительно нормы), в пораженных участках, интенсивно окрашивающихся синькой Эванса, что свидетельствует о повышенной проницаемости этих участков [17]. Более низкие концентрации были отмечены в сосудах почки (в 7 раз выше относительно нормы), в капиллярах легких (в 3 раза выше относительно нормы). Возникновение локальных повреждений эндотелия и повышение проницаемости сосудов могут вызывать накопление липидов и липопротеинов в подэндотелиальном слое и увеличение количества гладкомышечных клеток. Это, в свою очередь, может инициировать развитие атеросклероза. Важную роль при этом играют липопротеиды низкой плотности (ЛПНП), избыточное содержание которых в плазме способствует развитию атеросклероза. Кроме того, ЛПНП повышают токсичность ЛПС, по-видимому, за счет формирования комплексов между окисленными формами ЛПНП и ЛПС, которые, взаимодействуя с т.н. скаванджер-рецепторами (ацетил-ЛПНП-рецепторы), легко проникают в клетки и вызывают их гибель [38]. При этом необходимо учитывать, что окисленные формы ЛПНП сами по себе токсичны для клеток, особенно для пролиферирующих, а эндотоксин стимулирует выброс ферментов, окисляющих ЛПНП.
В отличие от ЛПНП, липопротеиды высокой плотности (ЛПВП) снижают токсичность ЛПС. ЛПВП обладают высокой ЛПС-связывающей активностью с образованием довольно устойчивого комплекса, что было доказано с использованием методов равновесного ультрацентрифугирования в градиенте плотности и иммуноаффинной хроматографии. Комплексы ЛПВП–ЛПС довольно долго циркулируют в кровотоке и накапливаются в тканях, обладающих механизмом специфического захвата липопротеина, в частности в надпочечниках. Эндотоксинсвязывающая активность ЛПВП может меняться в ходе различных заболеваний. Недостаточная эндотоксинсвязывающая активность ЛПВП может способствовать возникновению повреждения эндотелия. Кроме того, при перегрузке ЛПВП эндотоксином снижается их способность связывать холестерин. Между холестерином и ЛПС имеет место конкуренция за ЛПВП. При введении эндотоксина отмечается заметное снижение холестерина, связанного с ЛПВП, и показателя, характеризующего отношение холестерина, связанного с ЛПВП, к общему холестерину плазмы крови. Такие изменения носят атерогенный характер.
Схожую картину наблюдал М.Ю. Яковлев в экспериментах на животных. В частности, им установлен чрезвычайно важный факт участия кишечного ЛПС в патогенезе и формировании атеросклеротического повреждения эндотелия свойственного этому заболеванию и его осложнений [12, 13].
Предположения о возможной роли эндотоксина как фактора, инициирующего развитие атеросклероза, высказывали авторы ряда работ, которые наблюдали формирование повреждений эндотелия в коронарных артериях после введения ЛПС [5, 36]. Имеющиеся в настоящее время данные [36, 37] о постоянном присутствии эндотоксина в кровотоке в норме и при различных видах инфекционной и неинфекционной патологии заставляют рассматривать эндотоксин кишечной микрофлоры в качестве одного из очень важных факторов, участвующих в патогенезе атеросклероза. Причем проведенные нами исследования подтвердили значение дисбактериоза, столь часто встречающегося в пожилом и старческом возрасте, в процессе повышения системной эндотоксинемии. Обнаруженный нами феномен ослабленности гранулоцитарного звена антиэндотоксиновой защиты играет важнейшую роль в инициации атерогенеза, т.к. нормально функционирующее гранулоцитарное звено справляется даже с значительно повышенным содержанием эндотоксина.
Таким образом, эндотоксин обладает всеми необходимыми для инициации и/или прогрессирования атеросклероза прямыми и опосредованными свойствами: способностью повреждать и слущивать эндотелиальные клетки, обусловливать появление «пенистых клеток» (активированных макрофагов), вызывать десмолитические изменения стромы и активировать пролиферативный процесс. Морфологическим манифестом перенесенного эпизода гиперэндотоксинемии можно считать как минимум одну атеросклеротическую бляшку. По мере старения организма вероятность возникновения гиперэндотоксинемии значительно увеличивается в силу инволютивных изменений в органах (ЖКТ, костный мозг, тимус и др.), ответственных за синтез факторов антиэндотоксиновой защиты, и инволюции адренергических терминалей сосудов, которые демфируют (сглаживают) «адреналиновые залпы» надпочечников, что, по-видимому, и является одной из главных причин прогрессирования атеросклероза.



