Среди лиц с артериальной гипертензией (АГ) подавляющее большинство (90–95%) имеет эссенциальную АГ – гипертоническую болезнь [1]. Остальные страдают симптоматической АГ, в основе которой главным образом лежит почечная патология, более чем у 90% больных – ренопаренхиматозные заболевания. Это, прежде всего, диффузные заболевания почек с преимущественным поражением почечных клубочков (первичные и вторичные гломерулонефриты) [2, 3].
Уточнение механизмов прогрессирования хронических гломерулонефритов (ХГН) – одна из актуальных задач современной нефрологии. В настоящий момент признано, что нарастающее снижение почечных функций при ХГН обусловлено не только иммунным воспалением, но и неиммунными факторами, важнейшим из которых является ренопаренхиматозная АГ (РАГ) [2–4]. Поэтому изучение патогенетических звеньев формирования РАГ, поиск, исходя из этого, конкретных путей ее лечения представляют собой практически значимые задачи с позиций отдаления сроков наступления и прогрессирования хронической почечной недостаточности.
Особенностью патогенеза РАГ признается сложный «порочный» круг, где почки являются одновременно причиной АГ и ее органом-мишенью [3, 5].
На современном этапе интимные механизмы формирования и прогрессирования РАГ до конца не изучены. Это является предметом продолжающихся глубоких исследований и научных споров.
Считается, что в патогенезе РАГ весьма значимо нарушение основных механизмов поддержания артериального давления: расстройство водно-электролитного баланса (задержка натрия и воды), активация прессорных гормональных систем и угнетение депрессорных механизмов, вегетативная дисрегуляция. При этом следует согласиться с мнением, что, скорее всего, имеет место сочетанное воздействие множества указанных факторов на фоне одного или, возможно, нескольких ведущих [2, 3, 6].
В последние годы среди звеньев патогенеза АГ достаточное внимание уделяется состоянию вегетативной нервной системы (ВНС) и в частности ее роли в регуляции сосудистого тонуса [7–9]. Определенный опыт по изучению этой проблемы накоплен при эссенциальной АГ (ЭГ), ишемической болезни сердца, хронической сердечной недостаточности [10–13].
Вопрос о роли ВНС в патогенезе нефрогенной АГ продолжает находиться в стадии изучения. В доступной литературе встречается немного работ на эту тему. Преимущественно они касаются больных, находящихся в стадии додиализной и диализной почечной недостаточности [14–17]. При этом полученные результаты зачастую существенно различаются и не имеют однонаправленной трактовки. Это касается утверждения о раннем изменении тонуса как парасимпатического, так и симпатического отдела ВНС у больных АГ, находящихся на гемодиализе. Однако не обозначен характер угнетения парасимпатических влияний (изолированно или в сочетании с дисфункцией симпатической нервной системы), тем более что конкретные показатели качественных и количественных изменений со стороны этих звеньев ВНС авторами публикаций не приводятся [16–18].
В настоящей работе нами предпринята попытка оценить состояние вегетативной регуляции сердечно-сосудистой системы (ССС) у больных РАГ, имеющих сохранную функцию почек с помощью современного неинвазивного метода исследования ВНС – вариабельности синусового ритма сердца (ВРС).
Материалы и методы
Обследованы 136 больных ХГН на базе нефрологического отделения Нижегородской областной клинической больницы им. Н.А. Семашко. Из них основную группу (100 человек – 64 мужчины и 36 женщин в возрасте 41,4±11,6 года) составили больные гипертонической формой ХГН (далее обозначенные как пациенты с РАГ). В качестве групп сравнения в исследование были включены 36 больных ХГН без АГ (23 мужчины и 13 женщин в возрасте 43,8±12,2 года с изолированным мочевым синдромом) и 20 здоровых лиц в возрасте 36,4±19,1 года (12 мужчин и 8 женщин). Группы были сопоставимы по возрастному и половому составу.
Диагноз ХГН был установлен и верифицирован на основании клинических, лабораторных, инструментальных данных и нефробиопсии. В подавляющем большинстве случаев (55%) определялся мезангиопролиферативный ГН, несколько реже выявлялись мезангиокапиллярный ГН (21%) и ГН с минимальными изменениями (11%). Также имели место мембранозный ГН (3%), фокально-сегментарный гломерулосклероз (5%) и фибропластический ГН (5%).
Все обследуемые пациенты имели сохранную функцию почек (по классификации С.И. Рябова и соавт., 2000) [19]. При этом скорость клубочковой фильтрации, рассчитанная по формуле CKD-EPI [20], в обеих группах больных ХГН составляла не менее 60 мл/мин/1,73м², следовательно, стадия хронической болезни почек была не тяжелее второй. Степень АГ оценивали согласно классификации ВНОК [1]. Среди гипертензивных больных 22 человека имели 1 степень (ст.), 52 – 2 ст. и 26 – 3 ст. АГ.
Для оценки состояния вегетативной регуляции ССС, в частности влияния симпатических и парасимпатических влияний на синусовый узел сердца (СУС), использовали метод исследования показателей ВРС. Он основывается на изменчивости длительности интервалов RR, которые тесно коррелируют с влияниями симпатического и парасимпатического отделов ВНС на сердце [21, 22].
Оценку ВРС осуществляли с помощью системы «Астрокард» на основе 24-часового мониторирования ЭКГ. При этом определяли показатели ВРС во временной (SDNN, SDANN, SDNNi, NN50, отражающие в целом вегетативные влияния ВНС на сердце) и частотной областях интервалов RR (TotP, также отражающий в целом влияние ВНС, и LF, HF – показатели симпатического и парасимпатического влияния ВНС на сердце). Согласно рекомендациям, при интерпретации полученных результатов отражением роста воздействия на СУС вегетативных влияний (симпатического и парасимпатического) считали увеличение всех показателей ВРС, а снижение последних – уменьшением влияний ВНС [21, 22]. При этом значение LF (низкочастотный параметр спектрального анализа ВРС) расценивалось как показатель симпатических, а NN50 (параметр временного анализа ВРС, отражающий изменчивость интервалов RR) и HF (высокочастотный параметр спектрального анализа ВРС) как показатели парасимпатических влияний на ССС [21]. Кроме того, учитывалось количественное отношение LF/HF как отражение вагосимпатического баланса. По данным литературы, у здоровых лиц этот показатель колеблется от 1 до 1,5 [21]. Рост симпатических влияний проявляется увеличением показателя LF компонента, а парасимпатических – HF компонента [21, 22].
В диапазоне временного анализа ВРС уделялось внимание циркадному индексу (ЦИ) в виде отношения средней дневной к средней ночной частоте сердечных сокращений. Циркадная изменчивость параметров ритма сердца зависит, как известно, в первую очередь от его вариабельности, косвенно отражая функциональные резервы ССС. При этом показатель ЦИ у здоровых составляет в среднем 1,32 с колебаниями от 1,24 до 1,44 [22].
 Анализ параметров ВРС проводился следующим образом. Показатели ВРС у больных РАГ сравнивались с таковыми у здоровых лиц и нормотензивных пациентов. Здоровые лица при этом представляли вариант показателей нормы ВРС. Кроме того, проводился сравнительный анализ показателей ВРС у больных РАГ с учетом тяжести синдрома АГ.
Анализ параметров ВРС проводился следующим образом. Показатели ВРС у больных РАГ сравнивались с таковыми у здоровых лиц и нормотензивных пациентов. Здоровые лица при этом представляли вариант показателей нормы ВРС. Кроме того, проводился сравнительный анализ показателей ВРС у больных РАГ с учетом тяжести синдрома АГ.
В исследование не включались лица, имеющие патологию, которая могла сказаться на методике исследования и полученных результатах ВРС: перенесшие острое нарушение мозгового кровообращения, инфаркт миокарда; имевшие нарушения ритма сердца, в т.ч. мерцательную аритмию, частую эктрасистолию, нарушение проводимости сердца, тремор верхних конечностей; страдавшие алкоголизмом и психическими заболеваниями.
Исследование проводилось при поступлении больных в нефрологический стационар до назначения антигипертензивной и иммуносупрессивной терапии. При этом необходимо отметить, что до поступления в стационар ни один пациент не получал адекватную антигипертензивную терапию.
Полученные результаты обработаны при помощи пакета программ Statistica 6.0 (StatSoft, Inc., США).
Результаты и обсуждение
При обследовании больных ХГН с синдромом АГ обращала на себя внимание их исходно низкая приверженность к антигипертензивной терапии. Большая часть пациентов считала главной задачей лечение основного заболевания. Они проявляли приверженность к патогенетической иммунносупрессивной терапии (даже при ее плохой переносимости) и мало обращали внимание на лечение АГ. Так, из 100 гипертензивных больных ХГН в начале настоящего исследования 43% считали лечение АГ неактуальным. Остальные 57% хотя и согласились с необходимостью ее терапии, но реально не лечились или лечились неадекватно (эпизодически, неэффективными дозами антигипертензивных препаратов). При анализе медицинской документации нами установлено, что в соответствии со стандартами лечения в стационаре или поликлинике при выявлении синдрома АГ всем больным ХГН назначалась антигипертензивная терапия. Но они, как правило, или не проводили лечение, или, начав, прекращали его самостоятельно, в дальнейшем применяя антигипертензивные средства лишь в случае гипертензивных кризов. При этом следует отметить, что даже при высоком артериальном давлении больные чувствовали себя удовлетворительно и сохраняли работоспособность, что является характерным для симптоматической АГ при ренопаренхиматозных заболеваниях.
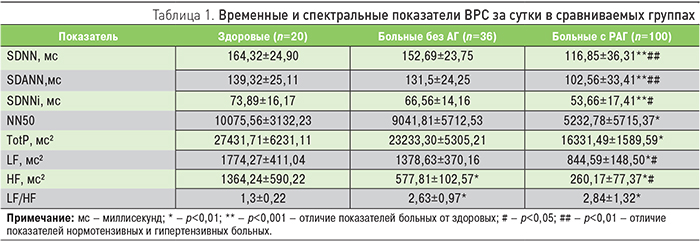
Оценка ВРС выявила признаки изменения вегетативной регуляции синусового ритма сердца у больных с РАГ в целом по группе. Об этом свидетельствовало снижение временных показателей (SDNN, SDANN, SDNNi, NN50) во всей группе гипертензивных больных в сравнении с нормотензивными и тем более со здоровыми лицами (табл. 1).
Подтверждало вегетативную дизрегуляцию ССС и снижение спектральных показателей ВРС. Из табл. 1 видно, что у гипертензивных больных в сравнении с нормотензивными пациентами отмечалась тенденция к уменьшению показателей TotP, LF и HF. При этом у лиц с РАГ, по сравнению со здоровыми, понижающаяся общая мощность (TotP) спектра ВРС свидетельствовала об уменьшении влияния на СУС как симпатических, так и парасимпатических воздействий в целом. С этим согласовывались значимо меньшие показатели как низкочастотного спектра (LF), так и, в еще большей степени, высокочастотного спектра волн (HF) у них.
Кроме снижения показателей ВРС у больных РАГ в целом (табл. 1), явно прослеживалось уменьшение значений NN50 и HF, отражающих угнетение влияния блуждающего нерва на СУС. Напротив, повышение показателя вагосимпатического баланса (LF/HF) свидетельствовало об одновременном увеличении активности влияний симпатической нервной системы.

Таким образом, по результатам исследования сложилось впечатление не только о снижении в целом вклада влияний ВНС в регуляцию деятельности СУС при РАГ, но и о существенной активации симпатических влияний при снижении парасимпатических.
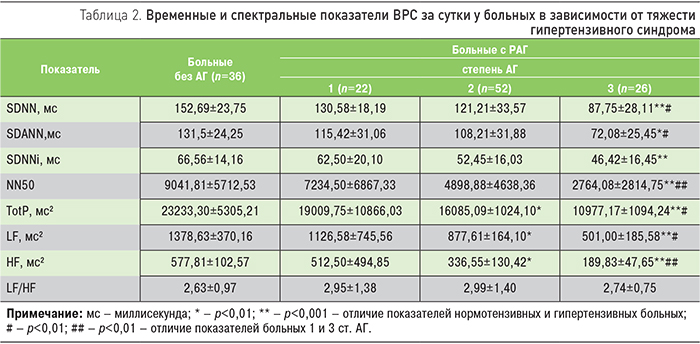
Более детальный анализ изменений показателей ВРС при РАГ позволил уточнить их особенности в зависимости от тяжести гипертензивного синдрома. При увеличении степени тяжести АГ обнаруживалось отчетливое снижение как временных, так и спектральных показателей ВРС (табл. 2). Достоверное различие показателей ВРС имело место между гипертензивными и нормотензивными больными ХГН, а также пациентами с АГ 1 и 3 ст.
Снижение показателей ВРС, по нашему мнению, могло быть обусловлено понижением в целом регулирующего влияния ВНС на деятельность сердца у больных РАГ, особенно при ее тяжелой степени. В то же время обнаруживалось разнонаправленное взаимоотношение влияния ее парасимпатического и симпатического отделов.
Из табл. 2 следует, что у больных АГ 3 ст. показатель NN50, отражающий снижение парасимпатических воздействий на СУС, достоверно снижался по сравнению с пациентами с нетяжелой АГ (1 ст.) и нормотензивными пациентами. С другой стороны, показатель вагосимпатического баланса (LF/HF) ВРС оставался повышенным у всех пациентов, независимо от наличия АГ, отражая во всех случаях признаки симпатической активности. Это дает основание предположить, что все больные ХГН имели признаки активации симпатической нервной системы в отношении деятельности сердца: при 1 ст. АГ в виде абсолютной симпатикотонии, а при 3 ст. – относительной. Одновременно при снижении влияний ВНС на СУС в целом у больных РАГ наблюдалось большее ослабление парасимпатических влияний на фоне относительной симпатической активации.
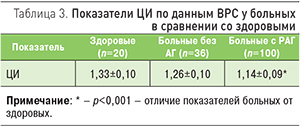
Закономерности, обнаруженные при анализе временных и спектральных показателей ВРС у исследуемых больных, проявлялись и в изменении ЦИ при РАГ (табл. 3). Из приведенных в табл. 3 данных следует, что ЦИ у нормотензивных больных приближался к нижней границе этого индекса у здоровых людей. У больных РАГ он был достоверно снижен как в сравнении с нормотензивными пациентами, так и со здоровыми лицами. Это, согласно данным литературы [22], может являться свидетельством снижения функциональных резервов ССС при РАГ.
Анализ ЦИ среди больных РАГ продемонстрировал усугубление нарушений функциональных резервов вегетативной регуляции ССС с утяжелением синдрома АГ (табл. 4), что выражалось в снижении этого индекса.
Заключение
Проведенное исследование позволило оценить состояние вегетативной регуляции деятельности сердца у больных РАГ, имеющих сохранную функцию почек. С учетом полученных данных можно полагать, что нарушение вегетативного гомеостаза с преобладанием симпатических влияний на сердце имеет место у всех больных РАГ с сохранной функцией почек. При формировании и нарастании тяжести синдрома АГ у этих больных происходит снижение функциональных резервов вегетативной регуляции сердечной деятельности. При 1 ст. АГ отмечается преобладание симпатических влияний на сердце при абсолютной симпатической активации. С нарастанием тяжести синдрома АГ до 2 и тем более 3 ст. у больных происходит снижение как симпатических, так и парасимпатических влияний на деятельность СУС в целом, однако при относительной симпатической активности.



