В настоящее время в мире 2,1 млрд человек имеет избыточную массу тела, индекс массы тела (ИМТ) от 25 до 29,9 кг/м2, в том числе 671 млн – ожирение (ИМТ ≥30 кг/м2). Темпы распространения ожирения стремительно растут. За последние три десятилетия распространенность избыточной массы тела и ожирения возросла на 27,5% у взрослых, на 47,1% – у детей. В Российской Федерации избыточная масса тела отмечается у 59,2% населения, непосредственно ожирения – 24,1%; в США – 67,4 и 33,3%, в Великобритании – 63,6 и 25,8% соответственно [1]. По данным Всемирной организации здравоохранения, ожирение предопределяет развитие до 44% всех случаев сахарного диабета (СД) 2 типа, до 23% – ишемической болезни сердца, до 41% – рака различной локализации [2].
В 2013 г. Американская медицинская ассоциация (American Medical Association, AMA) сочла необходимым подтвердить статус ожирения как хронического мультифакторного заболевания (в противовес определений ожирения как «состояния», «патологии», «нарушения» либо «фактора риска»). В 2014 г. статус ожирения как самостоятельного заболевания был задекларирован в регуляторных документах, рекомендациях Американской ассоциации клинических эндокринологов (American Association of Clinical Endocrinologists, AACE) и Американской коллегии эндокринологов (American College of Endocrinology, ACE). Соответственно, за последние годы приоритет научных исследований существенно изменился: акцент сместился от изучения последствий ожирения на идентификацию причин, уточнение патогенеза, разработку эффективной профилактики и терапии ожирения как самостоятельного заболевания. Помимо изменения характера питания, снижения двигательной активности, в качестве причин широкой распространенности ожирения рассматриваются генетические и эпигенетические факторы, увеличение возраста материнства, брачная ассортативность, эндокринные дизрапторы, глобальные изменения климата, нарушения циркадианных ритмов и состава кишечного микробиома [3]. Все эти факторы в конечном итоге нарушают механизмы регуляции энергетического баланса. Лекарственные средства, назначаемые для лечения ожирения, оказывают свой эффект с вовлечением как минимум одного из звеньев энергобаланса: 1) уменьшения суточного калоража либо всасывания нутриентов; 2) повышения энергозатрат [4]. Механизм действия большинства препаратов – как зарегистрированных, так и находящихся на стадии клинических исследований – преимущественно центральный; мишенями являются ключевые структуры центральной нервной системы, участвующие в регуляции аппетита.
ОСНОВНЫЕ ПРИНЦИПЫ РЕГУЛЯЦИИ ЭНЕРГЕТИЧЕСКОГО БАЛАНСА
Масса тела определяется балансом между потреблением энергии и ее расходом. Несмотря на ежедневную вариабельность состава пищи и физических нагрузок, у взрослого здорового человека масса тела остается стабильной на протяжении многих лет. При ожирении поступление энергии превышает ее затраты [5]. В регуляции энергетического баланса задействованы центральные и периферические механизмы. Центральный контроль реализуется с участием эффекторных систем головного мозга (нейропептиды, моноамины, опиоиды, эндоканнабиноиды и др.). Периферическая регуляция обеспечивается сигналами, исходящими от гормонов, характеризующих объем жировых депо (лептин, инсулин), ряда других гормонов желудочно-кишечного тракта (глюкагоноподобный пептид-1, грелин и т.д.), нутриентов (глюкоза, свободные жирные кислоты и др.). Центральная нервная система получает информацию о состоянии энергетического статуса организма от периферических органов с помощью метаболических, эндокринных и нейрональных сигналов. На основании анализа поступившей информации формируются адекватные реакции, обеспечивающие долгосрочную (поддержание массы тела) и краткосрочную (инициация либо прекращение приема пищи) регуляцию энергообмена. За реализацию гомеостатических механизмов отвечают гипоталамус и стволовые отделы головного мозга. Эти отделы мозга тесно взаимодействуют с кортико-лимбическими структурами, осуществляющими гедонистический контроль пищевого поведения (его когнитивные, мотивационные и эмоциональные составляющие элементы) [5–7] (рис. 1).
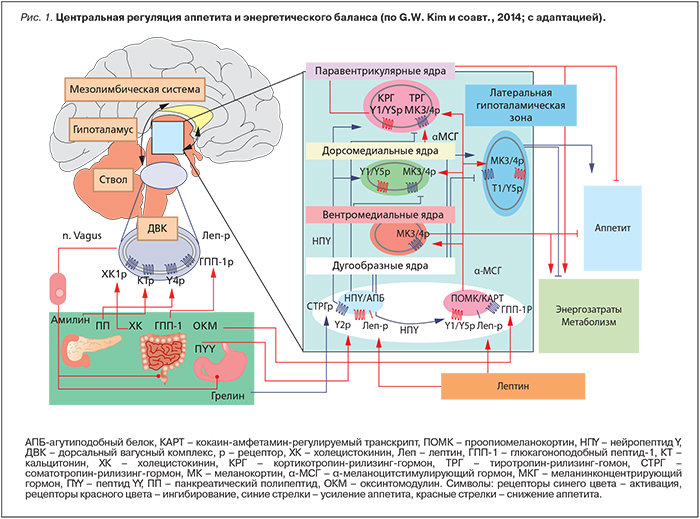
Дугообразным ядрам гипоталамуса принадлежит приоритет в интеграции сигналов, регулирующих энергетический гомеостаз. Привилегированность дугообразных ядер в гомеостатическом контроле энергообмена определяется их соседством со срединным возвышением – одним из циркумвентрикулярных органов головного мозга, капилляры которых имеют фенестры (окошки). Наличие фенестр создает идеальные условия преодоления гематоэнцефалического барьера для множества периферических гормональных сигналов.
Дугообразные ядра гипоталамуса содержат два дискретных пула нейронов. Один из них, продуцирующий нейропептид Y (НПY) и агутиподобный белок (АПБ), стимулирует прием пищи (т.е. оказывает анаболическое воздействие); другой пул клеток, вырабатывающий проопиомеланокортин (ПОМК) и кокаин-амфетамин-регулируемый транскрипт (КАРТ), подавляет аппетит (катаболический эффект). Учитывая, что именно эти группы клеток в первую очередь получают и преобразовывают поступающую с периферии информацию о состоянии энергетического баланса, их относят к нейронам первого порядка.
Обе группы нейронов связаны с паравентрикулярными, вентромедиальными ядрами, дорсомедиальной, латеральной и перифорникальной областью гипоталамуса, где содержатся нейроны второго порядка, также участвующие в регуляции обмена энергии. ПОМК- и АПБ-содержащие нейроны дугообразных ядер прямо или косвенно взаимодействуют с множеством гормонов, нейромедиаторов и нутриентов, вовлеченных в регуляцию энергетического баланса, в том числе с лептином, инсулином, глюкозой, грелином, пептидом YY, нейропептидом Y, β-эндорфином, эндогенными каннабиноидами, гамма-аминомасляной кислотой, орексинами, дофамином, серотонином и т.д. Инсулин и лептин ингибируют активность НПY/АПБ-содержащих нейронов и стимулируют ПОМК/КАРТ-продуцирующие нейроны, что приводит к подавлению аппетита и снижению массы тела. Грелин повышает аппетит путем блокады ПОМК/КАРТ-нейронов и активации НПY/АПБ-нейронов [8–10].
Помимо гипоталамуса, важнейшую роль в гомеостатической регуляции энергообмена играет ствол мозга. Основной структурой ствола, принимающей участие в энергообмене (интерпретации периферических сигналов и дальнейшей их трансляции в гипоталамус) является дорсальный вагусный комплекс. Он включает дорсальные ядра блуждающего нерва, ядра одиночного тракта и заднюю крайнюю область (area postrema). Задняя крайняя область (участок ромбовидной ямки, расположенный кзади и латерально от треугольника блуждающего нерва), как и срединное возвышение, относится к числу циркумвентрикулярных органов. Благодаря неполному гематоэнцефалическому барьеру в этой зоне, периферические сигналы насыщения имеют возможность непосредственно поступать в ствол мозга. Кроме того, обширные нейрональные связи между стволом и гипоталамическими ядрами обеспечивают альтернативный путь коммуникации циркулирующих сигналов голода и насыщения с гипоталамусом. Нейроанатомическую связь между желудочно-кишечным трактом и мозгом обеспечивает блуждающий нерв, его афферентные волокна передают информацию о состоянии наполнения желудка, уровне гастро-интестинальных гормонов и свободных жирных кислот [5, 9, 10].
Как у животных, так и у человека нейрональные структуры, обеспечивающие гомеостатический контроль энергообмена взаимодействуют с гораздо более объемными и более сложно организованными отделами мозга, вовлеченными в когнитивный и эмоциональный контроль аппетита. В целом данный комплекс не только регулирует внутренний обмен, но и обеспечивает адаптацию метаболических потребностей организма к условиям окружающей среды. Например, именно поэтому голодная мышь-полевка в течение длительного времени не покидает нору, вблизи которой охотится лиса. Вкусная пища как один из видов удовольствия является мощным орексигенным стимулом даже при отсутствии истинного дефицита энергии в организме. Чувство удовольствия обеспечивается рядом структур и медиаторных систем головного мозга, формирующих систему награды (reward system) [11, 12]. У человека церебральная система награды включает несколько отделов неокортекса (орбитофронтальная кора, островковая доля коры, поясная извилина), старую лимбическую кору (гиппокамп, миндалина), полосатое тело (прилежащие ядра, бледный шар), гипоталамус (латеральная и перифорникальная зоны), вентральную тегментальную область. Указанные структуры вовлечены в процессы получения удовольствия от физиологических стимулов, направленных на выживание вида (прием пищи и жидкости, половое поведение), а также являются нейрональным субстратом патологической склонности к азартным играм и наркотической зависимости. Как полагают исследователи, у большинства больных ожирение в первую очередь связано с употреблением чрезмерного количества вкусной, т.е. сладкой и/или богатой жирами пищи. В основе подобного поведенческого стереотипа лежит дисбаланс между гомеостатическими (направленными на поддержание постоянства внутренней среды) и гедонистическими (направленными на получение удовольствия, наслаждения) сигналами, регулирующими аппетит [13–15].
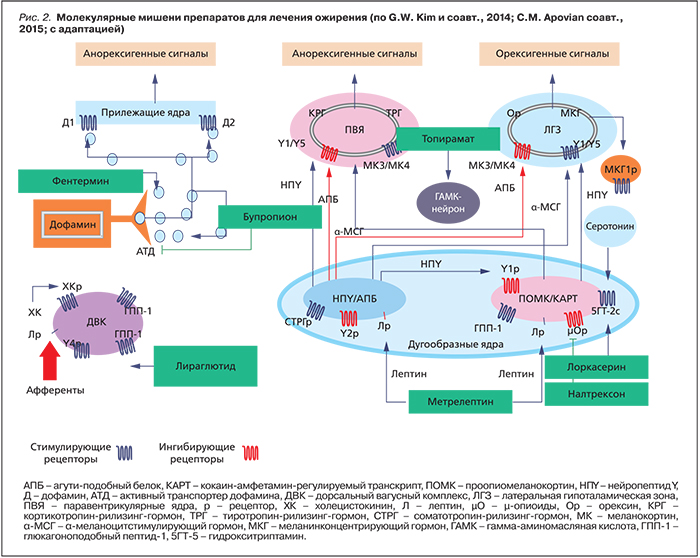
Лекарственные препараты центрального действия осуществляют анорексигенный эффект преимущественно на уровне дугообразных ядер гипоталамуса, повышая активность ПОМК-нейронов [7, 16] (рис. 2).
Необходимо отметить, что ни один из препаратов не вызывает необратимые, радикальные преобразования в системе регуляции массы тела, эффект прослеживается лишь непосредственно на фоне фармакотерапии.
ФАРМАКОТЕРАПИЯ ОЖИРЕНИЯ
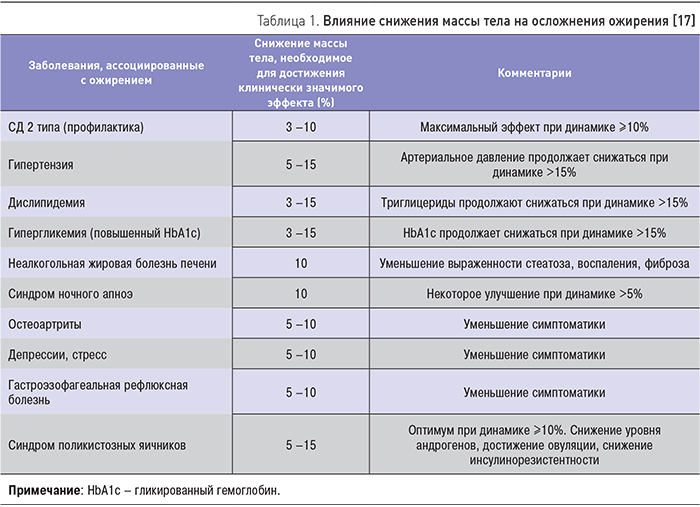
Снижение массы тела на 5–15% от исходных значений сопровождается клинически значимым улучшением метаболических показателей, снижением риска ассоциированных осложнений (табл. 1).
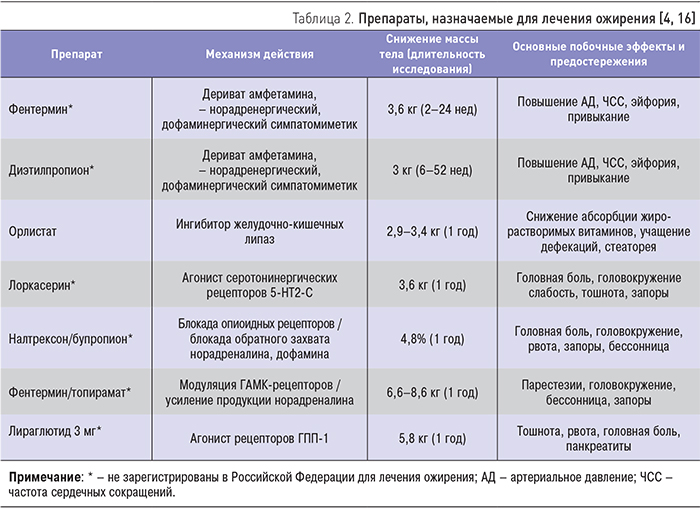
К сожалению, в клинической практике необходимость назначения фармакотерапии ожирения нередко игнорируется врачами. Как показало исследование, недавно проведенное в США, лишь 1 из 50 больных ожирением, обратившихся за медицинской помощью, назначают соответствующие медикаменты [18]. Согласно современным рекомендациям, медикаментозное лечение показано всем больным с ИМТ≥30 кг/м2, а также пациентам с ИМТ≥27 кг/м2 при наличии осложнений, связанных с ожирением (СД, артериальная гипертензия, дислипидемия и др.) [16]. За исключением орлистата, зарегистрированные к настоящему моменту лекарственные препараты способствуют достижению отрицательного энергетического баланса путем снижения аппетита, что повышает приверженность больных к диетотерапии (табл. 2).
Помимо мониторинга побочных эффектов препаратов, необходима оценка их эффективности в отношении снижения массы тела. Для большинства препаратов критерием является снижение массы тела не менее, чем на 5% за 3 мес применения, в противном случае лекарственное средство отменяется. Лираглютид 3 мг отменяется, если за 4 мес его применения динамика массы тела составила менее 4% от исходных значений [16].
В настоящее время в Российской Федерации для фармакотерапии ожирения применяются 3 препарата: орлистат, Диетресса и сибутрамин.
Орлистат. Механизм действия периферический, основан на подавлении активности желудочно-кишечных липаз, что приводит к уменьшению всасывания жира в кишечнике. В сочетании с гипокалорийной диетой орлистат вызывает клинически значимое снижение массы тела у пациентов с неосложненным ожирением, а также при сочетании ожирения с СД, гиперлипидемией, артериальной гипертензией. Препарат эффективнее, чем плацебо, предотвращает повторное увеличение массы тела. Орлистат принимается 3 раза в день по 60–120 мг во время еды или в течение часа после еды. Прием препарата можно пропустить, если пища не содержит жира. Наиболее распространенным побочным эффектом является частый жидкий масляный стул, что обусловлено основным механизмом действия препарата. Препарат можно назначать в течение 4 лет.
Диетресса. К настоящему времени эффективность и безопасность Диетрессы изучены не в полной мере. В целом механизм действия препарата базируется на снижении активности каннабиноидных рецепторов 1 типа (КБ1р). Эндоканнабиноидная система регулирует энергообмен на центральном и периферическом уровне. Блокада центральных КБ1р приводит к уменьшению аппетита (влияние на гипоталамические структуры), снижению мотивации к приему особо вкусной пищи (влияние на мезолимбическую систему). Периферические эффекты блокады КБ1р связаны с воздействием на жировую ткань, печень (подавление липогенеза), желудочно-кишечный тракт (восстановление нормальной секреции гормонов, участвующих в регуляции энергообмена), мышцы (повышение утилизации глюкозы). Диетресса назначается по 6 таблеток в день, по 1–2 таблетки на прием (держать во рту до полного растворения) за 15–30 мин до еды, продолжительность терапии – 3 мес. Препарат противопоказан при исходно депрессивных состояниях, не назначается в комбинации с психотропными препаратами. Антагонист каннабиноидных рецепторов 1 типа римонабант был изъят из клинической практики в 2008 г. в связи с повышенным риском развития депрессии. В настоящее время активно разрабатываются селективные антагонисты КБ1р, лишенные центральных эффектов, т.е. оказывающие влияние исключительно на уровне печени, мышц, желудочно-кишечного тракта, b-клеток поджелудочной железы [19].
Сибутрамин. Механизм действия преимущественно центральный, основан на подавлении обратного захвата серотонина, норадреналина и, в меньшей степени, дофамина в синапсах центральной нервной системы, что приводит к повышению чувства насыщения. Благодаря действию как на гомеостатический, так и на гедонистический контроль аппетита, сибутрамин способствует нормализации пищевого поведения [7]. За счет активации β2- и β3-адренорецепторов сибутрамин усиливает процессы термогенеза [20, 21]. В комбинации с диетотерапией клинически значимый эффект (снижение массы тела на 5–10%) на фоне применения препарата достигается существенно чаще, по сравнению с плацебо. Сибутрамин эффективен как при отсутствии осложнений, так и при наличии нарушений углеводного и жирового обмена. Стартовая доза составляет 10 мг в день (однократно), при отсутствии клинического эффекта доза увеличивается до 15 мг. Неблагоприятные эффекты включают умеренное увеличение АД и ЧСС. Сибутрамин противопоказан больным с неконтролируемой артериальной гипертензией, сердечной недостаточностью, аритмией, инсультом и инфарктом в анамнезе, глаукомой, а также в комбинации с психотропными препаратами. На фоне терапии необходим регулярный контроль АД и ЧСС. Длительность применения сибутрамина составляет 1 год.
В 2010 г. назначение сибутрамина было приостановлено во многих странах после исследования SCOUT, в котором был отмечен более высокий риск развития сердечно-сосудистых осложнений на фоне приема препарата по сравнению с плацебо [22]. Однако необходимо учитывать, что в данном исследовании ни один пациент не получал препарат согласно инструкции: критерием включения было наличие сердечно-сосудистой патологии, у трети больных возраст превышал 65 лет, длительность терапии в 5 раз превышала допустимую, лечение проводилось без учета эффективности в отношении динамики массы тела. В мае 2015 г. были опубликованы результаты ретроспективного британского исследования, в котором проведена оценка сердечно-сосудистых рисков при назначении сибутрамина в рутинной клинической практике. Выборка составила 23 927 пациентов, получавших сибутрамин. Авторы пришли к выводу, что при отсутствии исходной сердечно-сосудистой патологии риск осложнений на фоне приема препарата остается низким, соответственно, решение об отмене сибутрамина регуляторными органами было вынесено необоснованно [23]. Комбинированный препарат (сибутрамин+микрокристаллическая целлюлоза) обладает самой широкой собственной доказательной базой по эффективности и безопасности среди всех сибутраминсодержащих препаратов, зарегистрированных в РФ. Его эффективность и безопасность подтверждены в ходе наблюдательной программы «Весна» с участием свыше 34 тыс. больных ожирением, а также в программе «Примавера», предварительные результаты которой были представлены на XVII Европейском конгрессе эндокринологов [24, 25].
ЗАКЛЮЧЕНИЕ
Распространенность ожирения и ассоциированных с ним заболеваний предопределяет необходимость изучения механизмов регуляции энергетического баланса на молекулярном уровне с целью разработки эффективной патогенетической терапии. На сегодняшний день выбор препаратов достаточно ограничен. Тем не менее, благодаря уточнению функции центральных и периферических медиаторов регуляции аппетита, в настоящее время в ходе доклинических и клинических исследований проводится оценка эффективности и безопасности множества новых классов лекарственных средств – антагонистов/обратных агонистов КБ1р, антагонистов гистаминовых рецепторов, антагонистов рецепторов меланинконцентрирующего гормона, антагонистов грелина, антагонистов рецепторов нейропептида Y, агонистов адипонектина, агонистов лептина, агонистов оксинтомодулина и др. [26]. Внедрение в клиническую практику новых препаратов, а также их комбинаций, оказывающих комплементарное действие на ключевые звенья регуляции массы тела, будет способствовать выработке более эффективной стратегии ведения больных ожирением.



