Среди наиболее важных факторов, определяющих возникновение так называемой первичной (не связанной с другими соматическими или неврологическими заболеваниями) головной боли (ПГБ), традиционно упоминают о центральных механизмах нарушения ее восприятия, стрессе, психических расстройствах, мышечном напряжении, нарушении тонуса сосудов, воспалении и т.д. [1, 2]. При этом не совсем ясно, как эти факторы соотносятся между собой. Авторы настоящей статьи выдвигают гипотезу, позволяющую объединить различные патогенетические механизмы ПГБ между собой.
Представляется, что центральным звеном патогенеза ПГБ являются патологические изменения активности нейронов (нейрональной активности), принимающих участие в формировании «обычной» реакции на стресс [3]. А для него характерно угнетение ГАМК-ергической (ГАМК – γ-аминомасляной кислота) системы, которая обеспечивает эффективное торможение различных нейронов (таблица). При этом наблюдается быстрая и одновременная активизация остальных нервных клеток. Это препятствует какой-либо осмысленной деятельности, и жертва стресса «замирает». В дальнейшем, однако, такая активизация приносит определенную пользу. Так, стимулируется глутаматная система (↑ГЛУ), обеспечивающая возбудимость разных нервных клеток. В результате повышается тонус мышц, что позволяет лучше осуществлять разнообразные движения. Кроме того, возрастает активность вегетативной нервной системы, обеспечивающей иннервацию внутренних органов. Одновременно наблюдаются процессы, позволяющие быстрее распознать боль и принять меры к ее устранению. Так, облегчается проведение болевых импульсов. Создаются условия для реализации феномена взвинчивания, при котором происходит прогрессивное усиление болевых ощущений в ответ на повторные ритмические температурные или механические стимулы, чья интенсивность остается неизменной.
Стимуляция дофаминовой (↑ДА) и норадреналиновой (↑НА) систем обеспечивает лучшее осмысление ситуации, а также поднимает артериальное давление (АД). Одновременно растет частота сердечных сокращений (ЧСС) и дыхательных движений (ЧДД). Соответственно, увеличивается приток кислорода к различным органам, включая мышцы. Система гистаминовых нейронов (↑ГИ) поднимает уровень бодрствования. Она же способствуют перераспределению кровотока в тканях (спазм артерий и расширение артериол) и готовит организм к возможному повреждению, вызывая «защитное» воспаление.
Приспособительное значение описанных нейрональных механизмов вполне понятно. Столкнувшись с опасностью (стрессом), организм стремится «психически» и «соматически» подготовить себя к действию: «бегству» или «борьбе», которые могут быть сопряжены с травмами. В свою очередь «бегство» и «борьба» ассоциируются с низким (↓СЕ) или высоким (↑СЕ) уровнем активности серотониновой системы соответственно и необходимы для ограничения воздействия стресса. Причем при «бегстве» это происходит за счет удаления от источника опасности. В этой ситуации ГАМК-ергическая система получает время, необходимое для восстановления тормозящих функций. «Борьба» нивелирует влияние стресса иным путем. Это происходит за счет возросшей активности самих серотониновых нейронов. Последние, так же как и ГАМК-ергические, выполняют тормозящие функции в центральной нервной системе [4]. Соответственно, серотониновые нейроны могут подавлять излишнюю активность различных нервных клеток.
Интересно, что как «бегство», так и «борьба» сопровождается «соматическими» изменениями. В частности, снижение серотониновой активности (при «бегстве») ассоциируется с уменьшением количества серотонина, депонированного в тромбоцитах. В результате вязкость крови падает, а скорость кровотока в мелких сосудах увеличивается. Так, создаются условия для улучшения кровоснабжения, например, в мышцах. Напротив, повышение серотониновой активности (при «борьбе») может сопровождаться ростом содержания серотонина в тромбоцитах. При этом увеличивается склонность к тромбозам, создаются условия для спазма сосудов. Очевидно, однако, что все это может быть полезным в случае повреждения тканей и кровотечении. Наконец, серотонин осуществляет «перенастройку» тонуса сосудов, поскольку его действие зависит от их исходного состояния. При ангиоспазме этот нейромедиатор способствует расслаблению мышц. Напротив, при низком тонусе стенок сосудов серотонин обеспечивает их сокращение.
Те же самые, но только усиленные и выходящие за рамки приспособительных процессы наблюдаются и при различных психических расстройствах, которые обозначаются в международной классификации болезней 10-го пересмотра (МКБ-10) [5] с помощью большого числа диагнозов. Кроме того, на практике используются и другие термины, которые отсутствуют в МКБ-10. Как бы то ни было, все они проявляются симптомами, являющимися как бы «естественным» продолжением стресса. Так, свойственное последнему замирание (↓ГАМК) трансформируется в заторможенность (ступор), чувство «оцепенелости» и эмоциональной притупленности, «оглушенность».
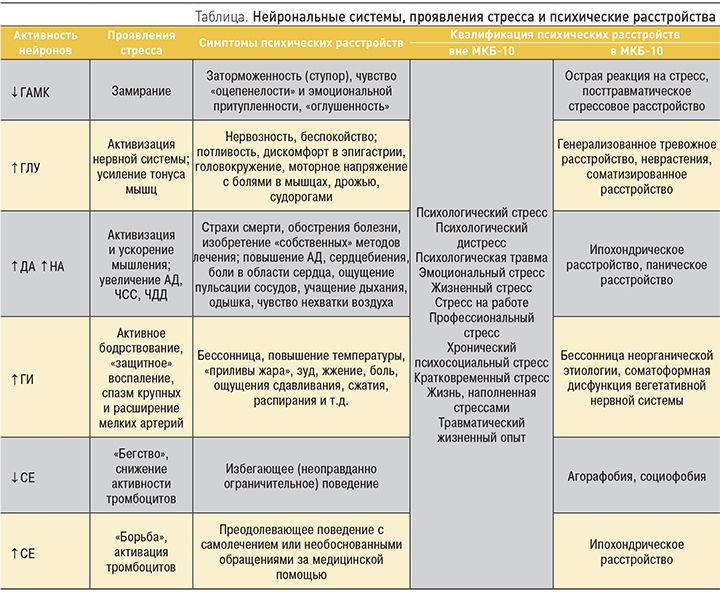
Аналогичным образом активизация вегетативной нервной системы, облегчение проведения импульсов от нейрона к нейрону, «взвинчивание», повышение тонуса мускулатуры (↑ГЛУ) реализуются в нервозности, беспокойстве; потливости, дискомфорте в эпигастрии, головокружении; напряжении с болями в мышцах (включая перикраниальные), дрожью, судорогами. Осмысление ситуации перерастает в страхи (смерти, обострения болезни) и в попытки изобрести «собственные» методы лечения (↑ДА). Подъем АД, рост ЧСС и ЧДД сопровождаются жалобами на сердцебиения, боли в голове и сердце, ощущение пульсации сосудов, учащение дыхания, одышку, чувство нехватки воздуха (↑ДА и ↑НА). Повышение уровня бодрствования сопровождается развитием бессонницы (↑ГИ). Перераспределение кровотока в тканях сопровождается жалобами на сдавливание, сжатие, распирание, «защитное» воспаление – не повышение температуры, «приливы жара», зуд, жжение, боль. Наконец, избегающее или преодолевающее поведение (↓СЕ и ↑СЕ) сопровождается снижением приверженности назначенной терапии (неоправданным ограничением нагрузок, отказом от лечения или самолечением, а также необоснованными обращениями за медицинской помощью). Кроме того, могут наблюдаться различные жалобы, связанные с изменениями тонуса сосудов.
Возвращаясь теперь к ПГБ, укажем, что она формируется с помощью тех же механизмов. В частности, повышение активности глутаматной системы наблюдается при всех трех наиболее распространенных разновидностях ПГБ (головных болях напряжения, мигрени и кластерных головных болях) [6–8]. В результате отмечается усиление болевых импульсов, развивается упомянутый выше феномен взвинчивания. Кроме того, свой вклад в формирование ПГБ вносит значительно повышенный тонус перикраниальных и шейных мышц.
В то же время довольно сложные изменения активности серотониновой системы характерны для мигрени. В частности, в начале приступа отмечается повышение уровня серотонина. Это сопровождается снижением кровотока в отдельных участках мозга, развитием очаговой неврологической симптоматики и ауры [9]. В дальнейшем происходит быстрое выведение серотонина и его метаболитов с мочой. В результате содержание этого нейромедиатора в центральной нервной системе падает. Это приводит к стойкой гипотонии церебральных сосудов, их избыточному растяжению, периваскулярному отеку, раздражению болевых рецепторов и развитию ПГБ [9]. Во многом аналогичные процессы, связанные с серотониновыми нейронами, свойственны и для кластерных головных болей. К тому же на фоне высокого содержания гистамина в стенке сосуда развивается воспаление, которое также способствует развитию боли [10]. Не случайно, что эти боли ранее называли гистаминовыми.
Таким образом, при «обычном» стрессе, различных психических расстройствах и ПГБ наблюдаются сходные по своему вектору изменения нейрональной активности, хотя и отличающиеся по интенсивности. Соответственно, легко представить, что у подверженных пациентов, отличающихся генетически детерминированной чрезмерно выраженной реакцией различных систем нейронов на «обычный» стресс, может возникнуть ПГБ, психическое расстройство или и то и другое сразу. Аналогичные нарушения еще быстрее возникают, если стресс будет не «обычным», а «сильным».
Существенная роль, по крайней мере, трех нейрональных систем (↑ГЛУ, ↑↓СЕ, ↑ГИ) при формировании ПГБ заставляет задать вопрос о том, какая из них вносит наибольший вклад в патогенез рассматриваемого страдания. Иными словами, что важнее для формирования ПГБ: усиление боли (включая феномен взвинчивания), повышение мышечного тонуса (↑ГЛУ) или изменения тонуса сосудов (↑↓СЕ), а также воспаление (↑ГИ)? Очевидно, что помимо теоретического значения, этот вопрос имеет и вполне практический смысл. Действительно, при лечении ГБ применяются самые разные препараты. Однако наиболее предпочтительными могут быть лишь те из них, которые позволяют воздействовать на основное звено патогенеза.
Представляется вероятным, что наибольший вклад в формирование ПГБ вносит повышение активности глутаматной системы. И дело тут не только в том, что такое изменение функций нервных клеток наблюдается при всех основных клинических вариантах ПГБ (головных болях напряжения, мигрени и кластерных головных болях). Данное предположение позволяет наилучшим образом объяснить целый ряд исключительно важных клинических особенностей ПГБ. В частности, у больных ПГБ отмечается достаточно много весьма мелких структурных изменений головного мозга. Однако все они напоминают «ослабленные» проявления инфарктов мозга, а также деменции [11].
Очевидно, что данная особенность ПГБ, которую зачастую относят к «функциональной» и не столь уж серьезной патологии, может показаться неожиданной. Между тем с повышением активности глутаматной системы сопряжен так называемый феномен эксайтотоксичности [12]. Этот неспецифический патогенетический механизм реализуется при самых разных заболеваниях головного мозга (инфарктах мозга, сосудистой деменции, болезни Альгеймера и т.д.) [13]. Он характеризуется быстрым проникновением внутрь различных нервных клеток через глутаматные NMDA-рецепторы (NMDA – N-метил-D-аспартат) ионов Ca2+. Последние достаточно токсичны и могут приводить к гибели нейронов (апоптозу). Эти данные вполне объясняют, почему при ПГБ отмечаются упомянутые выше изменения головного мозга. Кроме того, с тем же феноменом эксайтотоксичности могут быть связаны и достаточно выраженные нарушения внимания и работоспособности, которые наблюдаются у пациентов с ПГБ [14].
Известно также, что ПГБ часто возникает при избыточном употреблении некоторых лекарственных средств, в частности бензодиазепинов. Такая патогенетическая особенность ПГБ тоже может объясняться повышенной активностью глутаматной системы. Дело в том, что чрезмерное торможение нейронов мозга, вызванное бензодиазепинами, приводит к своеобразной «отдаче» [15]. Последняя ведет к росту активности глутаматных нервных клеток, а те, в свою очередь, способствуют развитию ПГБ.
Ведущая роль глутаматной системы при формировании ПГБ позволяет объяснить ее взаимосвязь с нарушением половой функции. Это явление наблюдается у 29% женщин, страдающих ПГБ, и чаще всего (в 20% случаев) ассоциируется со снижением либидо [16]. Между тем половое влечение регулируется, в первую очередь, двумя веществами – пролактином и дофамином (рисунок). Первое из них снижает либидо, второе, напротив, повышает. Уровень дофамина в головном мозге также зависит от активности глутаматной системы. При росте такой активности количество дофамина снижается. В результате у больных ПГБ часто отсутствует влечение, и половая жизнь затрудняется.
Наконец, ведущая роль активации глутаматной системы при формировании ГБ позволяет объяснить ее взаимосвязь с депрессиями. Выше уже упомянуто о том, что высокая активность глутаматных нейронов способствует снижению уровня дофамина в головном мозге. Между тем это сопровождается ослаблением положительных эмоций, что, в свою очередь, является одним из клинических признаков депрессии [4].
Таким образом, представленные данные прямо указывают на то, что ПГБ вполне можно назвать глутаматной головной болью. Соответственно, ведущую роль в лечении ПГБ должны играть препараты, снижающие активность глутаматных нейронов. Пожалуй, единственным таким препаратом в России является флупиртин. Он имеет в числе показаний головные боли, а его механизм действия направлен на снижение активности глутаматных нейронов [17]. Для этого флупиртин активирует нейрональные калиевые каналы. Выход ионов К+ вызывает стабилизацию потенциала покоя и снижение возбудимости мембран глутаматных нейронов. В результате достигается непрямое ингибирование NMDA-рецепторов, которые являются основными «передатчиками» возбуждения в глутаматной системе. Эти свойства позволяют флупиртину снижать у больных хронической ПГБ эффективность распространения болевых импульсов и препятствовать развитию феномена взвинчивания (обезболивающее действие) [18, 19]. Кроме того, препарат снижает тонус излишне напряженных мышц, включая перикраниальные и шейные (миорелаксирующий эффект) [19]. Важным свойством флупиртина является его терапевтическое воздействие на феномен эксайтотоксичности (нейропротективный эффект) [21]. Вот почему флупиртин продемонстрировал эффективность при лечении различных вариантов ПГБ [22, 23].
Представленные соображения делают флупиртин препаратом выбора при лечении хронической ПГБ. В свою очередь, это обстоятельство заставляет обратить внимание на ценовую доступность лекарственного средства Нолодатак (АО «Акрихин», Россия), который выпускается в капсулах по 100 мг. Препарат биоэквивалентен оригинальному флупиртину, в производстве Нолодатака использована субстанция компании «Ролабо Аутсорсинг С.Л.» (Испания).
Применяют Нолодатак по 100 мг (1 капсула), не разжевывая и запивая небольшим количеством жидкости (100 мл) 3–4 раза в день с равными интервалами между приемами. При выраженных болях – по 2 капсулы 3 раза в день. Максимальная суточная доза не должна превышать 600 мг (что соответствует 6 капсулам). Продолжительность лечения не должна превышать 2 нед. Побочные эффекты в виде ощущения общей слабости, сонливости или трудностей засыпания, преходящей тошноты наблюдаются относительно редко. Точное следование инструкции по применению препарата, верная оценка клинической картины заболевания, в том числе наличие сопутствующих соматических заболеваний, способны обеспечить безопасность лечебного процесса.
Завершая статью, следует указать на необходимость дальнейшего изучения роли нейрональных механизмов не только при формировании ПГБ, но и при болях иной локализации. Представляется, что такой подход может быть чрезвычайно продуктивен как в теоретическом, так и в практическом смысле.



