Сахарный диабет (СД) – одно из наиболее распространенных хронических заболеваний, характеризующееся комплексным нарушением обмена веществ, которое влечет за собой тяжелые макро- и микрососудистые осложнения. По данным Международной федерации диабета IDF [1], на сегодняшний день число больных во всем мире составляет около 415 млн человек, т.е. практически каждый одиннадцатый взрослый человек страдает СД.
Наиболее распространенной формой является СД 2 типа. В России, по данным Государственного регистра больных СД, на 1 января 2015 г. было зарегистрировано 3,7 млн человек, страдающих СД 2 типа [2]. В терапевтической практике частота встречаемости СД 2 типа, разумеется, гораздо выше, что обусловлено природой заболевания и поздней диагностикой. Представить себе реальное число случаев СД, с которыми приходится сталкиваться среднестатистическому врачу-терапевту, можно, экстраполировав данные российского исследования NATION [3] на «целевую» возрастную категорию. Так, если предположить, что возраст подавляющего большинства пациентов, которые приходят на прием к терапевту, колеблется от 55 до 70 лет, то, согласно данным, полученным в NATION, доля больных СД 2 типа среди больных этой возрастной группы будет составлять от 9,55 до 13,63% [3]. Таким образом, почти каждый седьмой пациент врача-терапевта в возрасте от 55 до 70 лет может страдать СД 2 типа, а следовательно, терапевты наряду с эндокринологами должны иметь четкое представление о методах управления СД 2 типа, профиле эффективности и безопасности различных сахароснижающих препаратов.
На сегодняшний день в клинической практике используются сахароснижающие лекарственные средства 9 фармакологических групп – от бигуанидов, представителем которых является применяемый на протяжении более полувека метформин, до препаратов инновационной группы ингибиторов натрийзависимого котранспортера 2 типа, вышедших на рынок всего несколько лет назад. Несмотря на последние достижения в области фармакологии, ознаменовавшиеся созданием целого ряда принципиально новых сахароснижающих препаратов, средства, принадлежащие к известным, проверенным группам, продолжают широко применяться в клинической практике. Одной из наиболее популярных групп сахароснижающих препаратов во всем мире вот уже много лет остаются производные сульфонилмочевины (ПСМ). Тот факт, что ПСМ, применяющееся более 60 лет, смогли сохранить свои позиции в современных руководствах по ведению больных СД 2 типа, во многом объясняется их высокой сахароснижающей активностью и хорошей переносимостью, снижением микрососудистых осложнений в сочетании с приемлемым профилем безопасности.
 Российские алгоритмы специализированной медицинской помощи больным СД [4], обновленные в 2015 г. экспертами Российской ассоциации эндокринологов [2], а также международные рекомендации американской и европейской ассоциаций по СД (ADA, EASD) [4] указывают, что ПСМ могут назначаться для лечения пациентов, не компенсированных на монотерапии метформином или альтернативными препаратами. Как в российских, так и в международных руководствах по ведению пациентов с СД ПСМ рекомендуются в качестве препаратов выбора для второй линии терапии больных, не компенсированных на монотерапии метформином, и на всех последующих этапах интенсификации лечения. Консенсусные алгоритмы ADA и EASD выделяют 5 наиболее значимых критериев для выбора конкретного сахароснижающего препарата, на основании которых предлагается делать индивидуальный выбор в пользу того или иного лекарственного средства. Согласно этим критериям, эксперты отмечают, что ПСМ характеризуются высокой эффективностью, доказанным влиянием на профилактику микрососудистых осложнений, умеренным риском побочных событий, среди которых ключевым фигурирует риск гипогликемических событий, негативным влиянием на массу тела и высокой доступностью в связи с низкой стоимостью. Однако на сегодняшний день нет ни одного класса сахароснижающих препаратов, который можно было бы рекомендовать всем больным СД 2 типа без ограничений, поскольку как традиционные, так и инновационные средства имеют ряд противопоказаний и потенциальных побочных явлений, которые необходимо учитывать.
Российские алгоритмы специализированной медицинской помощи больным СД [4], обновленные в 2015 г. экспертами Российской ассоциации эндокринологов [2], а также международные рекомендации американской и европейской ассоциаций по СД (ADA, EASD) [4] указывают, что ПСМ могут назначаться для лечения пациентов, не компенсированных на монотерапии метформином или альтернативными препаратами. Как в российских, так и в международных руководствах по ведению пациентов с СД ПСМ рекомендуются в качестве препаратов выбора для второй линии терапии больных, не компенсированных на монотерапии метформином, и на всех последующих этапах интенсификации лечения. Консенсусные алгоритмы ADA и EASD выделяют 5 наиболее значимых критериев для выбора конкретного сахароснижающего препарата, на основании которых предлагается делать индивидуальный выбор в пользу того или иного лекарственного средства. Согласно этим критериям, эксперты отмечают, что ПСМ характеризуются высокой эффективностью, доказанным влиянием на профилактику микрососудистых осложнений, умеренным риском побочных событий, среди которых ключевым фигурирует риск гипогликемических событий, негативным влиянием на массу тела и высокой доступностью в связи с низкой стоимостью. Однако на сегодняшний день нет ни одного класса сахароснижающих препаратов, который можно было бы рекомендовать всем больным СД 2 типа без ограничений, поскольку как традиционные, так и инновационные средства имеют ряд противопоказаний и потенциальных побочных явлений, которые необходимо учитывать.
Следует подчеркнуть, что ПСМ смогли сохранить серьезную позицию на этапах комбинированной терапии, в первую очередь, благодаря высокой эффективности в сочетании с метформином. Во всех алгоритмах управления СД 2 типа комбинация ПСМ с метформином относится к числу наиболее распространенных и рациональных схем лечения СД 2 типа, где каждый компонент влияет на фундаментальные патогенетические механизмы СД. Метформин относится к так называемым инсулин-сенситайзерам, т.е. препаратам, угнетающим глюконеогенез в печени и повышающим утилизацию глюкозы периферическими тканями, а ПСМ принадлежат к инсулин-секретагогам – средствам, стимулирующим β-клетки поджелудочной железы, что сопровождается мобилизацией и усилением выброса инсулина.
Наряду с классической схемой метформин–ПСМ для двойной комбинированной терапии СД 2 типа рекомендуют использовать и другие комбинации сахароснижающих препаратов. Так, российские алгоритмы [4] относят к числу рациональных комбинацию ПСМ, ингибиторов дипептидилпептидазы 4 типа и инсулина. Кроме того, подтверждена эффективность и безопасность сочетания ПСМ с агонистами глюкагоноподобного пептида-1 и ингибиторами натрий-глюкозного котранспортера 2 типа [5]. Таким образом, ПСМ можно комбинировать практически с любыми современными сахароснижающими препаратами, за исключением глинидов, что значительно облегчает задачу врача в условиях клинической практики.
Говоря о ПСМ, стоит отметить, что это объемная группа препаратов, в которую входят три поколения сахароснижающих средств, и каждое следующее поколение выгодно отличается от предыдущего. Препараты первого поколения (хлорпропамид, толбутамид) уже ушли в прошлое, уступив позиции более современным лекарственным средствам. Принесшие широкую известность ПСМ представители второго поколения, к числу которых относится глибенкламид, сочетают высокую сахароснижающую активность с достаточно высоким риском гипогликемических событий, а гликлазид имеет высокую безопасность, но и умеренную эффективность, что значительно затрудняет их применение. Единственный препарат последнего, третьего поколения глимепирид, вошедший в клиническую практику в 1995 г., выделяется из класса ПСМ особыми фармакокинетическими свойствами, двойным механизмом действия, благоприятным профилем безопасности, а именно низким риском гипогликемий и отсутствием увеличения массы тела, что было показано в ряде клинических исследований [6–9]. В обновленных стандартах Российской ассоциации эндокринологов [2] по ведению СД 2 типа рекомендуется останавливать выбор лишь на двух лекарственных препаратах из группы ПСМ: представителе второго поколения гликлазиде модифицированного высвобождения или препарате третьего поколения глимепириде, подчеркивая важность оценки риска гипогликемий, ассоциированного с применением того или иного препарата.
 Однако основными критериям эффективности терапии остаются ожидаемая сахароснижающая активность препаратов с учетом возраста больного и длительности заболевания, долгосрочность сохранения достигнутого результата, соотнесенные с влиянием на вес, коморбидную патологию и профилактику сосудистых осложнений. Не менее значимыми факторами являются схемы лечения, влияющие на удобство применения и определяющие степень приверженности пациентов лечению, и прогноз заболевания в целом.
Однако основными критериям эффективности терапии остаются ожидаемая сахароснижающая активность препаратов с учетом возраста больного и длительности заболевания, долгосрочность сохранения достигнутого результата, соотнесенные с влиянием на вес, коморбидную патологию и профилактику сосудистых осложнений. Не менее значимыми факторами являются схемы лечения, влияющие на удобство применения и определяющие степень приверженности пациентов лечению, и прогноз заболевания в целом.
С этих позиций глимепирид обладает рядом качеств, которые и обеспечивают его преимущества перед другими представителями группы ПСМ. Важным фармакокинетическим свойством глимепирида является его абсолютная, т.е. 100% биодоступность при пероральном приеме, причем практически не зависящая от приема пищи. Кроме того, препарат имеет достаточно большой период полувыведения – около 5–8 ч, что позволяет достигать терапевтической дозировки путем однократного приема в сутки.
Как известно, эффекты ПСМ основаны на их взаимодействии с рецепторами, расположенными на β-клетках поджелудочной железы – так называемыми SUR (англ. sulfonylurea receptor), которые взаимодействуют с АТФ-зависимыми К+-каналами (КАТФ-каналами) [10] c последующей активацией секреции инсулина. Существует несколько субъединиц SUR. В то время как подавляющее большинство ПСМ связывается с высокомолекулярным SUR1 (140 кДа), глимепирид вступает во взаимодействие с низкомолекулярной субъединицей SURX (65 кДа) [11]. Именно этим фактом объясняются особенности его фармакокинетики, отличающие его от препаратов предшествующих поколений ПСМ [12]. Так, глимепирид в 2,5–3 раза быстрее соединяется с рецептором и в 8–9 раз быстрее диссоциирует из образующегося комплекса глимепирида с белком [12]. К тому же глимепирид отличается низкой аффинностью к SUR (в 2–3 раза меньшей, чем глибенкламид), что также способствует более быстрой связи и дальнейшей диссоциации препарата с белком.
Эти свойства обеспечивают быстрое начало действия глимепирида и менее выраженное повышение плазменной концентрации инсулина в сравнении с глибенкламидом при достижении практически одинакового снижения уровня глюкозы в крови, что создает условие для снижения риска развития гипогликемических событий [13]. Примечательно, что при помощи глимепирида восстанавливается и первая, и вторая фаза секреции инсулина, благодаря чему его эффект становится наиболее приближен к физиологическому ответу β-клеток на прием пищи у людей, не страдающих СД [14]. За счет стимуляции обеих фаз секреции инсулина глимепирид эффективно корректирует и тощаковую, и постпрандиальную гликемию, а также снижает уровень гликированного гемоглобина (HbA1c) в крови. К тому же препарат способен поддерживать физиологическую секрецию инсулина и при физических нагрузках [15]. Несмотря на меньшее время взаимодействия с рецептором и меньшую стимуляцию, глимепирид оказывает адекватную стимуляцию секреции инсулина, достаточную для эффективного контроля гликемии. Меньшая частота гипогликемий, которая связана с применением глимепирида в клинической практике, может объясняться его более продолжительным действием и, как следствие, более ровным и стабильным воздействием на динамику уровня глюкозы в крови, что было показано в исследовании Müller [16].
 Помимо прямой стимуляции секреции инсулина, глимепирид имеет второй сахароснижающий механизм действия, который обеспечивается экстрапанкреатической активностью препарата, влиянием на инсулинорезистентность (ИР). Известно, что поступление глюкозы в адипоциты и мышечные клетки осуществляется с помощью специальных белков-транспортеров ГЛЮТ-1 и ГЛЮТ-4. В условиях ИР число белков-транспортеров в плазматической мембране клеток резко снижается, вследствие чего поступление глюкозы в клетки значительно сокращается. Экстрапанкреатическое сахароснижающее действие глимепирида заключается в увеличении количества транспортеров глюкозы ГЛЮТ-1 и ГЛЮТ-4 в инсулинорезистентных клетках мышечной и жировой ткани, что приводит к увеличению поглощения глюкозы периферическими тканями [13] Кроме того, глимепирид блокирует выброс глюкозы печенью путем повышения содержания фермента (фруктозо-2,6-бисфосфата), ингибирующего глюконеогенез [13].
Помимо прямой стимуляции секреции инсулина, глимепирид имеет второй сахароснижающий механизм действия, который обеспечивается экстрапанкреатической активностью препарата, влиянием на инсулинорезистентность (ИР). Известно, что поступление глюкозы в адипоциты и мышечные клетки осуществляется с помощью специальных белков-транспортеров ГЛЮТ-1 и ГЛЮТ-4. В условиях ИР число белков-транспортеров в плазматической мембране клеток резко снижается, вследствие чего поступление глюкозы в клетки значительно сокращается. Экстрапанкреатическое сахароснижающее действие глимепирида заключается в увеличении количества транспортеров глюкозы ГЛЮТ-1 и ГЛЮТ-4 в инсулинорезистентных клетках мышечной и жировой ткани, что приводит к увеличению поглощения глюкозы периферическими тканями [13] Кроме того, глимепирид блокирует выброс глюкозы печенью путем повышения содержания фермента (фруктозо-2,6-бисфосфата), ингибирующего глюконеогенез [13].
На фоне выраженной сахароснижающей активности глимепирид проявляет и внепанкреатические эффекты, которые также могут иметь важное клиническое значение за пределами углеводного обмена. Существенным преимуществом препарата перед большинством других представителей группы ПСМ является отсутствие влияния на нормальные компенсационные процессы адаптации миокарда к ишемии. Известно, что КАТФ-каналы находятся не только в клетках поджелудочной железы, но и в кардиомиоцитах. Традиционные ПСМ ингибируют их наряду с каналами β-клеток. В физиологических условиях большинство КАТФ-каналов кардиомиоцитов закрыты, однако при ишемических процессах они должны открываться для компенсации внутриклеточного pH. Благодаря этому механизму короткие периоды ишемии вызывают повышенную устойчивость миокарда к более выраженной ишемии, что получило название феномена ишемического прекондиционирования. Данный механизм направлен на профилактику развития инфаркта миокарда при возникновении повторных эпизодов ишемии. Кроме того, ишемическое прекондиционирование позволяет ограничить зону повреждения. В отличие от большинства ПСМ, глимепирид отличается низким сродством к КАТФ-каналам гладкомышечных клеток сосудов и кардиомиоцитов. Klepzig в своей работе (1999) указывает, что использование глимепирида оказывает в 3–4 раза меньший эффект на КАТФ-каналы сердечной мышцы [17] и потому не способствует нарушению адаптации миокарда к ишемии. При этом кардиопротективные свойства глимепирида дополняются также его способностью снижать количество экстрасистол и частоту желудочковой тахикардии во время ишемии миокарда [18].
К числу экстрапанкреатических эффектов глимепирида относится и его антиатерогенное действие [13]. Препарат способствует снижению содержания уровня общего холестерина, триглицеридов и липопротеидов низкой плотности (ЛПНП) в крови (рис. 1) [19]. Важно отметить, что для большинства пациентов с СД 2 типа характерно комплексное нарушение липидного обмена в виде повышенного содержания триглицеридов и ЛПНП и пониженного уровня липопротеидов высокой плотности [20]. При этом широко известно, что ЛПНП у пациентов с СД 2 типа отличаются достаточно мощной атерогенностью, т.к. при СД их консистенция становится более плотной, а размер уменьшается [20].
Наряду с антиатерогенным эффектом глимепирид проявляет и антиагрегантные свойства. Известно, что фибринолитическая активность при СД снижается. Это происходит за счет повышения уровня ингибитора активатора плазминогена I (PAL-I), что приводит к снижению активности тканевого активатора плазминогена (t-PA). Последний превращает профермент плазминоген в разрушающий нити фибрина плазмин. Вследствие этих нарушений фибринолиз замедляется и, соответственно, повышается склонность к тромбообразованию [21] Тромбоз же (в виде различных клинических проявлений), в свою очередь, входит в число основных причин смерти от осложнений СД [21]. Глимепирид способствует повышению активности t-PA и снижению активности PAL-I, восстанавливая баланс между ними и нормализуя активность фибринолитической системы. Таким образом, препарат имеет механизмы, препятствующие тромбообразованию и развитию сердечно-сосудистых осложнений СД [19] Кроме того, предположительно, глимепирид также селективно ингибирует циклооксигеназу – фермент, участвующий в синтезе тромбоксана А, одного из наиболее мощных эндогенных активаторов тромбообразования [13, 22]. Помимо этого, глимепирид препятствует тромбообразованию путем ингибирования метаболизма арахидоновой кислоты [22].
Имеются данные, что глимепирид способствует снижению содержания малонового диальдегида в крови, таким образом, значительно снижая перекисное окисление липидов и уменьшая окислительный стресс, который является одним из патогенетических механизмов реализации воспаления и повреждения сосудистой стенки, особенно выраженных у пациентов с СД 2 типа [12]. Механизм реализации снижения окислительного стресса, по всей вероятности, связан с повышением уровня эндогенного α-токоферола, а также увеличением активности антиоксидантных ферментов каталазы, глютатионпероксидазы и супероксиддисмутазы [12].
 Существуют данные, свидетельствующие о благоприятном влиянии глимепирида на функцию эндотелия, что может быть объяснено редукцией окислительного стресса, характерного для СД. Известно, что повреждение сосудистого эндотелия является одним из центральных патогенетических факторов, способствующих поражению сосудов при ишемической болезни сердца и СД 2 типа. Дисфункция эндотелия развивается вследствие влияния ряда неблагоприятных факторов, в том числе ИР, гиперинсулинемии, гипергликемии, дислипидемии, вызывающих повреждение и апоптоз эндотелиальных клеток [23]. В результате нарушается выработка клетками эндотелия оксида азота, вследствие чего снижается вазодилатирующая и антиагрегационная функция сосудистого эндотелия, что в свою очередь способствует развитию атеросклероза. Согласно данным одного из исследований, глимепирид способствует увеличению синтеза оксида азота эндотелием сосудов [24]. Эти свидетельства позволяют сделать вывод о вероятной способности глимепирида оказывать протективное действие и на сосудистый эндотелий [24].
Существуют данные, свидетельствующие о благоприятном влиянии глимепирида на функцию эндотелия, что может быть объяснено редукцией окислительного стресса, характерного для СД. Известно, что повреждение сосудистого эндотелия является одним из центральных патогенетических факторов, способствующих поражению сосудов при ишемической болезни сердца и СД 2 типа. Дисфункция эндотелия развивается вследствие влияния ряда неблагоприятных факторов, в том числе ИР, гиперинсулинемии, гипергликемии, дислипидемии, вызывающих повреждение и апоптоз эндотелиальных клеток [23]. В результате нарушается выработка клетками эндотелия оксида азота, вследствие чего снижается вазодилатирующая и антиагрегационная функция сосудистого эндотелия, что в свою очередь способствует развитию атеросклероза. Согласно данным одного из исследований, глимепирид способствует увеличению синтеза оксида азота эндотелием сосудов [24]. Эти свидетельства позволяют сделать вывод о вероятной способности глимепирида оказывать протективное действие и на сосудистый эндотелий [24].
Сочетание выраженного сахароснижающего эффекта глимепирида посредством прямой стимуляции выработки инсулина β-клетками поджелудочной железы наряду с целым спектром внепанкреатических свойств (повышение активности инсулина и чувствительности к нему периферических тканей, ингибирование глюконеогенеза в печени, антиатерогенный и антиагрегантный эффекты, кардиопротективное действие, способность снижать выраженность окислительного стресса) обеспечивает важные преимущества препарата третьего поколения ПСМ перед большинством других представителей группы. Эти свойства позволяют применять глимепирид в качестве мощного средства для нормализации углеводного обмена с выраженным кардиопротективным эффектом у больных СД 2 типа, входящих в группу риска развития сердечно-сосудистых заболеваний. Следует отметить, что эффективность сахароснижающего эффекта, а также внепанкретические свойства и переносимость глимепирида были тщательно изучены в целом ряде исследований.
Целесообразно также упомянуть данные о сахароснижающих свойствах глимепирида, которые были установлены за многие годы клинической практики и в результате рандомизированных клинических исследований. Впервые высокая эффективность монотерапии глимепиридом у пациентов с СД 2 типа была продемонстрирована в плацебо-контролируемом рандомизированном исследовании 1998 г. [25] общей длительностью 22 нед (10 нед – период титрации и 12 нед – период получения оптимальной дозы). Результаты показали, что в группе глимепирида уровень HbA1c снизился на 2,4%, в то время как в группе плацебо – на 1,0%. Эффективность проведенной терапии оценивалась в том числе по количеству пациентов, достигших HbA1c ≤7,2%, которого к концу исследования достигли 79% участников, получавших глимепирид, и только 32% больных из группы плацебо. В последующем эти данные многократно подтверждались и систематизировались ежегодными мета-анализами. Эффективность глимепирида при инициации сахароснижающей терапии была подтверждена в российском многоцентровом открытом проспективном наблюдательном исследовании Амарил-МОНО с участием 245 пациентов, не достигших целевых показателей гликемического контроля после изменения образа жизни в течение 12 нед после диагностики СД 2 типа [26]. Через 24 нед терапии глимепиридом 71,7% участников достигли целевого показателя HbA1c <7%, при этом среднее значение HbA1c составило 6,6±0,7% (p<0,001). Гликемия натощак к концу исследования снизилась на 2,3±1,3 ммоль/л, а показатель постпрандиальной гликемии – на 3,1±1,9 ммоль/л (p<0,001). На фоне столь выраженного сахароснижающего эффекта глимепирид продемонстрировал и высокий профиль безопасности: частота симптоматической гипогликемии составила 10,2%, ночной – 1,6%. Тяжелых гипогликемий зарегистрировано не было. Кроме того, индекс массы тела (ИМТ) за 24 нед исследования изменился незначительно – на +0,4 кг/ м2. В схожей клинической ситуации китайские исследователи показали [27], что за 16 нед стартовой терапии глимепиридом уровень глюкозы натощак снизился с 9,94 до 7,94 ммоль/л. Целевого уровня HbA1c <7% к концу терапии достигли 61% больных (в исследовании участвовал 391 пациент). В еще одном двойном слепом плацебо-контролируемом исследовании с участием 416 пациентов, получавших глимепирид или плацебо на протяжении 14 нед [28], уровень HbA1c в группе глимепирида снизился с 7,9–8,1 до 7,4–7,6%, в то время как в группе плацебо HbA1с повысился с 7,7 до 9,7%. Та же тенденция была продемонстрирована и в отношении уровня глюкозы натощак и постпрандиальной глюкозы. При этом профиль безопасности глимепирида оказался достаточно высоким.
Интересные результаты были получены в крупном обсервационном когортном исследовании (22 045 пациентов), изучавшем эффективность и переносимость глимепирида [29]. Около 29,3% участников исследования получали глимепирид в качестве стартовой терапии СД 2 типа, в то время как 70,7% уже принимали ПСМ ранее (из них 69,6% перешли с метформина на монотерапию глимепиридом, а 30,4% принимали комбинацию метформина и глимепирида). Наибольшего снижения HbA1c удалось достичь в группе пациентов, впервые принимавших ПСМ (-1,8% по сравнению с -1,3% у пациентов, перешедших к терапии глимепиридом из-за отсутствия достижения целей на фоне применения метформина). Частота гипогликемий была невысокой: в среднем этот показатель составил всего 0,3%. Примечательно, что во всех группах терапии было зафиксировано снижение массы тела по сравнению с начальными показателями (-1,4 кг), причем максимального снижения достигли пациенты, страдающие ожирением (-2,2 кг).
Влияние глимепирида на массу тела было изучено и в других исследованиях. Мета-анализ, оценивающий результаты четырех двойных слепых рандомизированных исследований [7], включивший данные 1444 пациентов, получающих глимепирид, показал отсутствие статистически значимого изменения массы тела на фоне лечения. Крупное наблюдательное исследование с участием 1770 пациентов, которые принимали глимепирид на протяжении 1,5 года [30], показало на фоне выраженного влияния на углеводный обмен (снижение HbA1c с 8,4 до 7,1% через 4 мес терапии и до 6,9% в конце исследования) благоприятное влияние препарата на массу тела. Средний вес участников за время исследования демонстрировал устойчивое снижение (с 79,8 кг в начале терапии до 76,9 кг через 1,5 года лечения, p<0,005). В сравнении с препаратом второго поколения глибенкламидом в мультицентровом ретроспективном исследовании Martin [31] с участием 520 пациентов, получавших глибенкламид или глимепирид на протяжении 12 мес, было выявлено, что глимепирид, обеспечивая идентичный с глибенкламидом гликемический контроль, ассоциируется со значительно более выраженным снижением массы тела. Так, в группе глимепирида за время терапии было зафиксировано снижение веса на -2,04±3,99 кг, а глибенкламида – -0,58±3,65 кг по сравнению с начальными показателями (p<0,001). ИМТ изменился в группах глимепирида и глибенкламида на -0,71±1,38 кг/м2 и -0,2±1,28 кг/м2 соответственно (p<0,001).
Работы, изучающие сравнительную эффективность и безопасность глибенкламида и глимепирида, подтвердили значительно меньшую частоту гипогликемий на фоне лечения глимепиридом при эквивалентном снижении уровня глюкозы крови. Так, в исследовании D.G. Dills [10] в группе пациентов, получающих глимепирид, гипогликемические события в течение первого месяца терапии были зарегистрированы в 1,7% случаев, а у больных, получавших глибенкламид, – в 5% случаев. Тенденция к гораздо меньшей встречаемости гипогликемий в группе глимепирида сохранялась на протяжении всего периода эксперимента (12 мес), хотя она и не достигла статистических различий. В масштабной работе Holstein, изучающей случаи тяжелой гипогликемии в Германии на протяжении 4 лет [9], говорится о снижении вероятности развития гипогликемий у пациентов, получающих глимепирид, почти в 8 раз по сравнению с больными на терапии глибенкламидом. Тяжелые, угрожающие жизни гипогликемии на фоне терапии глимепиридом не были зафиксированы ни у одного из 4,5 тыс. пациентов, данные которых были проанализированы Rosskamp [32].
Хорошая переносимость и высокая эффективность была доказана и в отношении одной из наиболее широко применяемых и изученных комбинаций ПСМ – метформина и глимепирида. Высокая эффективность данной комбинации была впервые показана в проспективном мультицентровом рандомизированном двойном слепом исследовании Charpentier, опубликованном в 2001 г. [33]. На фоне терапии комбинацией глимепирида и метформина у пациентов с начальным HbA1c ≥7% показатели углеводного обмена снижались намного более эффективно, чем при монотерапии метформином или глимепиридом. Так, через 20 нед после начала исследования в группе пациентов, продолживших получать только метформин, уровень HbA1c изменился на +0,07±1,20%, в группе глимепирида – на +0,27±1,10%, а группе комбинированного лечения – на -0,74±0,96% (p<0,001). Показатели постпрандиальной глюкозы и глюкозы натощак также продемонстрировали снижение у пациентов, получавших комбинацию двух препаратов, и повышение в обеих группах, получавших метформин и глимепирид в составе монотерапии.
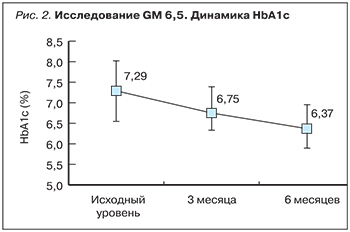
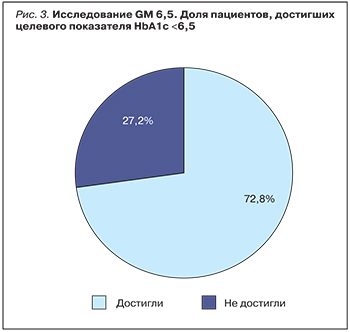
Возможность безопасного достижения достаточно жестких целевых показателей терапии СД 2 типа посредством комбинированной терапии глимепиридом и метформином была подтверждена и в российском наблюдательном проспективном исследовании, получившем название GM 6,5. В данное исследование включались пациенты, у которых показатель HbA1c на момент включения в программу составлял >6,5 и ≤7,5%, и в соответствии с Российскими рекомендациями по терапии СД 2 типа этим пациентам требовалась интенсификация терапии. В группу исследования вошли 600 пациентов, использовавших в качестве лечения монотерапию метформином на протяжении как минимум 12 мес. В ходе исследования все пациенты продолжали получать метформин, при этом по решению лечащего врача в схему лечения вводился глимепирид. Первичной целью данного регистра была оценка динамики HbA1c на фоне продолжения приема метформина и интенсификации терапии при помощи глимепирида (рис. 2). Результаты исследования показали, что средний уровень HbA1c, который через 3 мес терапии снизился с 7,29±0,68 до 6,75±0,5%, к концу терапии составил 6,37±0,49%. В абсолютных показателях уровень HbA1c через 3 и 6 мес после начала исследования снизился на 0,54±0,55 и 0,92±0,67%, а доля пациентов, достигших уровня HbA1c ≤6,5% через 6 мес терапии, составила 72,8% (рис. 3). Также было зафиксировано снижение других показателей углеводного обмена (глюкозы плазмы натощак и постпрандиальной гликемии). На фоне высокой эффективности терапии после добавления глимепирида была показана хорошая переносимость этой комбинации, а также отсутствие негативного влияния на вес. При исходной массе тела 90,4±13,1 кг к 6-му мес терапии показатели достигли 88,2±12,6 кг (общее снижение -2,1±2, кг). Средний ИМТ уменьшился с 32,5±4 до 31,7±3,9 кг/м2. При этом все различия были статистически значимыми.
Интересной находкой данного исследования являлось снижение частоты возникновения гипогликемий. Если в первой половине исследования (с момента включения до 3 мес наблюдения) частота гипогликемий в среднем составила 0,533±1,42 эпизода на 1 пациента за 3 мес, то во второй половине наблюдения (с 3-го по 6-й мес) уже 0,316±0,84 эпизодов на 1 пациента за 3 мес (p<0,0001). Серьезных нежелательных явлений за время наблюдения в исследовании зарегистрировано не было. Таким образом, результаты этого российского наблюдательного исследования показали, что в условиях реальной практики добавление глимепирида к монотерапии метформином пациентам, у которых требуется достижение целевого показателя HbA1c <6,5%, способствует значительному улучшению показателей углеводного обмена наряду с низкой частотой встречаемости гипогликемий и хорошей переносимостью.
Эффективность комбинации метформина и глимепирида была продемонстрирована и в категориях пациентов с более высокими начальными показателями углеводного обмена. Так, в исследовании Pareek [34] пациенты, не достигшие контроля гликемии на фоне монотерапии метформином или глимепиридом, с исходным HbA1c ≥7% и ≤10%, при переходе на комбинированную терапию метформином и глимепиридом в течение 12 нед значительно улучшили показатели гликемического контроля. Уровень HbA1c за время исследования снизился с 8,35±0,93 до 7,65±1,7% (p<0,001). Снижения HbA1c на ≥0,5% или уровня HbA1c <7% смогли достичь 65,79% пациентов, не компенсированных на фоне монотерапии. В этом исследовании было также зарегистрировано и улучшение липидного профиля участников.
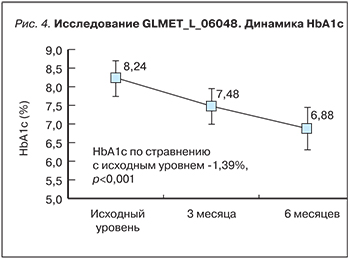
Хорошо известно, что политерапия может сопровождаться меньшей приверженностью пациентов лечению. Переход на фиксированные комбинации значительно увеличивает приверженность больных терапии [35]. С этой точки зрения особый интерес вызывает оценка эффективности и безопасности фиксированной комбинации глимепирида и метформина (Амарил М). В рамках этой задачи было проведено российское наблюдательное исследование, изучавшее применение препарата Амарил М в условиях реальной клинической практики у пациентов с СД 2 типа. В исследование вошли 1,2 тыс. пациентов, которые получали монотерапию метформином и/или глимепиридом в течение не менее 12 нед и имели неудовлетворительный уровень гликемического контроля (HbA1c 7,6–9%), в связи с чем решение лечащего врача было связано с необходимостью интенсификации существующей терапии путем назначения фиксированной комбинации глимепирида 2 мг и метформина 500 мг (Амарил М). Длительность наблюдения пациентов в данном регистре составила 24 нед. Результаты показали значительное снижение HbA1c через 3 и 6 мес терапии: от исходного уровня 8,24±0,42% HbA1c снизился до 7,48±0,46% через 3 мес терапии и до 6,88±0,56% – через 6 мес лечения препаратом Амарил М (рис. 4).
Показатели глюкозы плазмы натощак и постпрандиальной гликемии также свидетельствовали об улучшении показателей углеводного обмена. Доля пациентов, достигших уровня HbA1c ≤6,5%, составила через 3 мес 5%, а через 6 мес после начала исследования – 26,9%. Уровня HbA1c ≤7% смогли достичь 22,7 и 65,1% участников соответственно (p<0,001). При этом доля пациентов, которые перенесли эпизоды бессимптомной гликемии, составила 7,06%, симптоматической – 5,29% и ночной симптоматической – 0,92%. Тяжелых гипогликемий за время терапии зарегистрировано не было. Таким образом, результаты исследования в очередной раз подтвердили высокую эффективность и безопасность фиксированной комбинации глимепирида и метформина.
ВЫВОД
ПСМ долгие годы остается одним из наиболее часто использующихся классов сахароснижающих препаратов. Российские и международные руководства по лечению СД 2 типа уделяют ПСМ большое значение, рекомендуя их применение в качестве препаратов второй линии при недостижении компенсации на фоне монотерапии метформином. Выраженные сахароснижающие свойства ПСМ и хорошая переносимость как в монотерапии, так и в комбинации с метформином позволяют этому классу сохранять актуальность, несмотря на появление в практике новых классов сахароснижающих препаратов. Тем не менее стоит признать, что в значительной мере применение некоторых ПСМ ограничивается побочными эффектами, в частности высоким риском гипогликемий и прибавки массы тела, а также возможным негативным влиянием на сердечно-сосудистую безопасность. Представитель третьего поколения ПСМ глимепирид совмещает характерную для всех препаратов группы высокую сахароснижающую активность с более благоприятным профилем безопасности, а именно низким риском гипогликемических событий и отсутствием негативного влияния на массу тела. Помимо прямого влияния на углеводный обмен, глимепирид проявляет антиатерогенный, кардиопротективный, фибринолитический и целый ряд других экстрапанкреатических эффектов, имеющих важное значение в терапии СД 2 типа и сопутствующих метаболических нарушений. Благодаря уникальному двойному механизму сахароснижающего эффекта, а также комплексу экстрапанкреатических свойств глимепирид позволяет эффективно контролировать СД, в том числе и у категорий пациентов, имеющих сопутствующую сердечно-сосудистую патологию или факторы риска сердечно-сосудистых заболеваний.
В сочетании с метформином глимепирид представляет одну из самых эффективных и при этом хорошо переносимых комбинаций, позволяющую получить адекватный контроль гликемии у пациентов, не достигших целевых значений гликемии при применении этих препаратов в монотерапии. Доступность в клинической практике препарата с фиксированными дозами глимепирида и метформина (Амарил М) позволяет значительно повысить комплаентность пациентов и, таким образом, еще более эффективно контролировать гликемию у больных, нуждающихся в интенсификации сахароснижающей терапии.
Вышеуказанные факты обосновывают целесообразность дальнейшего использования глимепирида в широкой клинической практике. Обширная доказательная база, подтверждающая эффективность и благоприятный профиль безопасности глимепирида как в монотерапии, так и в комбинации с метформином, дает основания считать глимепирид одним из препаратов выбора для лечения СД 2 типа у пациентов, не достигших компенсации гликемии на фоне монотерапии.


