Препараты на основе гидролизатов плаценты человека (ГПЧ) используются в современной клинической медицине, начиная с первой четверти XX в. Во многом клиническое использование ГПЧ стало возможным благодаря результатам, полученным известнейшим российским офтальмологом и хирургом В.П. Филатовым (1875–1956) [1]. С 1940-х гг. ГПЧ все более активно начинают исследовать и в других странах (Германия, Япония, Индия, Франция) [2]. К настоящему времени опубликовано более 4,5 тыс. статей, посвященных ГПЧ. Результаты проведенных исследований указали на широкий спектр возможных клинических применений ГПЧ: иммуномодуляция, заживление ран, нейротрофические эффекты, нормализация пигментации кожи, гепатопротекция и др.
Одним из перспективных направлений использования препаратов на основе ГПЧ представляется лечение ревматоидного артрита (РА) – хронического воспалительного заболевания, приводящего к прогрессирующей деструкции хрящевой ткани суставов и эрозии костной ткани. У пациентов с РА, особенно у женщин и больных с депрессией, все большее распространение получают методы комплементарной и альтернативной медицины, включающие в частности инъекции ГПЧ [3].
 Экспериментальные [4, 5] и клинические [6, 7] исследования, проведенные в 1950–1960-х гг., показали эффективность использования плацентарных препаратов при лечении артритов [8]. На моделях остеоартроза у кроликов, вызванного монойодацетатом, применение ГПЧ ингибировало деградацию протеогликана в суставном хряще, подавляло активность матричных коллагеназ 2 и 9, избыточная активность которых приводит к ускоренной деградации коллагеновых волокон соединительной ткани. Показано, что применение ГПЧ оказывало протекторный эффект на хрящевую ткань коленных суставов [9].
Экспериментальные [4, 5] и клинические [6, 7] исследования, проведенные в 1950–1960-х гг., показали эффективность использования плацентарных препаратов при лечении артритов [8]. На моделях остеоартроза у кроликов, вызванного монойодацетатом, применение ГПЧ ингибировало деградацию протеогликана в суставном хряще, подавляло активность матричных коллагеназ 2 и 9, избыточная активность которых приводит к ускоренной деградации коллагеновых волокон соединительной ткани. Показано, что применение ГПЧ оказывало протекторный эффект на хрящевую ткань коленных суставов [9].
Далее последовательно рассмотрены молекулярно-физиологические механизмы действия ГПЧ на регенерацию соединительной ткани, результаты экспериментальных исследований ГПЧ на моделях артрита (в т.ч. потенцирование препаратом Лаеннек регенеративных процессов хряща при адъювантном артрите) и перспективы клинического применения препаратов на основе ГПЧ для терапии артрита и других патологий костно-мышечной и костно-связочной систем.
МОЛЕКУЛЯРНО-ФИЗИОЛОГИЧЕСКИЕ МЕХАНИЗМЫ ДЕЙСТВИЯ ГПЧ НА РЕГЕНЕРАЦИЮ СОЕДИНИТЕЛЬНОЙ ТКАНИ
Использование ГПЧ для ускорения процессов регенерации тканей основано на противовоспалительном, трофическом и антитромботическом эффектах ГПЧ. В эксперименте на модели резаной раны (выполнена биопсия эпителия длиной 8 мм) ГПЧ применялись топически и внутривенно (2,5 мл/кг). При обоих путях введения использование ГПЧ соответствовало значительному сокращению размера раны (р<0,05), индекса тяжести состояния раны (р<0,05), уменьшению среднего количества дней, необходимых для полного заживления (р<0,01), значительному приросту эластичности рубца и прочности на растяжение (р<0,01), заметному увеличению общего тканевого содержания ДНК и белков (в частности, коллагена) [10].
Важным компонентом регенеративного действия ГПЧ является противовоспалительный эффект. В эксперименте введение препарата стандартизированного ГПЧ Лаеннек внутривенно достоверно снижало уровни фактора некроза опухоли альфа (ФНО-α) и фермента синтеза простагландинов циклооксигеназы-2 (ЦОГ-2) при избыточно повышенных уровнях/активности этих белков. На моделях артрита отмечено снижение воспаления и повышение болевого порога [11].
Следует отметить, что ГПЧ также характеризуются выраженным противоболевым эффектом. В эксперименте ГПЧ значительно ингибировал выработку ФНО-α и ЦОГ-2, синтезирующей провоспалительные простагландины. В модели хронического артрита применение ГПЧ ослабляет отек, снижает образование гранулемы, увеличивает болевой порог в тесте Рэндалл–Селитто и продлевает время реакции крыс при нагреве поверхности кожи инфракрасными лучами [11].
Регенеративный, противовоспалительный и противоболевой эффекты ГПЧ обусловлены компонентами пептидного состава. К настоящему времени было предложено несколько различных молекулярных и физиологических механизмов, объясняющих ранозаживляющий эффект ГПЧ: увеличение уровней ростовых факторов фибробластов (ФРФ) [12], быстрая миграция нейтрофилов к ране [13], синтез NO, важнейшего клеточного медиатора в заживлении ран [14]. В частности, в составе препарата Лаеннек был найден противовоспалительный дипептид JBP485 (цикло-транс-4-гидроксипролилсерин), который снижает уровни секреции и ФНО-α и проявляет антиапоптотический эффект (снижение уровней и активности каспазы-3 – фермента-активатора апоптоза клеток [15]).
 В работе других исследователей [16] представлены результаты комплексного анализа пептидного состава препарата Лаеннек. В «легкой фракции» препарата (до 3000 Да) были найдены активный пептид нейромедина N и фрагмент активного пептида кокальцигенина. Было показано, что в состав Лаеннека входят пептидные ФРФ, фактора роста гепатоцитов (ФРГ, англ. HGF), инсулиноподобного фактора роста (ИФР, англ. IGF), эпидермальный фактор роста (ЭФР, англ. EGF), фактор роста нервов (ФРН, англ. NGF) и др. Эти ростовые факторы значительно ускоряют процессы регенерации поврежденных тканей и в то же время не оказывают существенного воздействия на здоровые ткани.
В работе других исследователей [16] представлены результаты комплексного анализа пептидного состава препарата Лаеннек. В «легкой фракции» препарата (до 3000 Да) были найдены активный пептид нейромедина N и фрагмент активного пептида кокальцигенина. Было показано, что в состав Лаеннека входят пептидные ФРФ, фактора роста гепатоцитов (ФРГ, англ. HGF), инсулиноподобного фактора роста (ИФР, англ. IGF), эпидермальный фактор роста (ЭФР, англ. EGF), фактор роста нервов (ФРН, англ. NGF) и др. Эти ростовые факторы значительно ускоряют процессы регенерации поврежденных тканей и в то же время не оказывают существенного воздействия на здоровые ткани.
Для регенерации соединительной ткани наиболее важна активность ФРФ, которые индуцируют клеточное деление фибробластов, хондроцитов, остеоцитов и других видов клеток соединительной ткани. Белки ФРФ связываются рецепторами ФРФ (FGFR) 4 различных типов. Связываясь с одноименными рецепторами, ФРФ активируют несколько путей передачи сигнала, в т.ч. с участием таких широко известных сигнальных белков, как Mg-зависимые MAPK (митоген-активируемые протеинкиназы), ERK (внеклеточно регулируемые киназы), фосфатидилинозитол-3-киназы (PI3K), фосфолипаза-C-гамма, JNK (Jun N-терминальная киназа) и PKC (протеинкиназа-С). Активация рецепторов вызывает фосфорилирование определенного тирозинового остатка белка FRS2, который затем взаимодействует с сигнальными белками Grb2, SOS, GAB1 и др. Эти начальные события способствуют устойчивой активации сигнального белка Ras, который в свою очередь активирует МЕК-МАРК путь, ведущий к изменениям в транскрипции генов, отвечающих, в частности, за структуру соединительной ткани (рис. 1).
В составе препарата Лаеннек достоверно установлено присутствие пептида с аминокислотной последовательностью KIPYI [16], соответствующей биологически активному пептиду нейромедина N, для которого характерен анальгетический эффект [17]. Низкоафинные рецепторы типа NTS2 играют важную роль в осуществлении антиноцицептивных свойств нейромедина. В экспериментальном исследовании [18] было показано, что связывание NTS2-рецепторами активного пептида нейромедина приводит к интернализации рецептора внутри клетки с последующей активацией внутриклеточного сигнального каскада внеклеточно регулируемых киназ 1/2 (ERK1/2), который, как известно, вовлечен в выживание клеток (нейронов, гепатоцитов, клеток эндотелия и др.). Интернализация рецептора (т.е. перемещение рецептора внутрь клетки) и активация сигнальных путей ERK1/2 является одним из молекулярно-клеточных механизмов осуществления аналгезии.
Заметим, что помимо анальгетического действия пептида нейромедина, противоболевое действие ГПЧ также осуществляется путем ингибирования передачи сигналов по сигнальному каскаду МАРК внутри клеток микроглии. Хорошо известно, что активация воспалительных реакций микроглии тесно взаимосвязана с нейропатической болью [19]. Клетки микроглии в культуре были предварительно обработаны 50 мкМ ГПЧ в течение 2 ч до обработки клеток провоспалительными липополисахаридами (ЛПС, 2 мкг/мл). ГПЧ снижал индуцированную ЛПС гибель клеток на 24% и тормозил вызванную ЛПС проапоптотического белка JNK-киназы на 23% [20]. Экспрессия ЦОГ-2 была увеличена после обработки клеток ЛПС, в то время как ГПЧ снижал экспрессию ЦОГ-2 в клетках, что способствовало снижению интенсивности воспаления, поддерживаемого микроглиальными клетками.

В Лаеннеке найден фрагмент активного пептида кокальцигенина с аминокислотной последовательностью QKRAC, соответствующий фрагменту 79–83 активного пептида кокальцигенина [16]. Кокальцигенин, известный также как «относящийся к гену кальцитонина пептид» (calcitonin gene-related peptide, CGRP), способствует более полноценному и быстрому заживлению ран и переломов. Клинические и экспериментальные исследования показывают, что более высокая скорость зарастания перелома ассоциирована с более высокими уровнями пептида CGRP в сыворотке [21], снижает уровни провоспалительного белка ФНО-α [22].
ЭКСПЕРИМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ ГПЧ ПРИ АРТРИТЕ
Стандартизированный ГПЧ (препарат Лаеннек) проявляет противовоспалительное и обезболивающее действие в моделях артрита и отека. В частности, ГПЧ достоверно ингибирует выработку ФНО-α и ЦОГ-2 в макрофагах, стимулированных провоспалительными ЛПС. Внутрибрюшинные инъекции ГПЧ в дозах 0,33, 1, 3 и 6 мл/кг дозозависимо уменьшали образование гранулемы в каррагинановой модели отека и моделировании хронического артрита задней лапы адъювантом Фрейнда. ГПЧ также увеличил порог болевой чувствительности в тесте Рэндалла–Селитто, латентность в тесте «горячая пластина» и время реакции в тесте «отдергивание хвоста» [23].
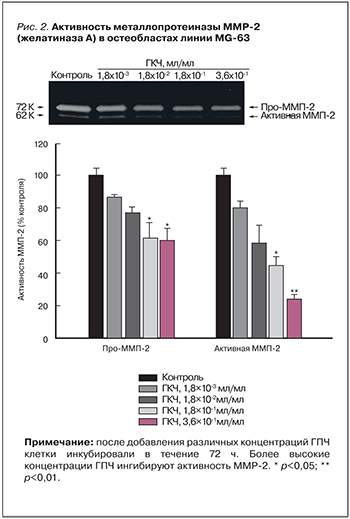
ГПЧ оказывает защитное действие на деградацию хряща в модели остеоартрита (внутрисуставное введение 3 мг монойодацетата). Начиная с 14 сут после создания модели, ГПЧ вводили внутрь сустава 1 раз в день в течение 14 сут. Посредством рентгенографии, гистологии и оценки активности фермента деградации хряща ММР-2 (желатиназы) показано, что ГПЧ тормозил деградацию протеогликана суставного хряща, значительно снижал деформации суставов и подавлял гистологические изменения, характерные для остеоартрита. В частности, активность металлопротеиназы ММР-2 дозозависимо снижалась [24] (рис. 2).
 На 28-е сут после создания модели было проведено рентгенографическое обследование. Такие неблагоприятные морфологические изменения, как острые углы хряща и кости сустава, лизис и смещение суставов были достоверно меньше после курса лечения с использованием ГПЧ (рис. 3).
На 28-е сут после создания модели было проведено рентгенографическое обследование. Такие неблагоприятные морфологические изменения, как острые углы хряща и кости сустава, лизис и смещение суставов были достоверно меньше после курса лечения с использованием ГПЧ (рис. 3).
РА характеризуется хроническим воспалением синовиальной оболочки сустава, что приводит к проградиентному разрушению суставного хряща, связок и костей. Такие цитокины, как ФНО-α, интерлейкин-1-бета (ИЛ-1β) и интерлейкин-6 (ИЛ-6) вовлечены в механизмы деградации синовиальной ткани, суставов и апоптоза клеток хряща при РА. В частности, цитокин ИЛ-1β участвует в разрушении хряща сустава при хроническом артрите, а не в начале опухания суставов; экспрессия ИЛ-1β постепенно увеличивается с возрастом. Цитокин ФНО-α, наоборот, участвует в разрушении хряща сустава на ранних стадиях артритического опухания суставов [25].
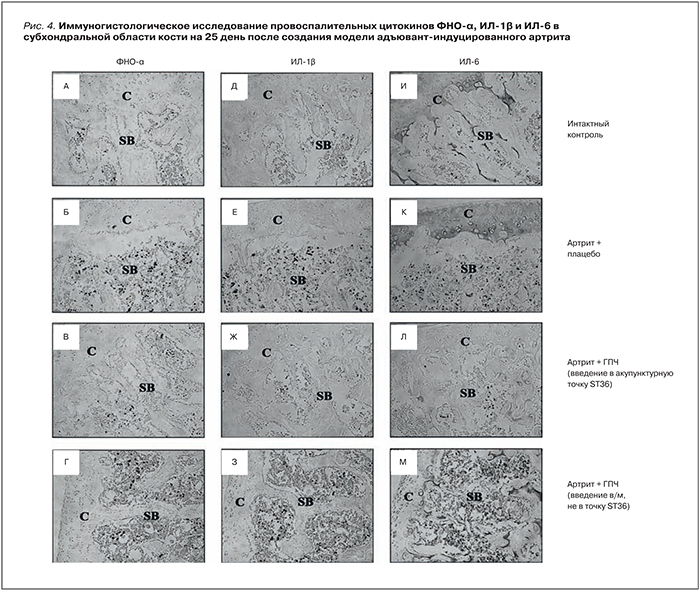
Применение ГПЧ оказывает терапевтическое воздействие на воспалительные реакции в субхондральной области кости на модели артрита у крыс. Модель РА создавалась посредством подкожного введения высушенных клеток микобактерий туберкулеза, эмульгированных в сквалене. После формирования модели полиартрита (11 сут после инъекции) ГПЧ ежедневно вводили в акупунктурную точку ST36 («Дзу-сан-ли», т.е. точка, расположенная в переднебоковой проекции, снаружи от коленного сустава задней лапы) в течение 2 нед. После лечения отмечена нормализация массы тела объема лап, которые были восстановлены почти до уровней интактного контроля. Уровни цитокинов ФНО-α, ИЛ-1β и ИЛ-6 в клетках субхондральной области кости сустава значительно снижались после обработки ГПЧ по сравнению с плацебо [25].
 На 25-е сут (середина хронической стадии адъювантного артрита у крыс) количество клеток, иммунопозитивных на ФНО-α, ИЛ-1β и ИЛ-6, значительно возрастало в клетках, расположенных между утолщениями трабекулярной части субхондральной кости по сравнению с интактным контролем (рис. 4). Лечение посредством ГПЧ резко снижало уровни экспрессии этих провоспалительных цитокинов, что совпадало по времени с улучшением массы тела, объема лапы и индекса состояния суставов [25].
На 25-е сут (середина хронической стадии адъювантного артрита у крыс) количество клеток, иммунопозитивных на ФНО-α, ИЛ-1β и ИЛ-6, значительно возрастало в клетках, расположенных между утолщениями трабекулярной части субхондральной кости по сравнению с интактным контролем (рис. 4). Лечение посредством ГПЧ резко снижало уровни экспрессии этих провоспалительных цитокинов, что совпадало по времени с улучшением массы тела, объема лапы и индекса состояния суставов [25].
ПОТЕНЦИРОВАНИЕ РЕГЕНЕРАТИВНЫХ ПРОЦЕССОВ ХРЯЩА И ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ АДЪЮВАНТНОГО АРТРИТА ПРЕПАРАТОМ ЛАЕННЕК
Приведенные выше результаты фундаментальных и клинических исследований препаратов на основе ГПЧ показывают перспективность использования препарата Лаеннек для реконструктивной терапии хряща и суставов. В настоящем разделе представлены результаты исследованиях эффектов препарата Лаеннек на модели экспериментального артрита у кроликов.
Т.н. адъювантный артрит, вызываемый введением адъюванта Фройнда, широко используется для изучения специфической противовоспалительной и противоревматоидной активности препаратов. Адъювантный артрит во многом схож с РА: для него также характерны развитие отека околосуставных тканей, деградация хряща, потеря функциональной активности сустава, лимфоцитарная инфильтрация внутрисуставной полости и др. [26, 27].
Терапевтическая эффективность Лаеннека оценивалась на модели адъювантного артрита у кроликов. Эксперимент проводился на 12 однополых беспородных кроликах массой тела 4,0–4,5 кг. Животные содержались в индивидуальных клетках при естественном освещении, температуре воздуха около 20–220С и свободном доступе к пище и воде.
Для индукции артрита в плантарную поверхность задней лапы вводили полный адъювант Фройнда (CFA, complete Freund adjuvant, пр-во Sigma-Aldrich) в объеме 250 мкл. На протяжении всего эксперимента (4 нед) ежедневно, с перерывом на выходные, проводили клинический осмотр животных с оценкой тяжести развития патологии в баллах. При отсутствии изменений инъецированной лапы присваивалась оценка «0», при наличии слабовыраженного отека – «1», при наличии отека и слабовыраженного покраснения – «2», при наличии значительного отека и сильно выраженного покраснения – «3», при наличии сильно выраженного отека и покраснения, затрагивающих все суставы инъецированной лапы, и/или при генерализации процесса (вовлечение суставов контрлатеральной лапы, суставов в основании хвоста, передних лап) – «4» [28].
На 7-й день после создания модели животные были рандомизированы на две экспериментальные группы по 6 животных так, чтобы степень тяжести развития заболевания минимально различалась между группами. Далее одна из групп начиная с 7-го дня эксперимента получала инъекции препарата Лаеннек (в/м по 0,2 мл на 1 кг массы тела), а другая – инъекции плацебо (физраствор) в течение 4 нед по 3 раза в нед. По окончании эксперимента суставы были подвергнуты гистологическому исследованию. Для этого образцы фиксировали в 10% растворе нейтрального формалина, декальцинировали и заливали в парафин. Критериями гистологической оценки служили изменения околосуставного аппарата, наличие воспалительного инфильтрата, состояние суставного хряща и костной ткани [29]. Состояние хряща по каждому из этих критериев оценивали в баллах так, что при максимальной выраженности патологического процесса балльная оценка для одного животного составляет 30 баллов по шкале проф. В.Г. Макарова (2015) [30].
 В результате проведения эксперимента установлена положительная клиническая и гистологическая динамика, ассоциированная с использованием препарата Лаеннек. Начиная с 23-х сут эксперимента после создания модели, балл клинической оценки тяжести был достоверно ниже в группе, в которой проводилась терапия Лаеннеком (табл. 1).
В результате проведения эксперимента установлена положительная клиническая и гистологическая динамика, ассоциированная с использованием препарата Лаеннек. Начиная с 23-х сут эксперимента после создания модели, балл клинической оценки тяжести был достоверно ниже в группе, в которой проводилась терапия Лаеннеком (табл. 1).
Гистологический анализ показал, что создание модели приводило к усиленной пролиферации синовиоцитов, гиперплазии соединителной ткани, отечности. Оценка гистологического качества ткани сустава по компонентам 30-балльной шкалы показала достоверно более высокое качество соединительной ткани хряща в случае терапии препаратом Лаеннек по всем изученным гистологическим показателям (табл. 2).
Таким образом, гистологическое исследование показало, что у животных, получавших Лаеннек, достоверно снижалось общее воспаление соединительной ткани, устранялось сужение суставной полости, предотвращались патологические изменения костной ткани и синовиальной оболочки, устранялась дегенерация хряща.
О КЛИНИЧЕСКИХ ИССЛЕДОВАНИЯХ ПРЕПАРАТОВ НА ОСНОВЕ ГПЧ ПРИ АРТРИТЕ
Наиболее интенсивно клинические исследования эффектов ГПЧ проводились в 1950-х гг. Были получены обнадеживающие клинические результаты лечения РА и артроза как посредством внутрисуставных [31], так и чрескожных инъекций ГПЧ [32, 33]. Например, в опубликованном в 1954 г. исследовании было показано, что имеются свидетельства улучшения состояния пациентов со II степенью РА после подкожной имплантации ткани плаценты человека. При этом улучшение сохранялось на протяжении по меньшей мере 6 мес после окончания терапии [34].
Современные клинические исследования эффективности стандартизированных ГПЧ только начинают проводиться. Имеющиеся результаты клинических исследований показывают, что при практическом лечении болевого синдрома при заболеваниях костно-мышечной системы терапия с использованием ГПЧ может быть проведена с использованием различных зон внутримышечного введения препарата.
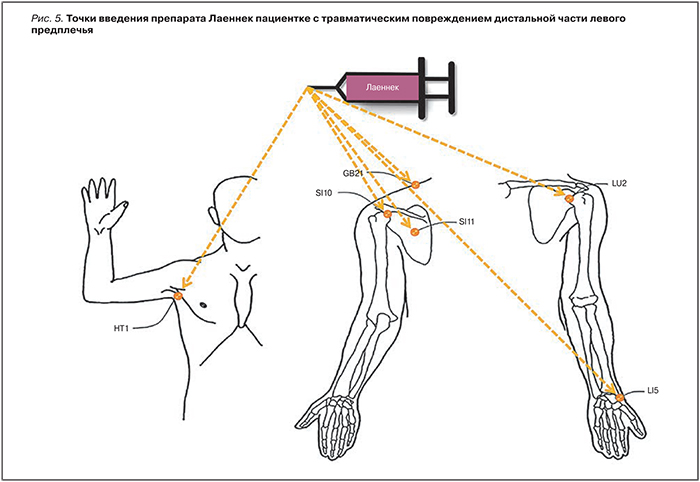
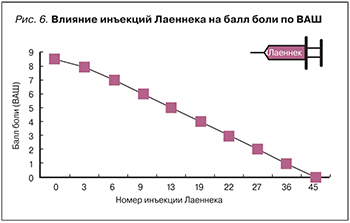
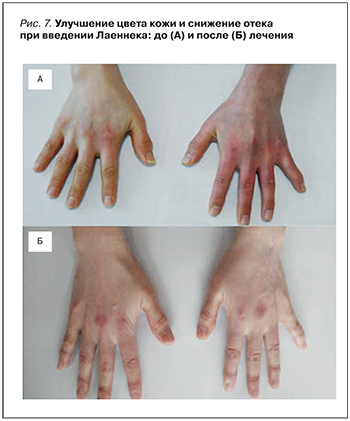 Например, в клиническом случае у пациентки А., 42 года, развился комплексный региональный болевой синдром в левой верхней конечности после травматического повреждения дистальной части левого предплечья. Боль была немедленной, устойчивой к пероральным анальгетикам и электромиостимуляции. Даже через 5 мес после травмы у пациентки отмечались сильная боль, отек, покраснение, ощущение холода в левой руке и потеря функции левой руки. Лаеннек вводился в акупунктурные точки LI5, LU2, SI10, HT1, GB21 и SI11 (рис. 5), которые локализованы в суставах или в мышцах, ответственных за движение левой верхней конечности. Инъекции Лаеннека привели к выраженному снижению интенсивности боли, опухания, к нормализации температуры, к исчезновению покраснения и к восстановлению двигательных функций [35]. Балл боли по визуальной аналоговой шкале (ВАШ) уменьшался по мере проведения терапии (рис. 6). Уже после 6-й процедуры отмечено снижение балла по ВАШ до 7, уменьшение ощущений скованности, холода и отека левого сустава запястья [35]. К 22-й процедуре балл ВАШ снизился до 3, покраснение кожи было практически полностью устранено (рис. 7).
Например, в клиническом случае у пациентки А., 42 года, развился комплексный региональный болевой синдром в левой верхней конечности после травматического повреждения дистальной части левого предплечья. Боль была немедленной, устойчивой к пероральным анальгетикам и электромиостимуляции. Даже через 5 мес после травмы у пациентки отмечались сильная боль, отек, покраснение, ощущение холода в левой руке и потеря функции левой руки. Лаеннек вводился в акупунктурные точки LI5, LU2, SI10, HT1, GB21 и SI11 (рис. 5), которые локализованы в суставах или в мышцах, ответственных за движение левой верхней конечности. Инъекции Лаеннека привели к выраженному снижению интенсивности боли, опухания, к нормализации температуры, к исчезновению покраснения и к восстановлению двигательных функций [35]. Балл боли по визуальной аналоговой шкале (ВАШ) уменьшался по мере проведения терапии (рис. 6). Уже после 6-й процедуры отмечено снижение балла по ВАШ до 7, уменьшение ощущений скованности, холода и отека левого сустава запястья [35]. К 22-й процедуре балл ВАШ снизился до 3, покраснение кожи было практически полностью устранено (рис. 7).
ЗАКЛЮЧЕНИЕ
РА является серьезной проблемой в терапии и в ряде случаев весьма тяжело поддается лечению. ГПЧ могут являться существенным дополнением комплексной терапии артрита, т.к. пептидные компоненты Лаеннека и других препаратов на основе ГПЧ оказывают выраженное противовоспалительное и трофическое действие, что потенцирует процессы регенерации соединительной ткани хряща и кости.
По результатам рассмотренных исследований следует также отметить несколько принципиально разных путей введения препаратов на основе ГПЧ (для наружного применения, внутримышечного или внутривенного введения, введения в определенные акупунктурные точки). В частности, внутривенное введение гидролизатов ГПЧ и введение в акупунктурные точки предполагает высочайшую степень очистки гидролизата, жесткую стандартизацию по рН, аминокислотам, молекулярным массам белков, отсутствие раздражающих компонентов (этанол, фенол, хлорид натрия и других агрессивных консерванты). Такого рода препарат должен производиться в условиях, способствующих сохранению биологической активности действующих начала ГПЧ – пептидов, в т.ч. фрагментов ростовых факторов. Нельзя забывать и о том, что сырьем для приготовления высокоочищенных форм ГПЧ должна быть плацента полностью здоровой женщины, без вирусных и бактериальных инфекций, получавшей полноценное питание в течение всего срока беременности. В настоящее время таким условиям соответствует только один фармацевтический препарат Лаеннек – гидролизат плаценты человека (Japan Bio Products, Япония), который производится по стандартам GLP и GMP и подвергается специальной очистке от потенциальных аллергенов.


