Сахарный диабет (СД) − заболевание, которое приобрело характер эпидемии и встречается у 5−6% населения большинства стран, 95% этих пациентов страдают СД 2 типа. Истинная численность больных СД в 2 раза выше. Это мнение экспертов ВОЗ блестяще доказано в российском исследовании «NATION», согласно которому СД 2 типа был выявлен у 5,4% россиян [1]. Этиопатогенез СД 2 типа достаточно изучен [2] и имеется широкий спектр препаратов для лечения этого заболевания. Одним из новых подходов к контролю гликемии является использование препаратов, блокирующих реабсорбцию глюкозы в почке [3−6]. Известно, что у больных СД 2 типа пороговый уровень гликемии и максимальная емкость почечной реабсорбции глюкозы выше, чем у здоровых. Около 90% реабсорбции глюкозы в почечных канальцах обеспечивает Na+-глюкозный котранспортер 2 типа (НГЛТ-2), при ингибировании которого снижаются количество реабсорбированной глюкозы и уровень гликемии [7, 8]. Потенциальная безопасность такого метода «ускользания» от гипергликемии доказана при обследовании пациентов с семейной глюкозурией. Первым представителем нового класса пероральных сахароснижающих препаратов (ПССП) − ингибиторов НГЛТ-2 в России стал дапаглифлозин. Эффективность и безопасность препарата были подтверждены в многочисленных клинических исследованиях [3, 9, 10].
Дапаглифлозин − селективный обратимый ингибитор НГЛТ-2, тормозит почечный перенос глюкозы, способствует снижению ее реабсорбции, что приводит к дополнительному выведению глюкозы почками. Глюкозурический эффект наблюдается уже после первой дозы препарата и сохраняется в течение суток. Количество глюкозы в моче зависит от уровня гликемии и скорости клубочковой фильтрации почек (СКФ), при этом не нарушаются синтез эндогенной глюкозы и адекватный ответ на гипогликемию.
Выведение глюкозы почками под действием дапаглифлозина также сопровождается потерей калорий и снижением массы тела [3, 11], слабымы диуретическим и натрийуретическим эффектами, что приводит к небольшому, но устойчивому снижению артериального давления (АД) [10]. По данным многочисленных клинических исследований, частота побочных эффектов при приеме дапаглифлозина сопоставима с таковой при применении плацебо. Учитывая частое сочетание СД 2 типа и сердечно-сосудистых заболеваний, актуальны вопросы сердечно-сосудистой безопасности ПССП [12]. По данным метаанализа, включающего 21 клиническое исследование, продемонстрирована безопасность применения дапаглифлозина у пожилых лиц и пациентов с сердечно-сосудистыми заболеваниями [7, 13].
Таким образом, дапаглифлозин – препарат, действие которого не зависит от секреции инсулина, поэтому риск гипогликемии минимален. Помимо быстрого и эффективного контроля гликемии дапаглифлозин способствует снижению массы тела и АД и может быть использован на любом этапе лечения СД 2 типа в монотерапии, в комбинации со многими ПССП и инсулином. Препарат характеризуется высокой общей и сердечно-сосудистой безопасностью, не влияет на функцию почек. Возможно, патогенетический механизм действия дапаглифлозина в значительной степени связан со снижением глюкозотоксичности (ГТ), которая и является одной из причин манифестации и прогрессирования СД 2 типа.
В клинических исследованиях для изучения ГТ и инсулинорезистентности (ИР) используются расчетные индексы HOMA-B и HOMA-IR соответственно. Изучению ИР посвящено большое количество работ, тогда как исследований по изучению ГТ у больных СД 2 типа в литературе представлено недостаточно. Индекс HOMA-B отражает секреторную активность β-клеток и в определенной степени зависит от расы и веса больных [14−16]. Показано, что у больных СД 2 типа по сравнению со здоровыми лицами секреторная активность β-клеток (индекс HOMA-B) существенно снижена [17]. В исследовании по изучению влияния ингибитора НГЛТ-2 ипраглифлозина на ГТ и ИР у больных СД 2 типа показано, что исходная секреторная активность β-клеток (индекс HOMA-B) была низкой (21,09±14,75). Через 3 месяца лечения отмечено значимое повышение индекса HOMA-B до 37,04±31,04 (на 75,6%; р<0,001) [18]. Влияние дапаглифлозина на ГТ и ИР изучено недостаточно, поэтому представляется актуальным исследование этих показателей у больных СД 2 типа.
Цель исследования. Изучить влияние дапаглифлозина на ГТ и ИР у больных СД 2 типа с нецелевым уровнем гликемии.
МАТЕРИАЛ И МЕТОДЫ
Было обследовано 27 пациентов с длительно текущим СД 2 типа и нецелевым уровнем гликемии. Возраст больных составлял от 28 до 78 лет, в среднем 55,14±2,52 года. Среди обследованных пациентов было 9 мужчин (33,3%) и 18 женщин (66,6%). Длительность СД составляла от 1 до 28 лет, в среднем 11,1±1,2 года.
Масса тела (МТ) составляла от 72 до 165 кг, в среднем 99,12±3,94 кг. У большинства больных имелось ожирение различной степени: у 3,7% (n=1) была избыточная МТ, у 92,6% (n=26) − ожирение, в т. ч. у 59,3% (n=16) – I ст., у 29,6 (n=8) – II ст., у 7,4% (n=2) – III ст. Индекс МТ (ИМТ) составлял от 27,8 до 52 кг/м2, в среднем – 35,11±1,19 кг/м2.
Артериальная гипертензия различной степени выявлена у 92,5% пациентов (n=25), получавших антигипертензивную терапию. Доказанную ишемическую болезнь сердца имели 29,6% больных (n=8). Все пациенты получали терапию статинами, ингибиторами АПФ, дезагрегантами.
Контроль СД был неудовлетворительным: уровень гликемии натощак составлял от 8,2 до 18 ммоль/л, в среднем 12,4±0,5 ммоль/л, гликированного гемоглобина (HbA1c) — от 8,0 до 14,3%, в среднем 10,3±0,3%. Никто из больных не имел уровень HbA1с < 8%. У всех пациентов была сохранена секреторная активность β-клеток: уровень С-пептида составлял от 2,1 до 14,8 нг/мл, в среднем 6,70±0,56 нг/мл (референсные значения 1,1−4,4 нг/мл).
До применения комбинированной сахароснижающей терапии, включающей дапаглифлозин, практически все пациенты (92,6%; n=25) получали бигуаниды, 51,8% (n=14) больных − инсулинотерапию, 37% (n=10) – ингибиторы дипептидилпептидазы-4, 11,1% (n=3) − производные сульфонилмочевины, 11,1% (n=3) – агонисты глюкагоноподобного пептида-1 (ГПП-1). На момент назначения дапаглифлозина агонисты ГПП-1 были отменены. Длительность инсулинотерапии составила в среднем 6,5 лет, доза базального инсулина 50,1 ед/сут.
Уровень HbA1с определялся иммунохимическим методом, уровни тощаковой и постпрандиальной гликемии − глюкозооксидазным методом. Определение концентрации инсулина в сыворотке крови проводилось методом радиоиммунного анализа. ИМТ рассчитывали по формуле: ИМТ (кг/м2) = МТ(кг) / рост (м2). Измерение АД выполняли по методу Н.С. Короткова в положении сидя. Оценку функционального состояния почек (уровень креатинина и мочевины) проводили кинетическим методом Яффе с подсчетом СКФ, которая определялась расчетным методом по формуле CKD-EPI (2011). Также у пациентов без инсулинотерапии рассчитывался индекс ГТ (HOMA-B) по формуле [19, 20]: 20 × инсулин плазмы натощак (мкЕд/л) / глюкоза плазмы натощак (ммоль/л) - 3,5. Индекс ИР (HOMA-IR) до и после назначения дапаглифлозина рассчитывали у всех пациентов по формуле [19, 20]: глюкоза плазмы натощак (ГПН; ммоль/л) × инсулин плазмы натощак (мкЕд/л) / 22,5.
С целью улучшения гликемического контроля всем больным дополнительно назначался препарат дапаглифлозин по 10 мг, 1 раз в сутки утром.
У всех пациентов СКФ составляла >60 мл/мин/1,73 м2 (от 61 до 114, в среднем 90,79±2,90 мл/мин/1,73м2). У обследованных больных не было продвинутой стадии хронической болезни почек. Период последующего наблюдения составил 1 год.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
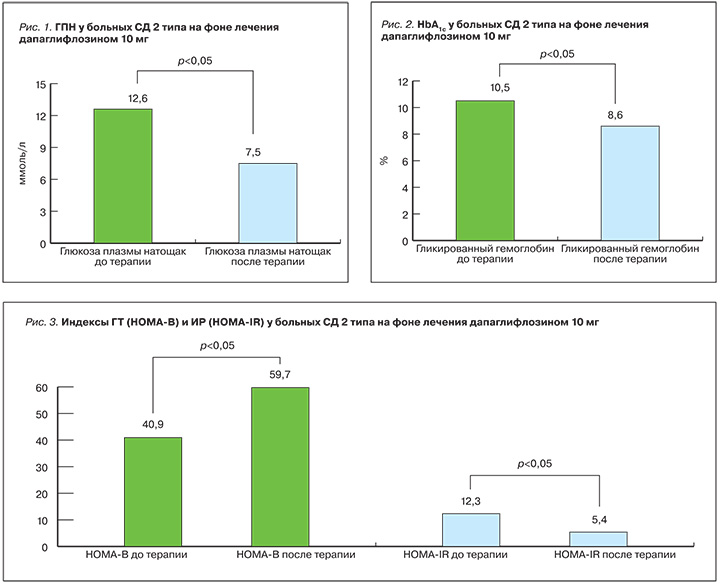
Терапия дапаглифлозином (10 мг) у больных с длительно текущим неконтролируемым СД 2 типа приводила к высокозначимому снижению уровня ГПН и HbA1с. Уровень ГПН на фоне лечения дапаглифлозином снизился на 4,7 ммоль/л и в среднем составил 7,53±0,27 ммоль/л (p=0,001; рис. 1). По дневнику гликемии эпизодов тяжелой гипогликемии зафиксировано не было, однако симптоматическая гипогликемия наблюдалась у 3 больных в группе инсулинотерапии. Уровень HbA1с на фоне лечения дапаглифлозином снизился на 1,4% и в среднем составил 8,6±0,2% (рис. 2). У 44% больных удалось достичь снижения HbA1с <8,5%. У 2 больных произведена отмена инсулина, у остальных – снижение его дозы в среднем на 30%.
Снижение МТ на фоне лечения дапаглифлозином (10 мг) составляло от 1 до 20 кг за год, в среднем 6,02±0,91 кг. Практически у 60% пациентов удалось добиться снижения МТ на 5%, а у 25% – на 10%.
В наблюдаемой группе больных отмечалось снижение АД: систолического в среднем на 12,6 мм рт. ст. (p=0,002), диастолического в среднем на 5,0 мм рт. ст. (p=0,017). Эпизодов ортостатической гипотензии не наблюдалось. Каких-либо кардиоваскулярных событий за период наблюдения в представленной группе больных зафиксировано не было. На фоне лечения дапаглифлозином наблюдалось значимое улучшение секреторной активности β-клетки (индекс HOMA-B) и снижение периферической ИР (индекс HOMA-IR). Так, HOMA-B исходно составлял для пациентов без инсулинотерапии 40,80±10,12, а на фоне лечения дапаглифлозином он вырос до 59,7±13,4 (p=0,007; рис. 3). Показатель HOMA-IR исходно составлял 12,27±1,24, а на фоне лечения дапаглифлозином он снизился до 5,4±0,79 (при норме <2,7; p=0,0004; рис. 3).
Итак, учитывая полученные результаты, можно отметить значительное улучшение периферической утилизации глюкозы и снижение периферической ИР у больных с плохим контролем СД 2 типа.
Препарат хорошо переносился, аллергических реакций не было. На фоне комбинированной терапии, включающей дапаглифлозин, у 1 пациентки наблюдалась побочная реакция в виде генитального зуда, который через 2 нед прошел самостоятельно. За период наблюдения инфекций мочеполовых путей не наблюдалось. Больные в целом имели удовлетворительный комплаенс в связи с удобным и простым приемом стабильной дозы дапаглифлозина (10 мг) в любое время суток.
ЗАКЛЮЧЕНИЕ
Дапаглифлозин стал первым представителем группы ингибиторов НГЛТ-2, зарегистрированным в России в 2014 г., поэтому имеется определенный практический опыт его применения. Инсулинонезависимый механизм его действия, отсутствие гипогликемических состояний, положительные плейотропные эффекты, безопасность и хорошая переносимость способствуют росту популярности дапаглифлозина. Препарат эффективен в качестве средства ранней монотерапии и в комбинации с другими ПССП, что доказано в многочисленных клинических исследованиях и пятилетним клиническим опытом [21]. Полученные авторами данные подтверждают литературные, однако степень снижения ГПН и HbA1с, а также МТ больных и АД оказались более выраженными. Вероятно, полученные результаты объяснимы исходными данными пациентов, которым дапаглифлозин назначался по индивидуальным показаниям в связи с недостаточной эффективностью предшествующей терапии. Учитывая быстрое и выраженное снижение уровня гликемии, авторами были проанализированы дополнительные факторы улучшения углеводного обмена, относящиеся к патофизиологическим аспектам развития СД 2 типа. Так, у пациентов были оценены ГТ и ИР исходно и в динамике с использованием известных формул [20]. Снижение ИР, вероятно, обусловлено существенным снижением МТ больных, а также, возможно, собственным инсулиносенситайзерным эффектом дапаглифлозина. Положительная динамика в отношении увеличения секреторной активности β-клеток косвенно подтверждает снижение ГТ фоне лечения дапаглифлозином.
Полученные результаты позволяют рекомендовать применение дапаглифлозина у пациентов с длительно текущим неконтролируемым СД 2 типа как альтернативу инсулинотерапии. Возможно, раннее назначение дапаглифлозина позволит улучшить гликемический контроль, отложить начало инсулинотерапии и минимизировать осложнения СД.
ВЫВОДЫ
Терапия дапаглифлозином (10 мг) у больных с длительно текущим неконтролируемым СД 2 типа приводила к высокозначимому снижению уровней ГПК и HbA1с.
На фоне лечения дапаглифлозином наблюдалось значимое улучшение секреторной активности β-клетки (HOMA-B) и снижение периферической ИР (HOMA-IR).
Дополнительными плейотропными эффектами дапаглифлозина (10 мг) явились значимые снижения МТ и АД.



