Сахарный диабет (СД) в современном мире является одной из важнейших медико-социальных проблем. За последние 20 лет масштабы распространения этого заболевания приобрели черты неинфекционной эпидемии. По предварительным данным, число больных к 2015 г. достигло 415 млн человек, и это только выявленные пациенты. Наиболее частой причиной смерти (68,3%) пациентов с СД является ишемическая болезнь сердца (ИБС). Известно, что пациенты с СД, наряду с нарушением углеводного обмена, имеют такие факторы риска, как артериальная гипертензия (АГ) и дислипидемия, что диктует необходимость комплексной оценки сердечно-сосудистого риска. В данной статье обсуждается вопрос оценки артериального давления (АД) и его связи с сердечно-сосудистыми осложнениями у пациентов с СД 2 типа.
ОЦЕНКА СЕРДЕЧНО-СОСУДИСТОГО РИСКА ПРИ АГ И СД
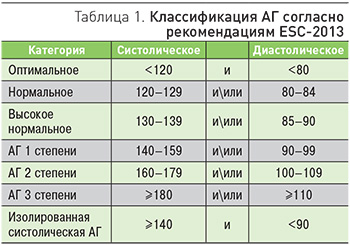 В настоящее время в соответствии с рекомендациями Европейского общества гипертонии и Европейского общества кардиологов (2013) применяется следующая классификация АД (табл. 1).
В настоящее время в соответствии с рекомендациями Европейского общества гипертонии и Европейского общества кардиологов (2013) применяется следующая классификация АД (табл. 1).
Следует учитывать, что при оценке значимости АД необходимо принимать в расчет наличие у большинства пациентов других факторов сердечно-сосудистого риска. Это особенно важно при подборе гипотензивной терапии, так как тактика лечения у пациентов разных групп риска может отличаться, о чем пойдет речь ниже. В настоящее время существует несколько методик оценки сердечно-сосудистых рисков. Наиболее распространенной является модель SCORE (Systematic Coronary Risk Evaluation), которая была разработана на основании крупных исследований в 12 странах Европы с участием более 205 тыс. больных [1]. По данной шкале оценивается 10-летний риск развития смертельных случаев всех заболеваний, связанных с атеросклерозом. Для расчета суммарного риска учитывается 2 немодифицируемых фактора риска (пол, возраст) и 3 модифицируемых (статус курения, систолическое АД, общий ХС). Необходимо учитывать, что в этой модели сильное влияние на прогноз имеет возраст, и, соответственно, сердечно-сосудистый риск у молодых пациентов может быть занижен даже при наличии других факторов риска. Данная особенность может привести к недостаточно интенсивному лечению данной группы пациентов. Таким пациентам при определении тактики лечения лучше использовать определение сердечного и сосудистого возраста. К сожалению, стандартные шкалы (PROCAM, ASSIGN, Framinghem Risk Score) не допустимы для использования у больных СД, и для данной категории пациентов были разработаны специальные шкалы.
В настоящее время для оценки кардиоваскулярного риска у пациентов с СД 2 типа используются два специальных калькулятора:
- калькулятор UKPDS Risk Engine, разработанный на основе материалов исследования UK Prospective Diabetes Study (UKPDS), в котором учитываются как традиционные факторы риска, так и специфические для пациентов с СД (online-калькулятор http://integrate.ccretherapeutics.org.au/Calculator/UkPds.aspx);
- калькулятор, разработанный по результатам исследования ADVANCE, в котором учитывается возраст на момент установки диагноза, длительность СД, пол, пульсовое давление, АГ, мерцательная аритмия, ретинопатия, уровень гликированного гемоглобина, отношение альбумин/креатинин, уровень холестерина (http://www.advanceriskengine.com/).
Нужно отметить, что практикующим врачам для оценки сердечно-сосудистого риска очень важно своевременное выявление бессимптомного поражения органов-мишеней, так как это может повлиять на назначение терапии. В настоящее время доказано, что на прогноз влияют следующие показатели: состояние миокарда, коронарный и периферический кровоток, почечная функция. Для выявления бессимптомного поражения сердца используют следующие исследования: ЭКГ, ЭхоКГ, стресс-ЭхоКГ, сцинтиграфию миокарда, МРТ. ЭКГ позволяет оценить наличие гипертрофии миокарда по индексу Соколова–Лайона SV1 +RV5>3,5 мВ. Но хотелось бы отметить, что для более точной диагностики гипертрофии миокарда левого желудочка следует использовать метод ЭхоКГ, позволяющий определить массу миокарда левого желудочка. За норму в настоящее время приняты значения 95 г/м2 для женщин и 115 г/м2 для мужчин; превышение этих значений говорит о наличии у пациента гипертрофии. В свою очередь, гипертрофию миокарда можно разделить на эксцентрическую и концентрическую, которая прогностически более неблагоприятна. Диагностическим признаком концентрической гипертрофии миокарда, наряду с увеличением массы левого желудочка, является увеличение отношения толщины стенки к радиусу левого желудочка более 0,42. Кроме того, по ЭхоКГ возможно выявление дилатации левого предсердия. В настоящее время принято оценивать размер левого предсердия по индексированному объему левого предсердия, который в норме не должен превышать 34 мл/м2. По результатам имеющихся на сегодняшний день исследований превышение этого объема является независимым предиктором развития фибрилляция предсердий и сердечной недостаточности [2]. Для уточнения диагностики ишемии миокарда тестом первой линии являются пробы с физической нагрузкой. Если они положительны или сомнительны, рекомендовано проведение стресс-эхографии или перфузионной сцинтиграфии. Кроме оценки состояния миокарда, при стратификации сердечно-сосудистого риска важно оценить состояние кровеносных сосудов с помощью УЗИ сонных артерий, определения лодыжечно-плечевого индекса и скорости пульсовой волны. По УЗИ сонных артерий оценивают толщину комплекса интима-медиа, наличие бляшек, которые являются факторами риска сердечно-сосудистых заболеваний [3].
Согласно рекомендациям Европейского кардиологического общества 2007 г., патологическим является утолщение комплекса интима-медиа более 0,9 мм. Утолщение более 1,5 мм говорит о наличии атеросклеротической бляшки. Но при этом нужно отметить, что крупное исследование ELSE не смогло доказать, что снижение толщины комплекса интима-медиа на фоне терапии приводит к снижению сердечно-сосудистых событий [4]. Измерение скорости пульсовой волны позволяет оценить жесткость сосудистой стенки, которая имеет высокую прогностическую значимость в развитии сердечно-сосудистых осложнений [5]. По последним рекомендациям Европейского кардиологического общества патологическим считается превышение скорости пульсовой волны выше 10 м/с [6]. Данных о том, что изменение пульсовой волны на фоне лечения приводит к снижению сердечно-сосудистых событий, в настоящий момент также нет. Оценить поражение периферических сосудов возможно также по лодыжечно-плечевому индексу. Его значение менее 0,9 указывает на выраженный атеросклероз сосудов, является предиктором сердечно-сосудистых событий и ассоциируется с двукратным увеличением сердечно-сосудистой смертности [5]. Кроме указанных выше показателей, сильным предиктором будущих сердечно-сосудистых событий является и поражение почек [7], в связи с чем всем пациентам с АГ рекомендовано проведение теста на микроальбуминурию и определение скорости клубочковой фильтрации. Итак, для первичной стратификации сердечно-сосудистого риска можно использовать все вышеперечисленные методы, но с целью динамического наблюдения можно рекомендовать только ЭКГ, ЭхоКГ и экскрецию белка с мочой, поскольку динамическое изменение других показателей не приводило к снижению сердечно-сосудистого риска.
Методы оценки АД
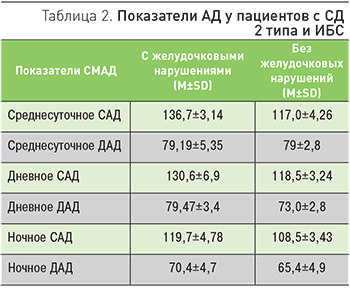
На настоящий момент основным методом оценки АД, согласно рекомендациям Всероссийского научного общества кардиологов и Всероссийского медицинского общества по АГ, является клиническое измерение АД. Это метод позволяет оценить АД в данный момент времени. Но не менее важно оценивать показатели АД в течение суток. К таким показателям можно отнести среднее АД, индекс площади и время гипертонии, отражающие процент времени, в течение которого АД превышает целевые значения. Данную информацию можно получить с помощью суточного мониторирования АД. По данным мониторирования рассчитываются средние дневные и ночные значения АД и их соотношение. Важность оценки данных показателей у пациентов с СД показывают результаты проведенного на кафедре эндокринологии РМАНПО исследования. Так, повышение среднего уровня систолического АД у пациентов с СД 2 типа и ИБС является предиктором ишемии миокарда и желудочковых нарушений ритма. Уровень систолического АД оказался достоверно выше в группе пациентов с ишемией миокарда в дневное время (p=0,043) и в ночное время (p=0,01) (табл. 2).
 Известно, что повышение АД увеличивает риск развития нарушений ритма сердца. Одним из механизмов аритмогенного характера гипертонии является удлинение интервала QT корригированного. Нами была выявлена статистически значимая прямая корреляция между среднесуточным систолическим АД (r=0,98, p=0,001) и среднесуточным диастолическим АД (r=0,65, p=0,04) с продолжительностью интервала QT. При этом продолжительность интервала QTc у пациентов с желудочковыми нарушениями ритма была статистически значимо длиннее (p=0,003).
Известно, что повышение АД увеличивает риск развития нарушений ритма сердца. Одним из механизмов аритмогенного характера гипертонии является удлинение интервала QT корригированного. Нами была выявлена статистически значимая прямая корреляция между среднесуточным систолическим АД (r=0,98, p=0,001) и среднесуточным диастолическим АД (r=0,65, p=0,04) с продолжительностью интервала QT. При этом продолжительность интервала QTc у пациентов с желудочковыми нарушениями ритма была статистически значимо длиннее (p=0,003).
Для оценки индивидуального сердечно-сосудистого риска необходимо не только исследование среднего уровня АД, но и его вариабельности, величины ночного снижения и утреннего подъема АД. Напомним, что в норме у человека существуют циркадные ритмы со снижением АД в ночные часы, достигающие минимума между 2 и 5 ч, с последующим резким повышением АД (превышающее ночное давление в среднем на 20 мм рт. ст. и дневное давление на 10 мм рт. ст.). У здоровых лиц в норме происходит ночное снижение АД на 10–22% (группа dippers) по сравнению с уровнем дневного АД. Недостаточным считается снижение АД в ночное время менее чем на 10% (группа non-dippers). Пациенты с отсутствием снижения АД в ночное время или его повышением в ночное время относятся к группе night-peakers. К чрезмерному снижению ночного АД относится его снижение более чем на 20% (группа over-dippres). Как показывают исследования, 73,5% пациентов с СД 2 типа имеют недостаточную степень снижения АД (группа non-dippers), у 11% ночное давление превышает дневное (night-peakers) [8]. При этом в исследовании PIUMO было выявлено, что отсутствие ночного снижения АД приводит к значимому увеличению сердечно-сосудистой смертности [9]. Схожие данные были получены и в Ohasama-исследовании [10]: относительный риск сердечно-сосудистой смертности при отсутствии ночного снижения АД у нормотоников повышается в 2,78 раза, а у гипертоников в 6,27 раз. При нормальном профиле АД у нормотоников относительный риск составляет 1,0, а у гипертоников 1,92. Таким образом, относительный риск сердечно-сосудистой смертности у нормотоников при нарушении суточного профиля АД даже выше, чем у гипертоников при сохранном суточном ритме. Отсутствие ночного снижения АД также приводит к дополнительному поражению почек. В исследовании у пациентов с ишемической болезнью сердца пациенты с суточным профилем non-dippers имели большее снижение клиренса креатинина и повышение экскреции белка с мочой через 3 года наблюдений по сравнению с пациентами с сохранным суточным профилем АД [11]. Недостаточное снижение АД также увеличивает риск цереброваскулярных осложнений [12].
В настоящее время существует несколько гипотез о возможных причинах нарушения суточного профиля АД. В некоторых исследованиях была выявлена взаимосвязь атеросклеротического поражения сосудов и нарушения суточного профиля АД. Не совсем ясно, что является причиной, а что следствием. С одной стороны, ночная гипертензия усугубляет поражение органов-мишеней при гипертонической болезни, но, с другой – атеросклероз приводит к нарушению барорефлекторной чувствительности в зоне каротидного синуса, что может быть причиной нарушения суточного профиля АД. По данным исследования П.А. Зелвеян и соавт. [17], увеличение толщины интима-медиа отмечалось у 30% с профилем non-dipper и только у 9% при профиле dipper. В нескольких работах отмечалась связь недостаточного ночного снижения АД с дисбалансом вегетативной нервной системы (повышение активности симпатического отдела и снижение парасимпатического) [13]. Возможный механизм данных изменений: прямое вазоконстрикторное действие гиперсимпатикотонии, опосредованно через увеличение активности ренин-ангиотензин-альдостероновой системы во время сна. Так, по результатам исследования N. Frizina и соавт. [19], у non-dipper отмечается недостаточное повышение парасимпатической нервной системы в ночное время. В японском исследовании было установлено, что степень ночного снижения АД зависит от уровня норадреналина днем. В работе Deyneli c соавт. [18]. была выявлена обратная корреляционная связь повышения дисперсии QT со степенью снижения ДАД ночью. На основании этого авторы сделали вывод о том, что недостаточное снижение АД в ночные часы может служить ранним маркером кардиоваскулярной формы автономной полинейропатии [14]. В связи с этим при ее выявлении всем пациентам рекомендовано проведение суточного мониторирования АД с целью исключения нарушения суточного ритма АД и скрытой гипертензии. Была установлена корреляция между ночным систолическим АД и количеством желудочковых нарушений ритма (r=0,45, p=0,02), что отражает влияние нарушенного суточного профиля АД на развитие аритмий. Недостаточное ночное снижение АД также увеличивает риск ишемических событий. У пациентов с эпизодами ишемии суточный индекс (отношение дневного и ночного АД) был ниже, чем у пациентов без ишемии миокарда: суточный индекс САД при ишемии составил 3,54±5,65 против 9,3±3,75 мм рт. ст. (p=0,02). Полученные данные свидетельствуют о необходимости оценки суточного профиля АД у пациентов с СД 2 типа с целью увеличения эффективности терапии.
Важным компонентом в определении особенностей АГ является также оценка утреннего подъема АД. С утренним подъемом АД связывают развитие острых сердечно-сосудистых катастроф, большинство из которых приходится именно на ранние утренние часы. При изучении 557 историй болезней пациентов, перенесших инсульт, отмечено, что максимальное количество случаев происходило между 10 и 12 ч, чуть реже между 4 и 6 ч утра. В исследовании Ohasama получены прямые доказательства роли утреннего подъема АД в увеличении смертности от сердечно-сосудистых причин на фоне АГ. Этот факт был установлен при длительном (более 10 лет) наблюдении за более чем 1200 больными с АГ среднего и пожилого возраста. Причиной избыточного утреннего подъема считается нарушение нейрогуморальной активности, прежде всего повышение активности симпатической нервной системы, что ведет к повышению сосудистого тонуса, в особенности в утренние часы. Помимо средних величин АД, важными показателями, влияющими на прогноз, являются вариабельность систолического и диастолического АД, что наглядно продемонстрировали результаты исследования ASCOT. По данным этого исследования было выявлено неблагоприятное влияние вариабельности АД, которую можно оценивать как достоверный предиктор развития инсульта и инфаркта независимо от среднего уровня АД, возраста, пола. Под вариабельностью АД принято понимать колебания АД. Вариабельность АД оценивается как стандартное отклонение от средней величины за дневной и ночной период для систолического и диастолического АД. За норму принималось стандартное отклонение систолического АД днем менее 15 мм рт. ст., ночью 14,5 мм рт. ст., а стандартное отклонение диастолического АД днем менее 13 мм рт. ст. и ночью менее 11 мм рт. ст. Увеличение вариабельности АД повышает риск поражения органов-мишеней. Так, гипертрофия миокарда левого желудочка у пациентов с нормальной вариабельностью давления в течение суток встречается примерно в 25% случаев, а у пациентов с повышенной вариабельностью – в 50%. Выявляется и взаимосвязь с поражением сосудов. Атеросклероз сонных артерий, по данным УЗИ, выявлялся у одного из пяти пациентов с АГ и нормальной вариабельностью давления в течение суток, при этом у пациентов с повышенной вариабельностью АД в четырех из пяти случаев определялось либо утолщение комплекса интима-медиа, либо атеросклеротическая бляшка.
Связь вариабельности АД с сосудистыми изменениями обусловлена различными причинами. Было показано, в частности, что высокая вариабельность АД способствует развитию эндотелиальной дисфункции, так как при суточном мониторинге АД (СМАД) у таких пациентов с высокой вариабельностью АД выявлялись более выраженные нарушения функции эндотелия по сравнению с пациентами с нормальной вариабельностью. Существует предположение, что повышение вариабельности АД вызывает эндотелиальную дисфункцию вследствие подавления продукции оксида азота и влияния на интиму сосудов, что, в свою очередь, может приводить к атерогенезу [15]. Предполагается также, что высокая вариабельность АД и значительный утренний подъем АД могут способствовать повышению агрегации тромбоцитов, что, безусловно, влияет на риск возникновения тромботических осложнений [16]. Итак, для полноценного контроля за АД необходимо изучение состояния механизмов сердечно-сосудистой регуляции, определение суточного ритма АД, ночных гипо- и гипертензии.
Нужно отметить, что в настоящий момент существуют четкие доказательства того, что снижение АД приводит к уменьшению числа сердечно-сосудистых событий. Начало гипотензивной терапии, по последним рекомендациям, показано всем пациентам с АГ 2 и 3 степени вне зависимости от сердечно-сосудистого риска и пациентам с АГ 1 степени в сочетании с СД, поражением органов-мишеней и в случае, если изменение образа жизни не привело к снижению АД.



