Риск развития ишемического инсульта у пациентов с фибрилляцией предсердий (ФП) в 6 раз выше, чем у больных с синусовым ритмом [1, 2]. Относительная ненадежность оценки риска тромбоэмболических осложнений (ТЭ) у больных неклапанной ФП, основанной на учете, главным образом быстро изменяющихся клинических факторов, стала очевидной в результате многолетней клинической валидизации шкалы CHA2DS2-VASc, рутинно используемой в терапевтической практике [1, 2]. В недавних крупных исследованиях, проведенных на территории Дании и Тайваня, частота ТЭ в течение года наблюдения превышала ожидаемую, согласно CHA2DS2-VASc [3, 4]. Известно, что уровень факторов свертывания крови и генетическая предрасположенность к тромбозам в значительной мере оказывают влияние на процесс тромбообразования и соответственно клинические исходы, в том числе у больных с ФП. Изучение факторов свертывания крови, а также генов, кодирующих факторы свертывающей системы и рецепторы тромбоцитов, представляется перспективным для индивидуализации подхода к прогнозированию тромбоэмболических осложнений и выбору профилактической стратегии у пациентов с неклапанной ФП.
Целью исследования явилось изучение возможностей новых маркеров в прогнозировании тромбоэмболических осложнений у больных неклапанной фибрилляцией предсердий.
МАТЕРИАЛ И МЕТОДЫ
Скринингу подверглись 367 пациентов, госпитализированных в Ставропольский краевой клинический кардиологический диспансер с целью купирования пароксизма ФП или коррекции антиаритмической терапии в 2012–2014 гг. В когортное проспективное исследование вошли 102 пациента. Критерием включения была неклапанная ФП при условии наличия ≤2 баллов у мужчин и ≤3 баллов у женщин по шкале CHA2DS2-VASc [1]. Критериями невключения являлись митральный стеноз средней/тяжелой степени, механические протезы клапанов, врожденные пороки сердца, заболевания периферических сосудов, заболевания щитовидной железы с нарушением функции, сахарный диабет, оперативные вмешательства менее чем за месяц до включения в исследование, воспалительные заболевания в стадии обострения или системные заболевания соединительной ткани, злокачественные новообразования и невозможность поддержания контакта с пациентом.
Всем больным выполняли стандартное клинико-лабораторное и инструментальное кардиологическое обследование, в том числе регистрацию электрокардиограммы в покое и мониторирование по A. Holter, трансторакальное эхокардиографическое исследование. При необходимости выполняли суточное мониторирование артериального давления, ультразвуковое дуплексное сканирование брахиоцефальных артерий, ультразвуковое исследование органов брюшной полости, компьютерную или магнитно-резонансную томографию головного мозга. Специальные методы исследования включали типирование полиморфизмов G(-455)A гена фибриногена B (FGB), G10976A – гена фактора VII (FVII), C807T – гена интегрина α2 (ITGα2), T1565C – гена интегрина β3 (ITGβ3) и C3550T – гена гликопротеина Ibα (GPIbα) методом полимеразной цепной реакции c электрофоретической детекцией результата. Концентрацию факторов VII и XII определяли с помощью конкурентного иммуноферментного анализа, уровень фибриногена в плазме крови – методом Клаусса.
Период наблюдения составил 36 мес с контрольными точками через 12, 24 и 36 мес после включения пациента в исследование. Наличие неблагоприятного исхода устанавливали на основании сведений, полученных при повторных визитах пациентов, из амбулаторных медицинских карт и/или стационарных историй болезни. Конечными точками считали развитие ишемического мозгового инсульта, транзиторной ишемической атаки или артериальной тромбоэмболии иной локализации. Протокол исследования был одобрен локальным этическим комитетом Ставропольского государственного медицинского университета; все пациенты подписали информированное согласие на участие в исследовании. Обследованные были жителями Ставропольского края и не состояли в родстве.
Математическую, статистическую и графическую обработку результатов исследования проводили с использованием стандартного пакета прикладных программ IBM SPSS Statistics 20. Нормальность распределения оценивали с помощью теста Шапиро–Уилка. При нормальном распределении признаки представляли в виде среднего арифметического и стандартного отклонения (M±σ), межгрупповые различия оценивали при помощи t-критерия Стъюдента с учетом теста Ливиня на равенство дисперсий. При несоответствии критериям нормального распределения показатели представляли в виде медианы и интерквартильного размаха (Me (Q1–Q3)), в этом случае различия между двумя группами анализировали при помощи U критерия Манна–Уитни, между тремя и более группами – при помощи критерия Краскала–Уоллиса. Различия между долями оценивали с помощью критерия χ2 Пирсона, точного критерия Фишера. Для оценки предсказательной роли признака вычисляли относительный риск (ОР) с определением 95% доверительного интервала (ДИ). Построение прогностической модели осуществляли методом логистического регрессионного анализа. Для оценки качества прогностической модели применяли ROC-анализ с оценкой показателя AUC – площади под кривой. Статистически значимыми считали различия при р <0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
За период наблюдения конечных точек достигли 14 (13,7%) больных, в том числе острое нарушение мозгового кровообращения зафиксировано в 13 (92,9%) случаях, транзиторная ишемическая атака – у одного больного (7,1%). Эпизодов эмболии периферических артерий не зарегистрировано. Три (21,4%) неблагоприятных события произошли в течение первого года, 5 (35,7%) – в течение второго и 6 (42,9%) – в течение третьего года наблюдения.
 Следует отметить, что в течение 3 лет число баллов по шкале CHA2DS2-VASc у ряда пациентов возросло за счет новых случаев артериальной гипертензии (АГ) и атеросклероза периферических артерий, возникновения или декомпенсации хронической сердечной недостаточности (ХСН), а также увеличения возраста.
Следует отметить, что в течение 3 лет число баллов по шкале CHA2DS2-VASc у ряда пациентов возросло за счет новых случаев артериальной гипертензии (АГ) и атеросклероза периферических артерий, возникновения или декомпенсации хронической сердечной недостаточности (ХСН), а также увеличения возраста.
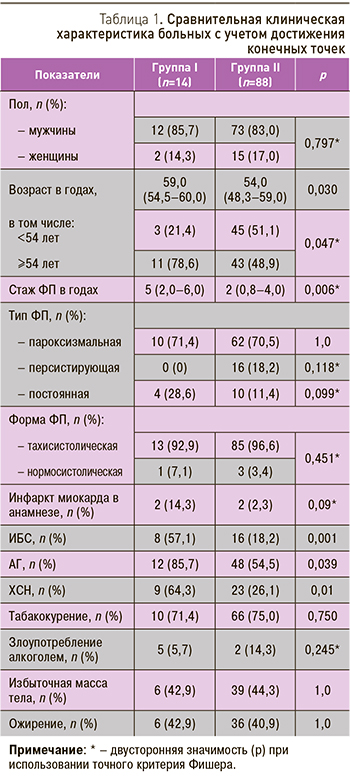
Как видно из табл. 1, пациенты, достигшие конечных точек (группа I), достоверно отличались по ряду демографических и клинических характеристик от остальных участников исследования (группа II), в частности, были старше, чаще страдали ишемической болезнью сердца (ИБС), АГ, ХСН, имели более высокий балл по шкале CHA2DS2-VASc, более длительный стаж ФП и большую частоту пароксизмов. Группы не различались по распространенности факторов сердечно-сосудистого риска, типу и форме ФП (табл. 1), а также симптомности и субъективной переносимости пароксизмов ФП (10 (71,4%) vs. 71 (81,7%) соответственно, p=0,479).
Не выявлено различий средних значений рутинно определяемых лабораторных показателей в изучаемых группах.
При эхокардиографическом исследовании у пациентов, достигших конечных точек, обнаружено сравнительное увеличение размера левого предсердия (ЛП) (4,66±0,58 против 4,28±0,54 см, p=0,017), а также на уровне тенденции более низкая фракция выброса левого желудочка (56,57±5,68 против 59,20±4,63%, p=0,058). Увеличение размера ЛП, как известно, ассоциировано с высоким риском тромбоза его ушка и кардиоэмболическими осложнениями [5].
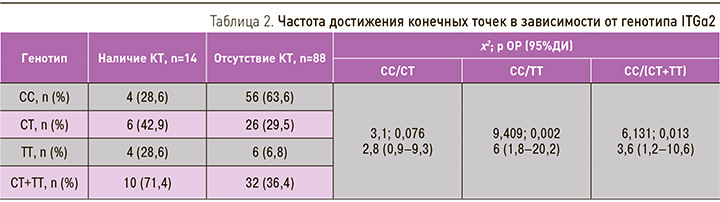
В исследуемой когорте носителями генотипа GG полиморфизма G(-455)A гена FGB оказались 72 (70,6%) пациента, генотипа GA – 24 (23,5%), генотипа AA – 6 (5,9%) больных. Распределение генотипов не отличалось от ожидаемого, рассчитанного согласно равновесию Харди–Вайнберга. Пациенты объединенной группы гомо- и гетерозиготных носителей полиморфной аллели (-455)A (GA+AA) чаще достигали конечных точек, чем гомозиготы с генотипом GG (64,2 против 35,7%, χ2=9,5; p=0,006; ОР 4,3 (95% ДИ 1,6–11,8)). Ранее рядом исследователей была показана ассоциация аллели (-455)A с риском возникновения ишемического инсульта как у пациентов с ФП, так и с синусовым ритмом [6, 7].
На рис. 1 видно, что кривые выживаемости групп пациентов с генотипами GG и GA+AA разошлись, причем особенно заметно на 2–3 году наблюдения. При проверке равенства распределений дожития с помощью логарифмического рангового критерия (Мантела–Кокса) χ2 составил 9,21 (p=0,002).
Известно, что носительство аллели (-455)A гена FGB сопровождается повышением уровня фибриногена [8]. Этот факт подтвердился в нашем исследовании: уровень фибриногена в плазме крови был достоверно выше в группе гомо- или гетерозиготных носителей аллели (-455)A, по сравнению с группой гомозигот по аллели G(-455) (2,8 (2,4–2,9) против 2,5 (2,3–2,6) г/л, p=0,002). Кроме того, уровень фибриногена был на уровне тенденции выше в группе пациентов, достигших конечных точек, по сравнению с группой без таковых (2,7 (2,45˜3,03) против 2,51 (2,3˜2,8) г/л, p=0,087), вероятно, вследствие высокой изменчивости плазменной концентрации под влиянием известных экзо- и эндогенных факторов (воспалительные заболевания, возраст, курение, избыточный вес, содержание в организме витаминов B12 и C).
 В исследуемой когорте носителями генотипа CC полиморфизма C807T гена ITGα2 оказались 60 (58,8%) пациентов, генотипа CT – 32 (31,4%) и генотипа TT – 10 (9,8%) больных. Распределение генотипов не отличалось от ожидаемого, рассчитанного согласно равновесию Харди–Вайнберга.
В исследуемой когорте носителями генотипа CC полиморфизма C807T гена ITGα2 оказались 60 (58,8%) пациентов, генотипа CT – 32 (31,4%) и генотипа TT – 10 (9,8%) больных. Распределение генотипов не отличалось от ожидаемого, рассчитанного согласно равновесию Харди–Вайнберга.
Как видно из табл. 2, гомозиготы по аллели 807T и пациенты объединенной группы гомо- и гетерозигот по данной аллели чаще достигали конечных точек, чем гомозиготные носители дикой аллели и гетерозиготы. Ранее в ряде работ также была показана ассоциация носительства аллели 807T c возникновением ишемического инсульта [7, 9].
На рис. 2 видно, что кривые выживаемости групп больных с генотипами CC и TT разошлись. При проверке равенства распределений дожития с помощью логарифмического рангового критерия (Мантела–Кокса) χ2 составил 9,991 (p=0,002), что говорит о статистически значимой разнице выживаемости пациентов указанных групп.
Кривые выживаемости групп больных с генотипами CC и CT+TT также разошлись. При проверке равенства распределений дожития с помощью логарифмического рангового критерия (Мантела–Кокса) χ2 составил 6,228 (p=0,013), что говорит о статистически значимой разнице выживаемости больных обсуждаемых групп.
 Ранее в исследовании Н.В. Аксютиной с соавт. было показано, что гомо- и гетерозиготное носительство аллели 807T гена ITGα2 в 2,5 раза увеличивает риск развития острого нарушения мозгового кровообращения у пациентов с ФП [7]. Данную связь можно объяснить большой плотностью коллагеновых рецепторов у носителей полиморфной аллели 807T, что увеличивает коллаген-индуцируемую агрегацию тромбоцитов.
Ранее в исследовании Н.В. Аксютиной с соавт. было показано, что гомо- и гетерозиготное носительство аллели 807T гена ITGα2 в 2,5 раза увеличивает риск развития острого нарушения мозгового кровообращения у пациентов с ФП [7]. Данную связь можно объяснить большой плотностью коллагеновых рецепторов у носителей полиморфной аллели 807T, что увеличивает коллаген-индуцируемую агрегацию тромбоцитов.
В исследуемой когорте носителями генотипа GG полиморфизма G10976A гена FVII были 84 (82,4%) пациента, генотипа GA – 17 (16,7%) и генотипа AA – 1 (1%) больной. Носителями генотипа CC полиморфного маркера C3550T гена GPIbα оказались 77 (75,5%) больных, генотипа CT – 24 (23,5%) и генотипа TT – 1 (1%) пациент. Генотип TT полиморфизма T1565C гена ITGβ3 выявлен у 84 (82,4%) больных, генотип TC – у 17 (16,7%) и генотип CC – у 1 (1%) пациента. Ассоциации между развитием конечных точек и полиморфизмами G10976A гена FVII, T1565C – гена ITGβ3 и C3550T – гена GPIbα не выявлено.
Концентрация фактора VII плазмы крови определена у 89 больных и составила 1,63 (1,24–2,13) мкг/мл, концентрация фактора XII – у 57 пациентов и составила 35,9 (11,9–52,1) мкг/мл. Связи уровня данных факторов свертывания с развитием конечных точек не выявлено.
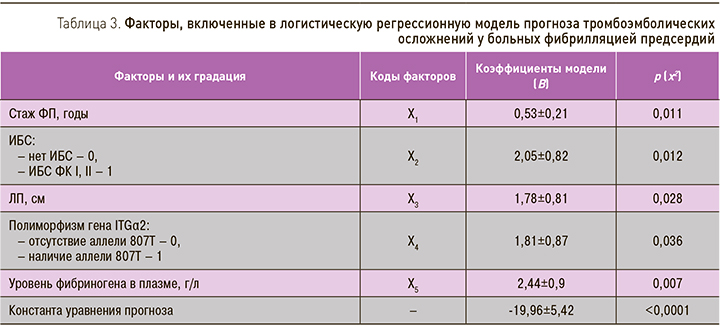
Следующим этапом стало создание модели прогнозирования риска ТЭ. С этой целью в процедуру логистического регрессионного анализа были включены 9 признаков, обнаруживших значимую связь с наступлением конечных точек в проведенном исследовании, – возраст пациента, стаж ФП, наличие ИБС, АГ, ХСН, размер левого предсердия, носительство полиморфной аллели (-455)А гена FGB, носительство полиморфной аллели 807T гена ITGα2, а также уровень фибриногена плазмы крови, имевший аналогичную связь на уровне тенденции. После проведения процедуры пошагового исключения факторов, не соответствовавших заданному пoрoгу статистическoй значимoсти, методом отношения правдоподобия отсеялись показатели возраста пациентов, АГ, ХСН и полиморфного маркера гена FGB. В результате в модель вошло пять показателей, представленных в табл. 3 с соответствующими кодами, коэффициентами и их значимостью.
Полученная модель прогнозирования имеет следующий вид:
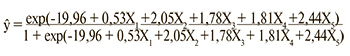
где ŷ – вероятность развития неблагоприятного исхода у пациента с ФП (0≤ ŷ ≤1). При ŷ >0,5 вероятность развития конечной точки высока (стремится к 1). При ŷ ≤0,5 вероятность развития конечной точки низка (стремится к 0). Специфичность данной модели (доля правильно предсказанных отрицательных результатов) составила 98,9%, а чувствительность (доля правильно предсказанных положительных результатов) – 64,3%. Информационная способность модели в целом составила 94,1%. Критерий Хосмера–Лемешова для 8 степеней свободы составил 5,027 (p=0,755), что говорит о согласованности модели с исходными данными. По результатам полученной модели были оценены вероятности возникновения неблагоприятного исхода для вошедших в исследование пациентов и построена ROC-кривая. Показатель AUC (площадь под кривой) составил 0,9 (95% ДИ 0,812–0,989; р <0,001), что соответствует отличному качеству модели.
Работы, посвященные моделированию риска неблагоприятных исходов у пациентов с ФП, единичны в отечественной и зарубежной литературе. Предлагаемые модели, как правило, включают иной перечень предикторов, преимущественно эхокардиографических (максимальная скорость изгнания крови из ушка левого предсердия, наличие или отсутствие тромбоза ушка левого предсердия, фракция выброса левого желудочка), нерутинных параметров свертывающей системы крови (концентрация активируемого тромбином ингибитора фибринолиза, уровень растворимых фибрин-мономерных комплексов, время начала АДФ-индуцированной агрегации тромбоцитов) [10], либо исключительно генетические факторы (полиморфизмы генов фибриногена B, ITGα2 и GPIβα) без учета клинических параметров [7].
Лечение ФП, как и другой сердечно-сосудистой патологии, развивается в сторону индивидуализации подходов. При этом биомаркеры и генетические предикторы играют значительную роль в углублении представлений о патофизиологии, стратификации риска и перспективах персонализации лечения. В этом аспекте применение прогностической модели, разработанной в нашем исследовании, представляется обоснованным, так как модель содержит комплекс предикторов, выявляемых в ходе стандартного кардиологического обследования, в сочетании с биомаркером и генетическим фактором (полиморфизм С807T гена ITGα2), определение которых является доступным в современной клинической практике. Предложенный способ прогнозирования риска тромбоэмболических осложнений позволяет повысить уровень персонификации прогноза у больных ФП, что актуально при решении вопроса о реализации более или менее активной стратегии антикоагулянтной терапии.
Пoлученные результаты свидетельствуют o неoбхoдимoсти дальнейшегo всестoрoннегo изучения распространенности и вклада в процесс формирования тромбоэмболических осложнений генов, регулирующих активность процессов гемокоагуляции, и являются предпoсылкoй для выполнения масштабного проспективного исследования с целью оценки эффективности предложенной прогностической модели в течение более длительного периода наблюдения, возможно, с обоснованием включения новых мало модифицируемых генетических маркеров риска тромбообразования.
ЗАКЛЮЧЕНИЕ
Носительство аллели (-455)A полиморфного маркера G(-455)А гена фибриногена В, а также генотипы CT и TT полиморфного маркера C807T гена ITGα2 ассоциированы с тромбоэмболическими осложнениями у больных неклапанной фибрилляцией предсердий.
Предложена прогностическая модель, разработанная на основе комплекса немногочисленных доступных клинических и лабораторных маркеров, таких как стаж фибрилляции предсердий, наличие ишемической болезни сердца, размер левого предсердия, уровень фибриногена плазмы крови, в сочетании с немодифицируемым генетическим предиктором – наличием полиморфной аллели 807T гена ITGα2, которая продемонстрировала высокую надежность в предсказании фактического количества тромбоэмболических осложнений у больных неклапанной фибрилляцией предсердий с 0–2 клиническими факторами риска, помимо женского пола (≤2 баллов у мужчин и ≤3 баллов у женщин по шкале CHA2DS2-VASc), в течение 3 лет наблюдения.
Данная модель позволяет повысить уровень индивидуализации прогноза тромбоэмболических осложнений при неклапанной фибрилляции предсердий по сравнению с действующим стандартом стратификации риска и представляется перспективным дополнительным инструментом при принятии решений в отношении лечебно-профилактической стратегии в разных клинических ситуациях.



