ВВЕДЕНИЕ
Внедрение генно-инженерной биологической терапии (ГИБТ) стало значительным событием в клинике внутренних болезней начала XXI в., поскольку увеличило число больных, достигающих ремиссии или низкой активности ревматических болезней [1]. Вместе с тем ГИБТ ассоциируется с рядом новых проблем, среди которых наиболее важными являются неэффективность лечения и развитие парадоксальных реакций при применении генно-инженерных биологических препаратов (ГИБП) [2–4].
Неэффективность лечения подразделяют на первичную, обусловленную исходным отсутствием эффекта, и вторичную, обусловленную синтезом нейтрализующих антител к лекарственному средству.
Под парадоксальной реакцией понимают появление у пациента на фоне ГИБТ симптомов, отсутствовавших до ее начала, причем вновь возникшие симптомы у большинства других больных с таким же заболеванием под действием ГИБП обычно уменьшаются или исчезают и зачастую включены в перечень показаний к применению указанного ГИБП [мнение авторов]. Таким образом, парадоксальную реакцию трудно трактовать как побочный эффект или нежелательную реакцию на лечение; более того, она не является признаком неэффективности или недостаточной эффективности ГИБТ, так как основные симптомы, по поводу которых исходно был назначен препарат, как правило, регрессируют [2–5]. К наиболее частым парадоксальным реакциям при применении ГИБП, в том числе ингибиторов фактора некроза опухоли α (ФНОα), относятся увеиты, псориаз, воспалительные заболевания кишечника [2–5]. Несколько реже встречаются саркоидоподобные реакции, гангренозная пиодермия, лейкоцитокластический васкулит и др. [1–5]. Интересно, что при применении ГИБП для лечения ревматоидного артрита парадоксальные реакции возникают значительно реже, чем при лечении спондилоартритов, воспалительных заболеваний кишечника или псориаза [6].
Этиология и патогенез парадоксальных реакций остаются неясными. Среди предполагаемых причин указывается возможность неполноценного апоптоза на фоне применения ряда лекарств с вероятной стимуляцией лимфоцитов, макрофагов и формированием лимфоцитарных инфильтратов в зоне парадоксальной реакции. Обсуждается роль генетической предрасположенности к определенным парадоксальным реакциям: показана ассоциация наличия определенных полиморфизмов генов с развитием увеитов и псориаза de novo при применении этанерцепта и других ингибиторов ФНОα [1, 7, 8].
Целью настоящей работы был анализ встречаемости и особенностей вновь возникших и имевшихся ранее увеитов у пациентов с анкилозирующим спондилитом (АС), получающих ингибиторы ФНОα.
МАТЕРИАЛ И МЕТОДЫ
В исследование были включены 119 больных АС, отвечающим модифицированным Нью-Йоркским критериям АС (1984) [9], старше 18 лет, получающие терапию ингибиторами ФНОα не менее 5 лет. Все пациенты включены в Санкт-Петербургский регистр ГИБТ и программу мониторинга активности, функционального статуса и коморбидности у пациентов с аксиальными спондилоартритами Северо-Западного федерального округа (ЛАДОГА) – регистрационный номер EГИСУ НИОКТР AAAA-A17-117100370030-9 от 03.10.2017.

35 пациентов получали инфликсимаб внутривенно по 5 мг/кг массы тела по схеме, указанной в инструкции, 35 – голимумаб по 50 мг в месяц подкожно, 29 – адалимумаб по 40 мг 1 раз в 2 недели подкожно, 11 – этанерцепт по 50 мг в неделю подкожно, 6 – цертолизумаба пэгол по 400 мг подкожно 1 раз в месяц. Клиническая характеристика больных представлена в таблице. Различия между пациентами, получавшими разные ингибиторы ФНОα, были недостоверны (p ≥0,05 для всех попарных сравнений). Средний срок наблюдения за пациентами составил 7,1±1,3 года.
Был выполнен анализ встречаемости увеитов на фоне терапии ингибиторами ФНОα и проанализированы их особенности (время возникновения первого эпизода относительно времени начала ГИБТ, частота рецидивов на фоне ГИБТ, наличие увеитов до начала ГИБТ, необходимость замены ГИБП и ее эффективность, взаимосвязь риска появления увеитов с эффективностью терапии опорно-двигательного аппарата). Эффективным считалось лечение, приведшее к достижению низкой активности или ремиссии заболевания согласно рекомендациям группы Экспертов по изучению спондилоартритов (ЭКСПА) при Ассоциации ревматологов России (АРР) и/или рекомендациям Международного общества по изучению спондилоартритов Assessment of SpondyloArthritis international Society (ASAS) [10]. Неэффективностью считали недостижение ремиссии или низкой активности АС [10].
 Статистический анализ выполняли с применением пакетов прикладных программ Statistica SPSS17 и Statistica GraphPadPrism. Характер распределения данных оценивали графическим методом и с использованием критериев Колмогорова–Смирнова и Шапиро–Уилка, нормальным считалось распределение при p ≥0,05. Описание признаков, имеющих нормальное распределение, было представлено в виде M±SD, где М – среднее арифметическое, SD – стандартное отклонение; для признаков с распределением, отличным от нормального, результаты представлены в виде Ме [Q1; Q3], где Me – медиана, Q1 и Q3 – первый и третий квартили.
Статистический анализ выполняли с применением пакетов прикладных программ Statistica SPSS17 и Statistica GraphPadPrism. Характер распределения данных оценивали графическим методом и с использованием критериев Колмогорова–Смирнова и Шапиро–Уилка, нормальным считалось распределение при p ≥0,05. Описание признаков, имеющих нормальное распределение, было представлено в виде M±SD, где М – среднее арифметическое, SD – стандартное отклонение; для признаков с распределением, отличным от нормального, результаты представлены в виде Ме [Q1; Q3], где Me – медиана, Q1 и Q3 – первый и третий квартили.
Для сравнения двух групп с нормальным распределением количественного признака определяли t-критерий Стьюдента для независимых групп (с учетом вида дисперсии признака, определенного методом Левена), парный t-тест для зависимых групп. При характере распределения данных, отличном от нормального, применяли непараметрические методы: критерий Манна–Уитни, критерий Вальда–Вольфовица, критерий χ2, критерий Вилкоксона, критерий знаков. Сравнение встречаемости признака изучали с применением метода Мантель–Кокс (log-rank Mantel–Cox test). Рассчитывали относительный риск развития увеитов и отношение шансов для появления увеитов в разных условиях. Применяли многофакторный анализ с пошаговым исключением признаков. Рассчитывали кумулятивную вероятность появления увеита при разных видах лечения спондилоартритов. Различия считались достоверными при p <0,05.
Пациенты, включенные в исследование, подписывали форму информированного согласия на участие в нем. Все данные анализировали после присвоения пациенту рандомизационного номера, не позволяющего идентифицировать пациента как личность. Исследование одобрено локальным комитетом по этике ФГБОУ ВО СЗГМУ им. И.И. Мечникова.
РЕЗУЛЬТАТЫ
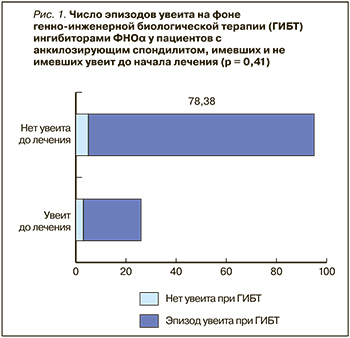
Из 119 больных АС 32 (26,8%) указывали на наличие хотя бы одного эпизода увеита (до или во время лечения ингибиторами ФНОα). 26 (81,25%) пациентов указывали на наличие увеитов до начала терапии ингибиторами ФНОα, у 6 (18,75%) увеиты впервые появились на фоне лечения этими препаратами. Вероятность рецидива увеита при применении ГИБП у пациентов, имевших увеит до начала терапии, не отличалась от вероятности развития увеита у лиц, не имевших его до лечения (относительный риск [OР] = 1,89); 95% доверительный интервал [ДИ] 0,44–8,15; p=0,41 для точного теста Фишера (рис. 1).
Из 26 больных, имевших увеиты до начала терапии ингибиторами ФНОα, 23 (88,46%) отмечали отсутствие рецидивов увеитов после начала ГИБТ, в то время как у 3 (11,5%) пациентов увеиты продолжали рецидивировать, что было расценено как признак недостаточной эффективности лечения АС (рис. 2).
Из числа всех пациентов, находившихся на ГИБТ, первичное отсутствие эффекта при лечении патологии опорно-двигательного аппарата при АС продемонстрировал 1 пациент, у 6 больных развилась вторичная резистентность к терапии ингибиторами ФНОα в течение последующих лет. Установлено, что эффективное лечение патологии опорно-двигательного аппарата (достижение низкой активности или ремиссии АС) ассоциируется с меньшим риском появления увеита на фоне применения ингибиторов ФНОα (OР=0,154; 95% ДИ 0,027–0,49; p=0,0056).
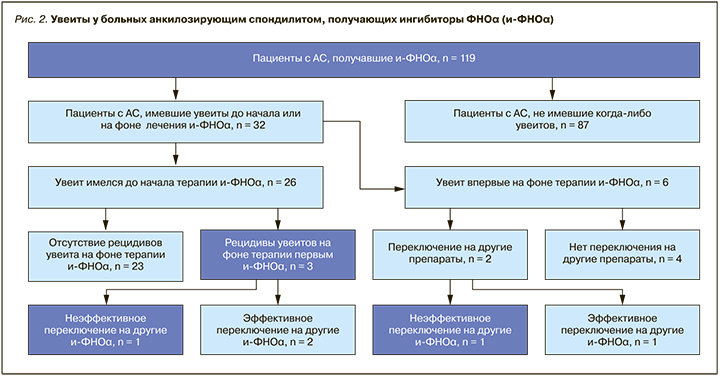
При анализе особенностей увеитов у пациентов, получавших разные ингибиторы ФНОα, получены следующие результаты. Из 9 больных, получавших инфликсимаб, 6 имели увеиты в анамнезе и на фоне лечения в течение 5 лет рецидивов увеитов не отмечали; у 3 больных развился увеит de novo, из них у 2 пациентов отмечался единственный эпизод острого увеита, не потребовавший изменения ГИБТ, а у одного пациента было 3 эпизода увеита, в связи с чем он был переведен на адалимумаб. При лечении этим ингибитором ФНОα отмечался еще один эпизод увеита, после чего было назначено лечение голимумабом с положительным эффектом в виде исчезновения рецидивов увеита.
Из 29 пациентов, получавших адалимумаб, 9 указывали на наличие хотя бы одного эпизода увеита. Из них у 1 пациента развился увеит de novo, в связи с чем он был переведен на лечение голимумабом с положительным эффектом. У одного из 8 больных, имевших увеиты до назначения адалимумаба, отмечен единичный рецидив острого увеита, не потребовавший перевода на другие ГИБП.
Из 35 пациентов, получавших голимумаб, на наличие увеитов указывали 12 человек. Одиннадцать больных имели увеиты до начала применения голимумаба, и у них не наблюдалось обострений увеита на фоне терапии. Увеит de novo отмечен у одного пациента, перевода на другой ГИБП в этом случае не потребовалось.
На фоне лечения цертолизумаба пэгол обострений увеитов не отмечено, пациенты с исходно имевшимся увеитом препарат не получали.
Один из пациентов с увеитом, включенный в исследование, продемонстрировал резистентность к лечению всеми ингибиторами ФНОα как в отношении уменьшения активности АС, так и в отношении течения хронического рецидивирующего увеита.
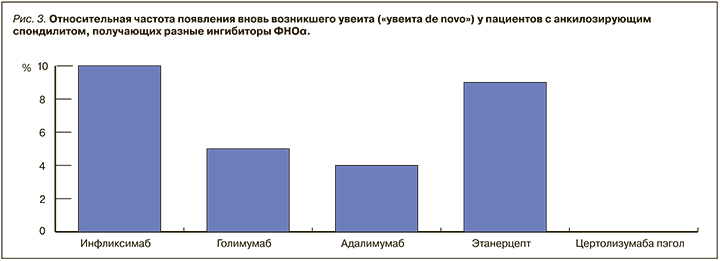
Из 93 пациентов, не имевших увеита перед началом ГИБТ, у 6 (6,4%) через 2–6 лет от начала лечения ингибиторами ФНОα развился острый увеит. При этом увеит de novo имел место у 3 из 30 (10%) пациентов, получавших инфликсимаб, у 1 из 28 (3,57%), получавших адалимумаб, у 1 из 24 (4,1%), получавших голимумаб, у 1 из 11 (9%), получавших этанерцепт. Ни разу такой увеит не развился у 6 пациентов, получавших цертолизумаба пэгол (рис. 3). Расчет кумулятивной вероятности развития увеита de novo при применении инфликсимаба, голимумаба, этанерцепта и адалимумаба показал большую его вероятность при терапии инфликсимабом по сравнению с другими ингибиторами ФНОα (R squares sum = 2,91; p=0,0001; рис. 3). Отмечена тенденция к увеличению риска увеита de novo при применении этанерцепта, которая не достигла статистической значимости (вероятно, в связи с малочисленностью выборки).
Установлено, что увеиты de novo возникали через 4±2 года от начала ГИБТ (минимально 2, максимально 6 лет), в то время как рецидивы ранее существовавших увеитов отмечались уже в первые месяцы после инициации ГИБТ (1–6 мес). Взаимосвязи между эффективностью лечения и риском возникновения увеита de novo не установлено (ОР=0,96; 95% ДИ 0,012–2,14; p=1,1).
ОБСУЖДЕНИЕ
Увеиты являются значимыми внескелетными проявлениями АС, которые снижают качество жизни больных и могут стать причиной временной или постоянной потери трудоспособности. В связи с этим отсутствие рецидивов увеитов – обязательное условие достижения ремиссии или низкой активности АС [10]. Вместе с тем лечение увеитов представляет определенные сложности.
Появление в арсенале ревматологов ингибиторов ФНОα, приведшее к значимому прогрессу в лечении скелетных проявлений АС, в первые годы также повысило эффективность лечения офтальмологических проявлений этого заболевания [11]. Однако вскоре появились данные о вновь возникающих или не разрешающихся увеитах на фоне терапии ингибиторами ФНОα [12, 13]. Во многих когортах в ходе наблюдения за больными АС с увеитами, как и в нашей работе, было выделено две группы пациентов: ранее имевшие увеит, у которых применение ингибиторов ФНОα не приводит к его излечению, и те, у кого увеит впервые возникает на фоне ГИБТ. Была высказана гипотеза, что механизм развития указанных форм увеитов неодинаков. Поводом к этому было явное преобладание случаев вновь возникшего увеита на фоне применения антител к растворимым рецепторам ФНОα, лечение которыми также ассоциируется с частым развитием или ухудшением течения воспалительных заболеваний кишечника. Предполагают, что на фоне блокады растворимых рецепторов ФНОα отсутствует полноценный апоптоз и это может приводить к активации Т-лимфоцитов, M2- или СD14+ макрофагов с активацией и прогрессированием парадоксального воспалительного процесса со стороны сосудистого тракта глаза или кишечника. Это предположение подтверждено экспериментами на экспериментальных моделях у животных. В пользу этой теории свидетельствует и тот факт, что в больших проспективных когортных исследованиях, как и в нашей работе, наименьшее число вновь возникших увеитов наблюдалось при применении ингибиторов ФНОα, характеризующихся наименьшим воздействием на растворимые рецепторы ФНОα и наибольшим влиянием на мембранные фракции ФНОα (адалимумаб и голимумаб) [13–15]. Однако нельзя исключить и наличие наследственной предрасположенности к развитию увеитов у лиц – носителей полиморфизмов ряда особых генов [16, 17].
Полученные нами результаты сопоставимы с данными других исследований [12–13]. Вместе с тем наша работа интересна тем, что в когорте больных не было пациентов с увеитами, которым для лечения АС назначали этанерцепт; это привело к изменению распределения риска возникновения новых увеитов в сторону инфликсимаба при сохранении высокого риска при применении этанерцепта. Любопытно и то, что, по нашим данным, при лечении ингибиторами ФНОα частота впервые возникших увеитов сопоставима с аналогичным показателем в отношении ранее существовавших увеитов. Это делает возможным предположение о том, что неэффективность ингибиторов ФНОα в лечении увеитов в ряде случаев имеет место у лиц с генетической предрасположенностью к их возникновению, подобной той, которую демонстрируют лица с увеитами как парадоксальными реакциями. В то же время у лиц с отсутствием генетической предрасположенности к парадоксальным реакциям лечение увеитов ингибиторами ФНОα в большинстве случаев эффективно. Противоречит подобному предположению тот факт, что сроки развития увеитов как рецидивов и увеитов как парадоксальной реакции различаются, а также то обстоятельство, что рецидивы увеита при АС ассоциируются с худшим ответом на лечение патологии опорно-двигательного аппарата, а развитие новых увеитов происходит в том числе на фоне ремиссии такой патологии.
Отметим, что частота появления у больных АС увеитов и воспалительных заболеваний кишечника со временем увеличивается, а встречаемость псориаза остается прежней [18]. Вероятнее всего, предикторы рецидивов увеита и предикторы появления парадоксальных реакций в виде увеита на фоне терапии ингибиторами ФНОα различаются. И предикторы отсутствия ответа на ГИБТ, установленные в работах ряда авторов, не могут быть предикторами увеитов как парадоксальных реакций на лечение биологическими агентами [19].
ВЫВОДЫ
- На фоне лечения ингибиторами ФНОα более чем у 80% больных АС, указывавших на наличие увеитов до начала ГИБТ, рецидивов увеита не отмечается.
- Эффективность лечения патологии опорно-двигательного аппарата у пациентов с АС ассоциируется с уменьшением риска рецидивов увеита у лиц, имевших увеиты до начала терапии, но не риска появления увеита de novo.
- Риск возникновения увеитов de novo при применении ингибиторов ФНОα у больных АС сопоставим с риском рецидивов увеитов у пациентов с увеитами в анамнезе.
- Применение адалимумаба и голимумаба ассоциируется с меньшим риском развития увеитов de novo, чем применение инфликсимаба и этанерцепта.
- Рецидивы увеитов у пациентов с указанием на их наличие в анамнезе чаще встречается в первый год ГИБТ; увеиты de novo чаще встречаются через 2–6 лет от начала применения ингибиторов ФНОα.
- Увеиты de novo, возникшие при применении моноклональных антител к ФНОα, в большинстве случаев имеют острый характер, хорошо купируются местными средствами и не требуют замены ГИБП.
ЗАКЛЮЧЕНИЕ
Данные ряда исследований, включая настоящее, позволяют предположить, что рецидивы увеитов у пациентов, имевших их в анамнезе, служат признаком неэффективности лечения АС, тогда как появление увеитов de novo на фоне ГИБТ является парадоксальной реакцией на ингибиторы ФНОα. Необходимо длительное наблюдение за большими выборками пациентов с АС, получающих ГИБП, а также проведение дополнительных клинических, лабораторных и генетических исследований для формирования представления о патогенезе и факторах риска развития увеита на фоне ГИБТ, а также для разработки мер по их эффективной профилактики.
Оптимизация лечения пациентов с рецидивирующими на фоне ГИБТ увеитами требует накопления дополнительных данных о природе указанного явления.


