Холестатические заболевания печени возникают вследствие нарушения выработки и выведения желчи гепатобилиарной системой. В результате этого происходит уменьшение канальцевого тока желчи, печеночной экскреции воды и/или органических анионов (билирубина, желчных кислот), накопление желчи в гепатоцитах и желчевыводящих путях, задержка компонентов желчи в крови (желчных кислот, липидов, билирубина). Повреждение клеток печени (гепатоцитов) или клеток желчных протоков (холангиоцитов) приводит к широкому диапазону клинических проявлений – от отдельных нарушений биохимических показателей функции печени до острой печеночной недостаточности или злокачественных образований в гепатобилиарной системе (например, холангиокарциномы).
 Длительно сохраняющийся холестаз (в течение нескольких месяцев–лет) может привести к развитию цирроза печени [1]. Врожденные, иммунологические, структурные (обструктивные/сосудистые) и токсические факторы также способствуют развитию холестатических заболеваний. К наиболее распространенным и изученным холестатическим заболеваниям печени обычно относятся первичный билиарный холангит (ПБХ) и первичный склерозирующий холангит (ПСХ).
Длительно сохраняющийся холестаз (в течение нескольких месяцев–лет) может привести к развитию цирроза печени [1]. Врожденные, иммунологические, структурные (обструктивные/сосудистые) и токсические факторы также способствуют развитию холестатических заболеваний. К наиболее распространенным и изученным холестатическим заболеваниям печени обычно относятся первичный билиарный холангит (ПБХ) и первичный склерозирующий холангит (ПСХ).
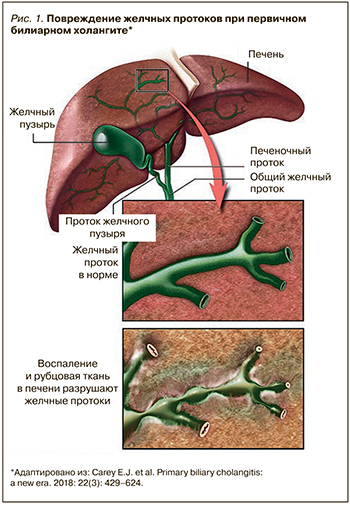
Под ПБХ (прежнее наименование – первичный билиарный цирроз) понимают хроническое аутоиммунное заболевание, характеризующееся прогрессирующим негнойным деструктивным воспалением мелких внутрипеченочных желчных протоков, их дальнейшим разрушением и исчезновением с последующим формированием фиброза и его конечной стадии – цирроза печени (рис. 1) [2].
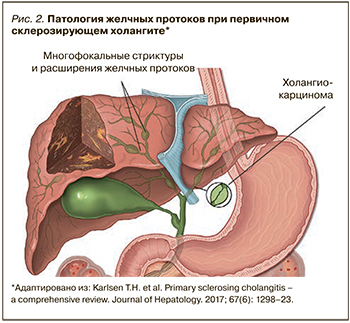
ПСХ – это хроническое заболевание печени, при котором воспаление и фиброз приводят к многоочаговым стриктурам желчевыводящих путей (рис. 2) [3].
Холестаз наблюдается во всех возрастных группах. Однако в младенческом и подростковом возрасте он встречается чаще. Кроме того, нет очевидной разницы в распространенности холестатической желтухи у мужчин и женщин [5]. Женщины имеют более высокий риск атрезии желчных протоков, лекарственного холестаза и внутрипеченочного холестаза беременных.
 По многочисленным опубликованным данным, в мире одна из каждой 1000 женщин старше 40 лет страдает ПБХ [6]. Продолжающиеся эпидемиологические исследования помогают лучше уяснить распространенность ПБХ в мире в целом и европейских странах. Заболеваемость им составляет приблизительно 1–2 случая в год на 100 000 населения. По разным данным, заболеваемость колеблется в пределах 0,3–5,8, распространенность — 1,9–40,2 случаев на 100 000 [7, 8, 9].
По многочисленным опубликованным данным, в мире одна из каждой 1000 женщин старше 40 лет страдает ПБХ [6]. Продолжающиеся эпидемиологические исследования помогают лучше уяснить распространенность ПБХ в мире в целом и европейских странах. Заболеваемость им составляет приблизительно 1–2 случая в год на 100 000 населения. По разным данным, заболеваемость колеблется в пределах 0,3–5,8, распространенность — 1,9–40,2 случаев на 100 000 [7, 8, 9].
ЭТИОЛОГИЯ И МЕХАНИЗМЫ РАЗВИТИЯ ХОЛЕСТАЗА
Этиология и механизмы развития холестаза многофакторны. Холестаз принято разделять на внепеченочный и внутрипеченочный [1].
Внепеченочный холестаз развивается чаще всего при механической обструкции магистральных внепеченочных или главных внутрипеченочных протоков. Наиболее частой его причиной выступают камни общего желчного протока [1].
Внутрипеченочный холестаз характеризуется уменьшением тока желчи и ее поступления в двенадцатиперстную кишку при отсутствии механического повреждения и обструкции внепеченочных желчных протоков. Он может быть связан с нарушением механизмов образования и транспорта желчи на уровне гепатоцитов в результате гепатоцеллюлярной патологии, а также может являться следствием повреждения внутрипеченочных протоков или их сочетанием [10, 11]. По механизму расстройства образования желчи холестаз делят на гепатоцеллюлярный и холангиоцеллюлярный.
Гепатоцеллюлярный холестаз может быть обусловлен вирусными, алкогольными, лекарственными, токсическими поражениями печени, застойной сердечной недостаточностью, метаболическими нарушениями (доброкачественный возвратный внутрипеченочный холестаз, холестаз беременных, муковисцидоз, альфа-1-антитрипсиновая недостаточность).
В патогенезе гепатоцеллюлярного холестаза важную роль играет нарушение функций базолатеральной и каналикулярной мембран. В основе этого явления могут лежать нарушения гепатобилиарного транспорта, такие как мутации генов белков-транспортеров и приобретенные дисфункции транспортных систем, обусловливающие нарушение каналикулярной или холангиоцеллюлярной секреции. Гепатоцеллюлярная аккумуляция токсических холефильных соединений вызывает множественные нарушения экспрессии гепатоцеллюлярных переносчиков. Кроме того, недостаток специфических компонентов желчи, вызываемый дисфункцией белков-переносчиков, раскрывает токсический потенциал других компонентов желчи [12].
Холангиоцеллюлярный холестаз имеет место при ПБХ, ПСХ и вторичном склерозирующем холангите, билиарной атрезии, болезни Кароли и др. При большинстве из перечисленных заболеваний наблюдается нарушение биохимических процессов в гепатоците, таких как трансметилирование и транссульфурирование (пересульфидирование). В результате угнетения реакций трансметилирования в гепатоцеллюлярных мембранах снижается содержание фосфолипидов, падает активность Na+/К+-АТФ-азы и других белков-переносчиков, что нарушает текучесть мембран, а также захват и выведение компонентов желчи. Нарушение реакций трансcульфурирования снижает клеточные запасы тиолов и сульфатов (глутатиона, таурина и др.), которые служат главными детоксикационными субстанциями в отношении эндогенных и экзогенных ксенобиотиков, включая желчные кислоты, а также обладают выраженным антиоксидантным эффектом. Их дефицит в конечном итоге определяет цитолиз гепатоцитов при холестазах любого генеза. Дуктулярный холестаз развивается в результате повреждения эпителия желчных протоков и нарушения их проходимости, в ряде случаев он связан с нарушением метаболизма желчных кислот, а также изменением их состава.
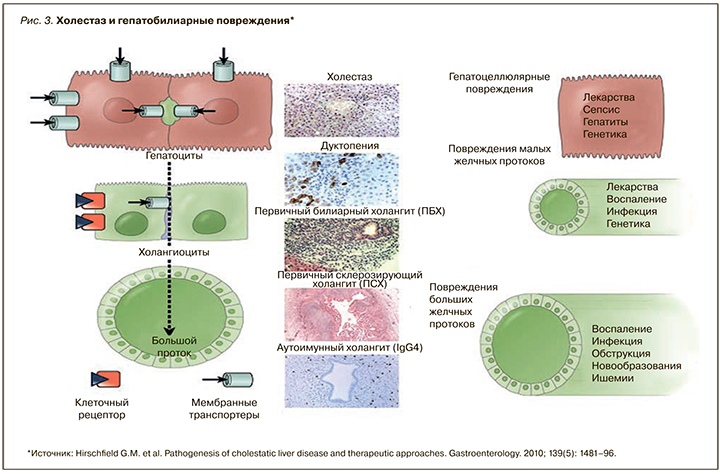
На рисунке 3 представлена этиология холестатических заболеваний печени, связанных с местом гепатобилиарного повреждения [13]. В ответ на повреждение зрелые холангиоциты и гепатоциты пролиферируют, что может привести к перидуктулярному фиброзу, билиарному фиброзу и холангиту. Прогрессирование заболевания и эффективность восстановления зависят от этиологии и реакции организма человека на повреждение.
Для полноценной детоксикационной функции печени и кишечного пищеварения критически важна эффективная секреция желчи. Холестаз представляет собой нарушение образования и/или оттока желчи, которое может оставаться бессимптомным или проявляться утомляемостью, зудом, неприятными ощущениями в правом верхнем квадранте живота, желтухой [14]. Ранние биохимические маркеры холестаза — повышение уровня щелочной фосфатазы (ЩФ) и гамма-глутамилтрансферазы (ГГТ) в сыворотке крови. Позднее повышается уровень билирубина. Холестаз расценивают как хронический при его продолжительности более 6 мес [15].
В таблице 1 представлены основные причины внутри- и внепеченочного холестаза у взрослых.

ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ХОЛЕСТАТИЧЕСКИХ ЗАБОЛЕВАНИЙ ПЕЧЕНИ
Хронические холестатические заболевания печени часто остаются бессимптомными на протяжении месяцев и лет, сопровождаясь только повышением уровня ЩФ в сыворотке [15]. ЩФ может поступать в сыворотку из разных источников (печени, тонкой кишки, костей, плаценты): повышение ее сывороточного уровня наблюдается не только при холестатических заболеваниях печени, но и при быстром росте костей у детей, внепеченочных заболеваниях (например, костных, таких как болезнь Педжета), дефиците витамина D или при беременности. О печеночном происхождении высокого уровня ЩФ свидетельствует одновременное повышение уровня ГГТ (или 5’-нуклеотидазы) и/или конъюгированного билирубина.
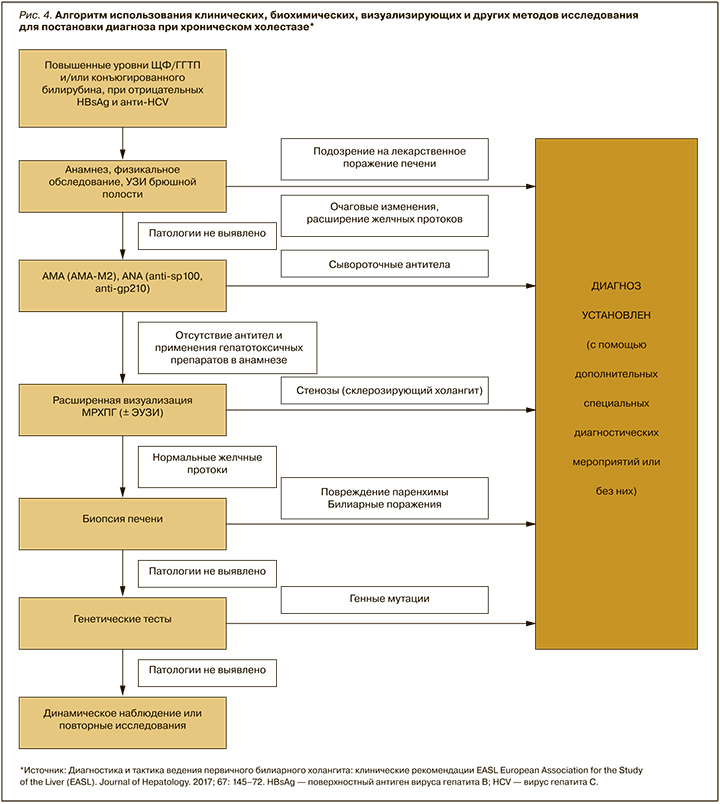
Для идентификации органа – источника ЩФ применяют определение ее изоформ, но на практике этот метод мало распространен, поэтому у детей более точным маркером холестаза является уровень ГГТ. Алгоритм диагностики хронического холестаза клиническими, биохимическими и визуализирующими методами, позволяющий в большинстве случаев установить его этиологию, представлен на рисунке 4 [15].
АНАМНЕЗ, ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ И УЗИ БРЮШНОЙ ПОЛОСТИ
В диагностике холестатических заболеваний печени неясного происхождения часто решающее значение имеет тщательно собранный анамнез – индивидуальный (в том числе сведения о поездках в другие страны), социальный, семейный [14]. ПБХ может сопутствовать аутоиммунному тиреоидиту Хашимото, синдрому Шегрена (нарушение секреции слез и слюноотделения), целиакии, системному склерозу. Воспалительные заболевания кишечника часто сопровождаются первичным склерозирующим холангитом.
Вторичный склерозирующий холангит может развиться после длительной интенсивной терапии и/или тяжелой политравмы, иммуноглобулин (Ig)G4-связанный холангит – после длительного контакта с красками, дизельным топливом и другими нефтепродуктами или промышленными газами. Лекарственный анамнез должен охватывать не только когда-либо проводившуюся и проводимую в настоящее время медикаментозную терапию, но и употребление средств нетрадиционной медицины, в том числе растительных, лекарственные зависимости (например, от анаболических стероидов, слабительных и т.п.), сведения о курении и употреблении алкоголя. Холестатический тип повышения уровня печеночных ферментов в сыворотке наблюдается приблизительно в 30% случаев лекарственных поражений печени [14]. Потенциально гепатотоксичны такие антибактериальные препараты, как амоксициллин + клавулановая кислота и триметоприм + сульфаметоксазол, а также анаболические стероиды, азатиоприн [16]. Следует прекратить прием лекарственных средств, начатый за 5–90 дней до развития холестаза, если он не был прекращен ранее по другим причинам, и проследить влияние этой меры на интенсивность заболевания.

Физикальное обследование направлено на выявление гепато- и спленомегалии и внепеченочных признаков далеко зашедшего поражения печени, таких как желтушность кожи, склер и слизистых, ксантелазмы, эритема подошв и ладоней, изменения ногтей и расчесы, особенно на руках и ногах. УЗИ брюшной полости – первоочередное визуализирующее исследование для исключения механической обструкции желчных путей, объемных образований, в том числе внепеченочных, и заболеваний желчного пузыря. УЗИ – чувствительный, неинвазивный и относительно дешевый метод, который, кроме всего прочего, применим у постели больного. Однако его информативность зависит от навыков исследователя, изменения желчных протоков могут остаться не диагностированными. При нормальной УЗИ-картине наиболее вероятен внутрипеченочный холестаз.
СЕРОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ И СТАНДАРТНЫЕ БИОХИМИЧЕСКИЕ ПОКАЗАТЕЛИ ФУНКЦИИ ПЕЧЕНИ
При хроническом внутрипеченочном холестазе как следующий этап диагностики рекомендуется определение антимитохондриальных антител (АМА) и ПБХ-специфических антинуклеарных антител (АНА) – иммунофлюоресцентное исследование и/или тестирование на специфические антитела (анти-sp100 и анти-gp210) с помощью вестерн-блоттинга или твердофазного иммуноферментного анализа (ELISA). В диагностике ПБХ и других хронических холестазов неясной этиологии они высокочувствительны и специфичны, но специфичностью исключительно в отношении ПБХ они не обладают. Распространенность АМА-серопозитивности выше (около 1:1000), чем ПБХ (около 0,4:1000). В некоторых популяциях (например, среди индейцев-шайенов в Колорадо) распространенность AMA- и ПБХ-специфичной АНА-серопозитивности без клинических проявлений ПБХ достигает 15% [15].

Высокий уровень билирубина в сыворотке рассматривается как главный предиктор неблагоприятного исхода [17]. По уровню билирубина в сочетании с уровнем альбумина до начала терапии урсодезоксихолевой кислотой (УДХК-терапии) можно выделить 3 категории риска: низкий (при нормальном уровне обоих показателей), средний (отклонение от нормы только одного из них) и высокий (при сочетании гипербилирубинемии с гипоальбуминемией). В определении уровня риска у больных, получающих УДХК, эффективны также шкала риска Мейо и шкала MELD (модель терминальной стадии болезни печени) [18]. Однако гипербилирубинемия и гипоальбуминемия развиваются только на очень поздней стадии ПБХ. Оценить риск по уровням билирубина и альбумина на ранних стадиях невозможно.
ДОПОЛНИТЕЛЬНЫЕ ВИЗУАЛИЗИРУЮЩИЕ ИССЛЕДОВАНИЯ И БИОПСИЯ ПЕЧЕНИ
 Магнитно-резонансная холангиопанкреатография (МРХПГ) при холестазе служит точным и безопасным методом визуализации внутри- и внепеченочных желчных протоков [15]. В диагностике первичного или вторичного склерозирующего холангита решающее значение имеет выявление стеноза и расширения внутри- и/или внепеченочных желчных протоков. В диагностике камней и внепеченочной обструкции желчных протоков, особенно дистальных, эндоскопическое УЗИ по информативности равнозначно МРХПГ.
Магнитно-резонансная холангиопанкреатография (МРХПГ) при холестазе служит точным и безопасным методом визуализации внутри- и внепеченочных желчных протоков [15]. В диагностике первичного или вторичного склерозирующего холангита решающее значение имеет выявление стеноза и расширения внутри- и/или внепеченочных желчных протоков. В диагностике камней и внепеченочной обструкции желчных протоков, особенно дистальных, эндоскопическое УЗИ по информативности равнозначно МРХПГ.
Если перечисленными методами установить причину внутрипеченочного холестаза не удалось, показана биопсия печени. Биоптат подходящего для диагностики качества должен включать по крайней мере 11 портальных полей. Гистологические находки могут включать:
- изменения желчных протоков: хронический негнойный холангит, облитерирующий фиброзный холангит и более редкие холангиопатии;
- изменения вне желчных протоков: болезни накопления, инфильтративные, воспалительные и гранулематозные поражения, узелковую регенераторную гиперплазию, пелиоз, расширение синусоидов и цирроз различной этиологии;
- гепатоцеллюлярный холестаз с незначительными гистологическими изменениями или без них, наблюдающийся при доброкачественном рецидивирующем внутрипеченочном холестазе, приеме эстрогенов или анаболических стероидов, сепсисе, полном парентеральном питании или как паранеопластический феномен.
В таблице 2 представлены заболевания, связанные с билиарными поражениями.
ГЕНЕТИЧЕСКОЕ ТЕСТИРОВАНИЕ
Описан целый ряд наследственных синдромов, сопровождающихся холестазом [15]. Из моногенных холестатических синдромов наиболее изучены мутации генов транспортных белков ATP8B1, ABCB11 и ABCB4, которые могут проявиться в раннем детстве, подростковом или зрелом возрасте как прогрессирующий семейный внутрипеченочный холестаз 1–3 типа (Progressive Familial Intrahepatic Cholestasis, PFIC type 1–3), доброкачественный рецидивирующий внутрипеченочный холестаз, персистирующая гепатоцеллюлярная секреторная недостаточность, внутрипеченочный холестаз беременных или холестатический синдром вследствие нехватки фосфолипидов. В таблице 3 представлены мутации генов транспортных белков при семейном внутрипеченочном холестазе 1–3 типа.
Молекулярно-генетическая диагностика этих мутаций выполняется в специализированных лабораториях. Она показана в случаях, когда другие причины холестаза исключены и семейный анамнез, клиническая картина, данные биохимических и визуализирующих исследований указывают на его моногенную наследственную природу. Генетическая диагностика чрезвычайно редких холестатических синдромов, таких как синдром Алажилля (дефекты генов Jagged, Notch2), PFIC4 (TJP2), которые связаны с мутациями MYO5B, кодирующего виллин, или FXR, выполняется лишь в отдельных специализированных центрах и показана только при обоснованных подозрениях на эти наследственные расстройства.
Диагностические инструменты важны в клинической практике с нескольких точек зрения. Во-первых, они значимы для отбора пациентов в условиях обычной помощи или при клинических исследованиях; во-вторых, для стратификации пациентов по группам риска и оценки неоднородности по ожидаемому исходу при включении в клинические исследования. В таблице 4 представлены инструменты прогнозирования исходов ПБХ с классификацией пригодности и надежности на 3 уровня (высокий, умеренный и неопределенный).
ЛЕЧЕНИЕ ПАЦИЕНТОВ С ХОЛЕСТАЗОМ
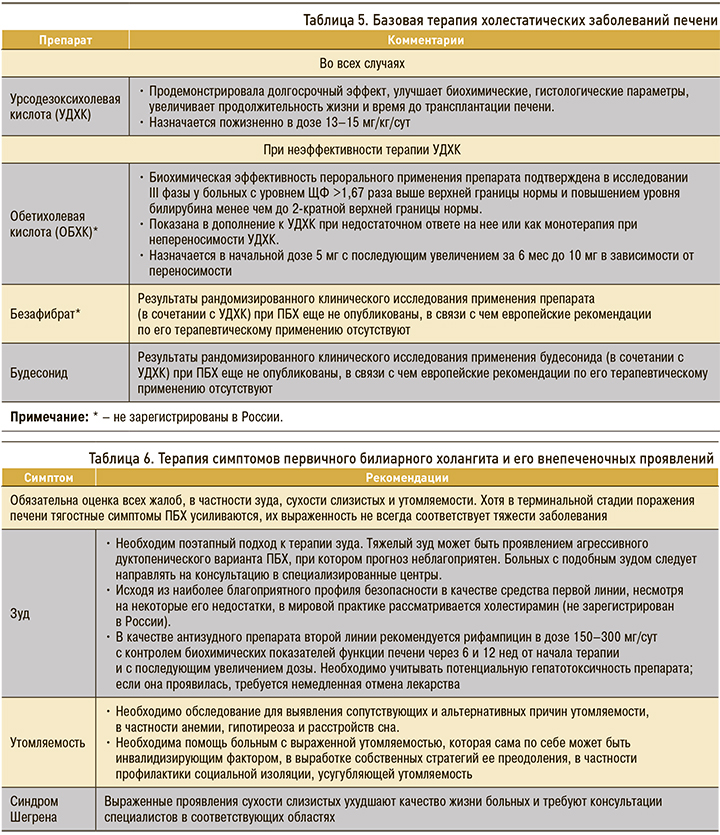
Терапия холестатических заболеваний печени делится на базовую (табл. 5) и терапию основных симптомов/синдромов, встречающихся при холестазе.
Приблизительно у 10% больных ПБХ обнаруживаются проявления аутоиммунного гепатита (АИГ). В большинстве случаев они возникают одновременно с проявлениями ПБХ, но иногда спустя годы после диагностирования ПБХ. Для подтверждения сопутствующего АИГ обязательна биопсия. Она показана при непропорционально высоком уровне аланинаминотрансферазы (АлАТ) и/или IgG.
При ПБХ с характерными для АИГ проявлениями благоприятное действие оказывает иммуносупрессивная терапия, дополняющая УДХК. Она показана при выраженном «пограничном» гепатите. Показания к ней следует оценивать и при умеренном «пограничном» гепатите. Больных необходимо информировать о возможном побочном действии иммуносупрессивных лекарственных средств [15].
Спектр симптомов ПБХ, резко ухудшающих качество жизни, весьма широк [15]: кроме общеизвестных проявлений (зуд, сухость слизистых, утомляемость), он включает и такие, как боль в костях и животе, синдром «беспокойных ног». Рекомендации по симптоматическому лечению ПБХ приведены в таблице 6.
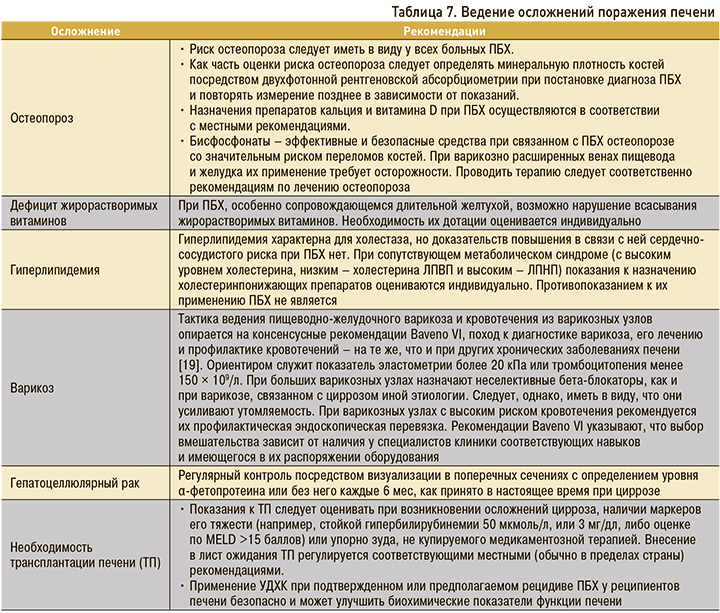
В таблице 7 представлены основные рекомендации по ведению пациентов с осложнениями при ПБХ [15].
 В современных руководствах в качестве первой линии лечения пациентов с холестазом рекомендовано применение урсодезоксихолевой кислоты (УДХК) [15].
В современных руководствах в качестве первой линии лечения пациентов с холестазом рекомендовано применение урсодезоксихолевой кислоты (УДХК) [15].
В обычных условиях УДХК составляет около 1–3% желчных кислот, но при приеме препаратов УДХК внутрь она становится преобладающей в пуле желчных кислот. Степень обогащения желчи ею коррелирует с улучшением биохимических показателей функции печени [15].
УДХК является посттранскрипционным стимулятором секреции гепатоцитов и холангиоцитов, также она усиливает перенос последних через мембраны посредством мощной активации посттранскрипционного сигнального пути транспортных белков и каналов. При холестатических состояниях этот механизм и обеспечиваемая им секреция HCO3, желчных кислот, билирубина и ряда других холефилов нарушается. По опубликованным данным, оптимальная доза УДХК составляет 13–15 мг/кг/сут в один или (в целях лучшей переносимости) два приема.
К препаратам УДХК, широко применяемым в терапии холестатических заболеваний печени, относится Гринтерол® (АО «Гриндекс», Латвия) [20, 21]. Гринтерол® представляет собой микронизированную УДХК полного цикла европейского производства (от субстанции до готовой формы). Процесс микронизации позволяет получать однородные по размерам микрочастицы. Микронизированная УДХК обладает лучшими параметрами биодоступности [23].
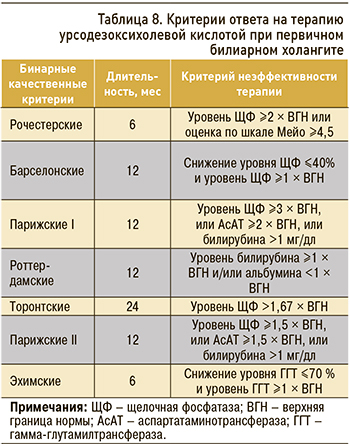
Надежность динамики стандартных биохимических показателей функции печени на фоне терапии УДХК как простого и информативного диагностического инструмента подтверждена последними 10 годами широкого использования препарата. Ответ на УДХК-терапию поддается оценке по модели дискретных бинарных переменных или балльных оценочных систем на основе расчета непрерывных переменных (табл. 8).
Международный консенсус признал наиболее важными критериями ответа на УДХК-терапию при ПБХ уровни ЩФ и общего билирубина [17]. Этим объясняется повышение эффективности Парижских критериев I при разграничении групп низкого и высокого риска. Для более точного прогнозирования в ранней стадии ПБХ, которая имеет место более чем у 2/3 больных исследованных в последнее время групп пациентов, предназначены Парижские критерии II [22].
Таким образом, патофизиологические механизмы развития холестаза многофакторны и взаимосвязаны между собой. Диагностика холестатических заболеваний печени может осуществляться по предложенному алгоритму, в основу которого заложен принцип пошагового исключения наиболее вероятных причин их возникновения. Успех лечения больных с холестазом зависит от своевременно поставленного диагноза и применения лекарственных препаратов первой линии, позволяющих устранить или ослабить патогенетические механизмы развития заболевания. Наиболее изученными и часто применяемыми препаратами для лечения пациентов с холестазом являются препараты УДХК.


