Изначально боль – явление физиологическое, чья функция – предупредить об опасности, вредных воздействиях окружающей среды или патологических процессах, происходящих в организме. Первично возникающая боль обычно бывает острой, резкой, интенсивной, проходит при устранении раздражителя и восстановлении поврежденной ткани или органа. Такая боль выполняет сигнальную функцию и обеспечивает активацию систем организма, направленных на устранение повреждающего фактора. Определение боли, данное Международной ассоциацией по изучению боли (Merskey, Bogduk, 1994), гласит: «Боль – это неприятное ощущение и эмоциональное переживание, возникающее в связи с настоящей или потенциальной угрозой повреждения тканей или изображаемой терминами такого повреждения». Таким образом, боль не всегда возникает в ответ на повреждение; иногда она появляется в его отсутствие или продолжается, когда повреждение уже устранено. Такая боль служит не защитным, а повреждающим фактором. Это так называемая патологическая боль, которая формируется как следствие нарушения функционирования нервной системы и психических нарушений. Эта составляющая обычно присутствует в структуре хронических болей.
Хроническая боль – это боль, продолжающаяся сверх нормального периода заживления (более 3 мес) и не поддающаяся обычному медикаментозному лечению, эффективному при острой боли. Единого временного критерия «хронической боли» нет: по данным Международной ассоциации по изучению боли, она длится не менее 3 мес, в соответствии с критериями DSM-IV – более 6 мес. Хроническая боль часто становится самостоятельной болезнью, выступая единственным симптомом, для которого характерно отсутствие прямой связи с органической патологией. Определить причину такой боли чаще всего не удается.
Распространенность хронических болей чрезвычайно высока и, по некоторым данным, достигает четверти всего населения Земли. По большей части это пожилые люди, имеющие несколько заболеваний, которые провоцируют развитие болевого синдрома комплексной этиологии. Лидирующее место в структуре болей занимают боли, связанные с заболеваниями опорно-двигательного аппарата (артриты, артрозы, мышечно-тонические синдромы и др.).
Кроме подразделения боли по временному фактору (острая и хроническая), существует классификация болей, учитывающая их патофизиологические особенности, в соответствии с которыми формируются разные терапевтические подходы. На сегодняшний день наиболее распространено выделение трех типов боли [1]:
• ноцицептивная (соматогенная, соматическая) боль. Возникает при активации болевых рецепторов различными раздражителями (например, при травме, воспалении, ишемии, отеке). Главные механизмы ее развития – воспаление и мышечный спазм. При повреждении поверхностных тканей, боль, как правило, острая, хорошо локализованная; патология внутренних органов дает глубокие, схваткообразные боли без четкой локализации. Ноцицептивная боль служит защитной реакцией и проходит после исчезновения повреждения, однако при хроническом воспалении, например, при ревматоидных болях, адаптивное значение боли утрачивается. Этот тип боли терапевтически чувствителен к морфину и другим наркотическим анальгетикам;
• нейропатическая (нейрогенная) боль. Является следствием первичного повреждения нервной системы на любом уровне (выделяют периферическую и центральную невропатическую боль). Она не связана с повреждением ноцицепторов, не служит сигналом о повреждении и не имеет защитной функции. Основные механизмы, лежащие в основе данного типа боли:
- периферическая сенситизация (избыточная активность натриевых каналов);
- центральная сенситизация (гипервозбудимость центральных сенсорных нейронов);
- дизингибиция (недостаточность нисходящих антиноцицептивных влияний).
Примеры такой боли – тригеминальная боль, корешковый синдром, боль при диабетической невропатии, постгерпетическая невралгия, постинсультная центральная боль. Общие их характеристики – персистирующий характер, большая длительность, неэффективность анальгетиков, многообразие сенсорных проявлений (гиперестезия, гипералгезия, аллодиния, выпадение разных видов чувствительности), сочетание с вегетативными расстройствами (снижение кровотока, гипер- и гипогидроз в болевой области) и двигательными нарушениями [2];
• дисфункциональная боль. Обусловлена изменением функционального состояния отделов ЦНС, участвующих в контроле боли (синдром центрального усиления боли). Основными механизмами ее развития считаются дизингибиция и центральная сенситизация. Главное отличие дисфункциональной боли от болей двух первых типов – невозможность выявить причину либо органическое заболевание, объясняющее ее появление. Основными предпосылками, влияющими на ее развитие, выступают эмоциональные, социальные и психологические факторы, которые приводят к дисфункции нисходящих норадренергических и серотонинергических систем; в результате этого обычные неболевые стимулы начинают восприниматься как болевые. Примерами такой боли служат головная боль напряжения, фибромиалгия, психогенная боль при соматоформных расстройствах.
ПОДХОДЫ К ТЕРАПИИ БОЛЕВЫХ СИНДРОМОВ
Большинство болей имеет смешанный характер; определение наличия того или иного компонента в структуре болевого синдрома необходимо для правильного подбора терапии.
Принципы терапии боли основаны на оценке ее интенсивности, типа (ноцицептивная, нейропатическая, дисфункциональная) и механизма развития (центральная или периферическая сенситизация, недостаточность нисходящих ингибиторных влияний, мышечный спазм, воспаление), после чего подбираются адекватные фармакологические и нефармакологические методы лечения. Методики биологической обратной связи, релаксационный тренинг, поведенческая терапия и гипноз могут быть полезными при рефрактерных к лечению болях с психогенным компонентом.
Современная медикаментозная терапия имеет в своем арсенале множество препаратов, дифференцированно применяющихся при различных типах боли (табл. 1). Поскольку очень часто болевой синдром имеет комплексный характер, перечисленные средства комбинируются между собой индивидуально для каждого пациента.
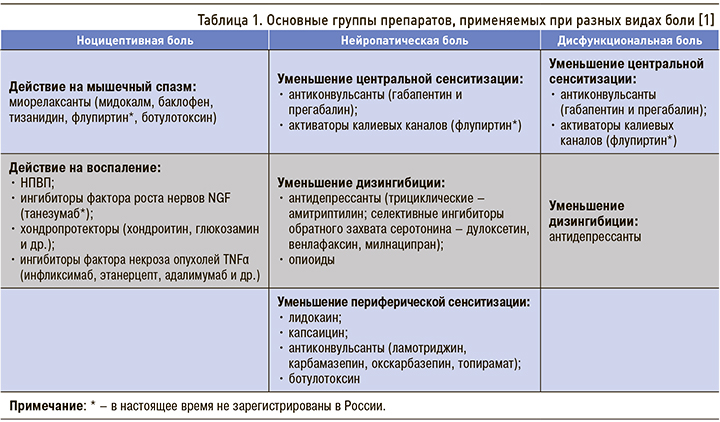
Нестероидные противовоспалительные препараты (НПВП) – одни из наиболее часто применяемых анальгетических средств. Их противоболевой эффект проявляется прежде всего в отношении ноцицептивных болей воспалительного генеза слабой и умеренной интенсивности, а также в комплексной терапии интенсивной боли. Эта группа препаратов широко назначается для купирования острого и хронического болевого синдрома, связанного с дегенеративными заболеваниями позвоночника: без нее невозможно обойтись при терапии артритов, артрозов, миотонических синдромов.
Основные терапевтические эффекты НПВП – анальгетический, противовоспалительный и жаропонижающий – основаны на снижении синтеза простагландинов из арахидоновой кислоты посредством ингибирования фермента циклооксигеназы (ЦОГ). ЦОГ существует в двух формах [3]:
- ЦОГ-1 относительно стабильно экспрессируется в большинстве типов тканей, обеспечивает нормальную функцию тромбоцитов, регулирует почечный кровоток и осуществляет цитопротекцию слизистой оболочки желудка с помощью простагландина I2 (простациклин);
- экспрессия ЦОГ-2 увеличивается в присутствии поврежденной ткани и провоспалительных медиаторов, что повышает выработку простагландинов, тромбоксана и лейкотриеновых медиаторов воспаления и боли.
Таким образом, ЦОГ-1 постоянно присутствует во всех тканях, тогда как ЦОГ-2 синтезируется на фоне воспаления. Большинство НПВП и ненаркотических анальгетиков ингибируют оба вида ЦОГ. Блокада ЦОГ-1 обусловливает ряд побочных эффектов, в первую очередь со стороны желудочно-кишечной системы, поэтому считается, что прием селективных ингибиторов ЦОГ-2 (нимесулид, мелоксикам, целекоксиб, эторикоксиб) сопряжен с более низким риском возникновения нежелательных гастроинтестинальных явлений. Однако не следует забывать, что побочные эффекты ЦОГ-2 ингибиторов зависят от дозы препарата и длительности его применения [4]. Кроме того, постоянное применение селективных НПВП имеет свои недостатки, наиболее серьезным из которых является повышение угрозы сердечно-сосудистых осложнений (усиления гипертонии и сердечно-сосудистой недостаточности); особенно это касается пожилых пациентов с соответствующей сопутствующей патологией [5]. По мере хронизации боли применение большинства НПВП становится все менее эффективным, так как в формировании болевого синдрома начинают преобладать центральные патофизиологические механизмы. Таким образом, выбор НПВП должен осуществляться индивидуально для каждого пациента с учетом возраста, сопутствующих заболеваний, длительности применения и соотношения «риск–польза».
Диклофенак – одно из наиболее широко применяемых лекарственных средств группы НПВП. Оригинальный (референтный) препарат диклофенака Вольтарен® является наиболее изученным препаратом среди всех НПВП: опубликовано более 3600 статей, посвященных изучению эффективности и безопасности Вольтарена®, в клинических исследованиях по его применению приняли участие более 200 тысяч пациентов. Вольтарен® зарегистрирован в 140 странах. Он производится в пероральной и инъекционной формах, в виде эмульгеля для наружного применения, трансдермального пластыря, а также в ректальных суппозиториях.
Особенность препарата Вольтарен® эмульгель состоит в том, что диклофенак диэтиламин содержится в нем виде эмульсии в водном геле с добавкой спиртов изопропанола и пропиленгликоля. Исследования in vitro продемонстрировали, что по своей эффективности эмульгель превосходит липогель и мазь [6]. После нанесения Вольтарена® эмульгеля на кожу активное соединение накапливается не только в мышцах в зоне аппликации, но и в синовиальной оболочке и синовиальной жидкости суставов [7].
Вольтарен® эмульгель как оригинальный препарат имеет самую большую доказательную базу среди топических форм диклофенака. Так, в 12-недельном рандомизированном двойном слепом мультицентровом исследовании H.S. Baraf et al. с участием 420 больных гонартрозом 1–3 стадии (по Kellgren–Lawrence) препарат продемонстрировал значительно более выраженное относительно плацебо уменьшение боли по шкале WOMAC, улучшение функции одного или обоих коленных суставов и хорошую переносимость независимо от степени заболевания и возраста пациентов [8].
Аналогичный результат в виде статистически достоверного превосходства над плацебо результат был получен и в идентичном по дизайну 3-месячном исследовании H.R. Barthel, посвященном использованию препарата Вольтарен® эмульгель у 492 пациентов с тем же остеоартритом коленных суставов [9].
Диклофенак более 30 лет активно используется в терапии воспалительных и дегенеративных заболеваний опорно-двигательного аппарата (суставов, связок, сухожилий, мышц), таких как ревматоидный артрит, ревматизм, анкилозирующий спондилит, хронический подагрический артрит, тендовагинит, бурсит, миалгия, невралгии, деформирующий остеоартроз, дорсалгия и т.п. Также диклофенак широко назначается при травмах, постоперационных болях, приступах мигрени, заболеваниях внутренних органов (дисменорея, аднексит, почечная и печеночная колика, инфекции лор-органов, ряд офтальмологических заболеваний).
Несмотря на всеобщую известность и длительное использование диклофенака, не все его фармакодинамические свойства до конца изучены. Основным, хорошо известным механизмом обезболивающего действия препарата служит угнетение ЦОГ, которое снижает выработку простагландина Е2 (PgE2) и тромбоксана. Вместе с тем существуют и другие, менее известные периферические и центральные механизмы действия диклофенака [10], такие как ингибирование ряда медиаторов боли, воспаления и внутриклеточных путей, позволяющих препарату оказывать влияние на хроническую боль. Недавний метаанализ (176 исследований с участием 146 524 пациентов), в котором сравнивалась эффективность различных НПВП и парацетамола у пациентов с остеоартритом, позволил сделать два основных вывода:
- парацетамол клинически не эффективен независимо от дозы;
- диклофенак в суточной дозе 150 мг более эффективен в лечении боли и физической инвалидизации, чем большие дозы ибупрофена, напроксена или целекоксиба [11].
Эти преимущества в эффективности перед другими НПВП дополнительно свидетельствуют об особенностях в механизмах действия диклофенака.
ПЕРИФЕРИЧЕСКИЙ МЕХАНИЗМ ДЕЙСТВИЯ ДИКЛОФЕНАКА
Исследования in vitro и in vivo продемонстрировали, что все НПВП ингибируют синтез простагландина и тромбоксана. При этом сообщается, что у диклофенака эффективность в подавлении уровней ЦОГ в крови и синовиальной ткани (а следовательно, и в синтезе провоспалительных и ноцицептивных простагландинов) в 3–1000 раз выше, чем у других НПВП [12, 13], и что ингибирование PgE2 коррелирует с уровнем препарата в плазме [14]. Диклофенак в 4 раза более избирателен к ЦОГ-2, чем другие НПВП, но в терапевтических концентрациях он также ингибирует 70% ЦОГ-1, что может объяснить его сбалансированный эффект в отношении неблагоприятных сердечно-сосудистых событий [15].
Первоначально считалось, что диклофенак не ингибирует напрямую фосфолипазу А2 (ФЛA2). Однако затем в некоторых исследованиях было показано, что относительно высокие дозы диклофенака ингибируют 93% внепанкреатической ФЛA2 у пациентов с острым панкреатитом [16, 17], хотя этот вывод считается спорным [18]. Установлено, что диклофенак ингибирует 90% ФЛA2 из яда змеи [19], а также угнетает ферменты дегидрогеназу и гидроксидегидрогеназу, тем самым инактивируя связанные с эйкозаноидами противовоспалительные медиаторы [20] (рис. 1).
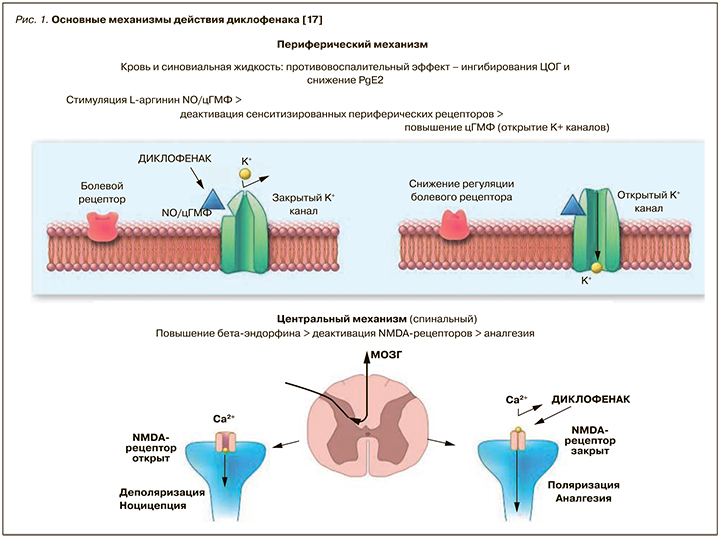
В дополнение к ингибированию ЦОГ диклофенак, по-видимому, снижает функцию сенсибилизированных периферических болевых рецепторов, стимулируя метаболический путь: l-аргинин/оксид азота (NO)/циклический гуанозина монофосфат (цГМФ) [22]. Известно, что NO-индуцированное увеличение цГМФ облегчает открытие различных ионных каналов [23, 24]. На животных продемонстрировано, что аналог цГМФ индуцирует периферическую антиноцицепцию путем активации калиевых каналов, чувствительных к аденозинтрифосфату (ATФ) [25]. Диклофенак, по-видимому, обладает тем же эффектом, что и активаторы АТФ-чувствительных калиевых каналов [26]. Диклофенак натрия может ускорять регенерацию нерва и усиливать его влияние на заживление, но может вызывать и отрицательный эффект, воздействуя на развивающиеся нервы при невропатической боли после травмы, и приводить к дисфункции периферической нервной системы [27]. Еще один отрицательный момент – тератогенные свойства диклофенака натрия, за счет которых он может менять толщину миелиновой оболочки и структуру аксонов. Таким образом, возможные преимущества и ограничения препарата до сих пор до конца неизвестны (рис. 2).
ЦЕНТРАЛЬНЫЙ МЕХАНИЗМ ДЕЙСТВИЯ ДИКЛОФЕНАКА
Обнаружено [28], что пероральный прием диклофенака гораздо более эффективен, чем местное нанесение (концентрации в ткани в месте повреждения были одинаковыми). Учитывая незначительность системного распространения препарата при местном применении, сделан вывод, что в антиноцицептивный эффект пероральной формы включает центральный компонент действия.
Результаты целого ряда исследований на животных и людях позволяют предположить, что диклофенак может прямо или косвенно воздействовать на ЦНС разными путями [29]:
- инъекции диклофенака в дозе 1–10 нг в разные области мозга мыши дозозависимо снижают уровни этакриновой кислоты, у крыс центральные антиноцицептивные эффекты диклофенака могут быть частично нивелированы антагонистом опиоидных рецепторов налоксоном [30];
- внутрибрюшинное введение диклофенака снижает концентрацию β-эндорфина гипофиза (эндогенного опиоида) у крыс в течение 30 мин [31], и это связано с увеличением уровня β-эндорфина в плазме (подтверждение вовлечения центральных опиоидных путей);
- диклофенак повышает концентрацию β-эндорфина в плазме у людей, не страдающих от боли [32];
- диклофенак является антагонистом NMDA-рецепторов [10], которые участвуют в передаче ноцицептивных импульсов в спинном мозге. В ряде экспериментов на мышах показано, что диклофенак ослабляет опосредованную NMDA-рецепторами гипералгезию через l-аргинин/NO/cGMP метаболический путь [33], выступает селективным и конкурентным ингибитором NMDA-рецепторов в мышцах [34] и заметно повышает концентрацию кинуреновой кислоты в спинном и промежуточном мозге.
Роль центральных механизмов в формировании хронических болей при остеоартрите, ревматоидном артрите и других заболеваниях опорно-двигательного аппарата была неоднократно подтверждена и описана. Доказательством центрального механизма таких болей служит эффективность применения антидепрессантов (дулоксетина, амитриптилина и др.), изменяющих метаболизм болевых нейротрансмиттеров [35]. То, что НПВП, включая диклофенак, могут действовать через этот путь, безусловно, следует рассматривать как важный факт, открывающий новые возможности применения этой группы препаратов.
НОВЫЕ МЕХАНИЗМЫ ДЕЙСТВИЯ ДИКЛОФЕНАКА
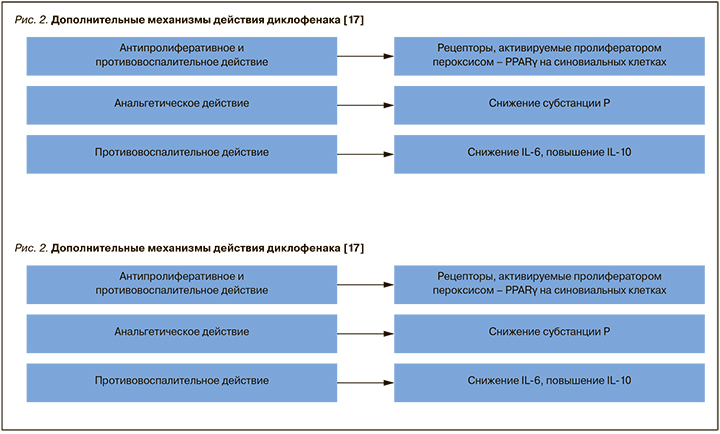
PPARγ – это рецепторы, активируемые пероксисомными пролифераторами, которые контролируют дифференцировку адипоцитов и макрофагов, играют роль в подавлении пролиферации опухолевых клеток и вовлекаются в воспалительные процессы и метаболизм жирных кислот. Сообщается, что сродство диклофенака к PPARγ в 50 раз выше, чем у других НПВП, и что, активируя эти рецепторы и ингибируя синтез простагландина, диклофенак действует на спинальные ноцицептивные процессы [10, 36].
Известно, что у пациентов с ревматоидным артритом синовит связан с активацией микроглии и астроцитов спинного мозга, а также изменением метаболизма нейротрансмиттеров (γ-аминомасляной кислоты – GABA, субстанции P, кальцитонин-ген-связанного пептида – CGRP) и их рецепторов в спинном мозге [37], которые активируют выработку провоспалительных цитокинов (фактора некроза опухоли альфа – TFNα, интерлейкина-1– IL-1 и интерлейкина-6 – IL-6) и облегчают передачу боли [38]. Передача болевых импульсов может быть дополнительно увеличена за счет повышения нисходящей активации и уменьшения нисходящего торможения, а центральная сенсибилизация влияет не только на нервы воспаленного сустава, но и снижает болевые пороги в соседних тканях [39], поскольку сенсорные нервы находятся в суставных капсулах, связках, наружных частях менисков, субхондральной кости, сухожильных влагалищах и мышцах.
Диклофенак может быть полезен в случае вышеописанной хронической нейровоспалительной боли, поскольку стимуляция PPARγ подавляет активацию микроглии [40]. У больных ревматоидным артритом диклофенак повышает активность PPARγ в синовиальных клетках и уменьшает пролиферацию клеток за счет снижения жизнеспособности и индукции апоптоза [41]. Также выявлено, что лиганды PPARγ оказывают противовоспалительное действие, блокируя активацию ядерного фактора каппа-би активированных B-клеток (NF-κB) и белка активации 1 (AP1), и могут связываться со специфическими последовательностями в промоторных элементах генов воспалительного ответа [42, 43]. Наконец, на модели макрофагов продемонстрировано, что диклофенак через PPARγ метаболический путь индуцирует высвобождение ряда противовоспалительных цитокинов, включая интерлейкин-10 (IL-10) и трансформирующий фактор роста-β (TGF-β) [44] (рис. 3).
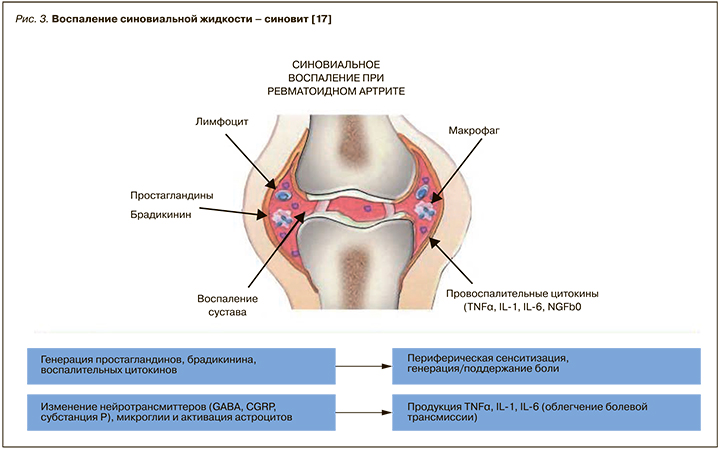
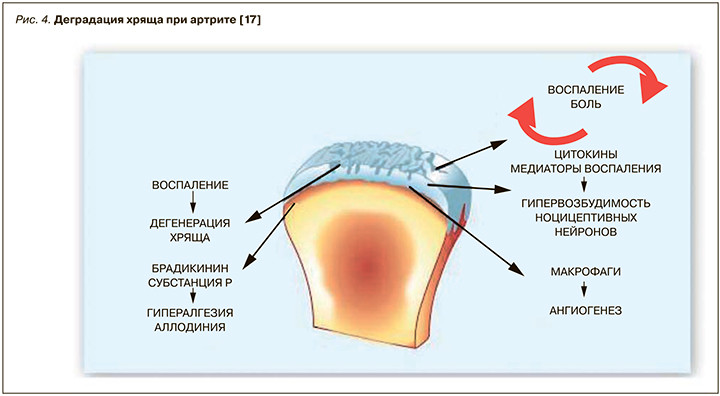
Известно, что в плазме и синовиальной жидкости пациентов с артритом обнаруживается субстанция P – провоспалительный нейропептид, ассоциированный с различными воспалительными заболеваниями [45]. Предполагается, что, поскольку НПВП используются для лечения боли, связанной с артритом, они могут также влиять на хемотаксическое действие субстанции P на моноциты и полиморфноядерные (PMN) клетки, что является критическим этапом при заболевании артритом. Исследование пациентов с ревматоидным артритом показало, что диклофенак натрия 50 мг и напроксен 250 мг при приеме 3 раза/сут в течение 7 дней значительно снижают уровни субстанции P в синовиальной жидкости [10]. Таким образом, обезболивающий эффект диклофенака может быть хотя бы частично обусловлен ингибированием лейкотриенового метаболического пути, вызванного истощением субстанции P (рис. 4). Эти данные свидетельствуют, что диклофенак может оказывать влияние на субстанцию Р, которая играет важную роль в ЦНС, сенсибилизируя спинномозговые нейроны, вызывая расширение сосудов, снижая ноцицептивные пороги и способствуя нейрогенному воспалению в периферической нервной системе.
Первоначальное воспаление включает очень большое количество цитокинов: высвобождение IL-6 регулируется простагландинами, а его экспрессия, равно как и экспрессия других провоспалительных цитокинов, подавляется IL-10. НПВП могут снижать уровни провоспалительных цитокинов с помощью независимого от простагландина механизма, поскольку экспрессия и продукция IL-6 подавляются кетопрофеном, индометацином и диклофенаком независимо от выработки PgE2 Т-клетками человека [46], и диклофенак полностью блокирует синтез PgE2 в хондроцитах человека [47]. Пациенты, получавшие диклофенак в течение 12 ч после операции, имели значительно более низкий уровень IL-6 и значительно более высокий уровень IL-10 по сравнению с группой плацебо [48]. У пациентов с ревматоидным артритом уровень IL-6 в плазме и синовиальной жидкости значительно снижался к 7-му дню лечения диклофенаком [49], а у больных остеоартритом – к 180-му дню терапии [50].
Известно, что тканевой ацидоз возбуждает ноцицептивные сенсорные нейроны через чувствительные к кислоте ионные каналы (ASIC) и тем самым способствует ощущению боли. Определено, что диклофенак и ибупрофен селективно ингибируют ASIC3 и ASIC1a в линии обезьяньих клеток, трансформированных вирусом 40 обезьян (клетки COS), и то, что они предотвращают индуцированную воспалением экспрессию ASIC в сенсорных нейронах [51]. Также оба лекарственных средства ингибируют протон-индуцированные токи в интернейронах гиппокампа крыс [52], а местное применение диклофенака уменьшает вызванную кислотой боль у людей, вероятно, через ослабление активности ASIC [53].
ЗАКЛЮЧЕНИЕ
Таким образом, влияние диклофенака на воспалительные и болевые процессы многогранно. По мере изучения этого лекарственного средства открываются новые перспективы его использования, требующие дальнейших исследований.
Механизмы действия диклофенака делают его особенно эффективным при лечении ноцицептивной боли и хронической центральной боли. При этом такие фармакодинамические особенности диклофенака, как активация рецепторов PPARγ и высвобождение противовоспалительных цитокинов, снижение вещества P и повышение β-эндорфина, действие на NMDA-рецепторы и ASIC3 ионные каналы, служат основанием для рассмотрения возможностей его применения и в других сферах, например, при невропатической боли, центральной сенситизации и центральной боли, поскольку препарат способен улучшать качество жизни этих групп пациентов. Некоторые механизмы действия диклофенака представляют интерес и в онкологическом контексте, в связи с чем ведутся исследования по его применению против болей, связанных со злокачественными новообразованиями [54].


