К основным формам иммуновоспалительных ревматических заболеваний (ИВРЗ) относятся ревматоидный артрит (РА), спондилоартриты (СпА), системная красная волчанка (СКВ), системная склеродермия (ССД), системные васкулиты (СВ), связанные с синтезом антинейтрофильных цитоплазматических антител (АНЦА), синдром/болезнь Шегрена (СШ), идиопатические воспалительные миопатии (ИВМ) и некоторые другие. Расшифровка механизмов патогенеза этих заболеваний, расширение возможностей их ранней диагностики, разработка стратегии фармакотерапии (лечение до достижения цели – Treat To Target) в сочетании с разработкой широкого спектра инновационных противовоспалительных и иммуномодулирующих лекарственных препаратов (генно-инженерных биологических препаратов и химически синтезированных ингибиторов сигнальных молекул) относятся к крупным достижениям медицины XXI в. [1–4].
Наиболее распространенной и яркой формой ИВРЗ является РА, который характеризуется хроническим системным и локальным воспалением, вызывающим прогрессирующую деструкцию суставов, поражение внутренних органов и развитие коморбидной патологии (атеросклеротическое поражение сосудов, остеопороз, интерстициальное заболевание легких и др.), нередко определяющей прогноз заболевания [5, 6]. Этиология РА неизвестна, а патогенетические механизмы хронизации воспаления определяются сложным взаимодействием внешнесредовых и генетических факторов, ведущих к глобальной дисрегуляции механизмов врожденного и приобретенного иммунитета, которые развиваются задолго до клинической манифестации болезни [6, 7].
ИНГИБИТОРЫ ФАКТОРА НЕКРОЗА ОПУХОЛИ АЛЬФА
Среди генно-инженерных биологических препаратов (ГИБП), применяемых для лечения РА и других ИВРЗ (в первую очередь анкилозирующего спондилита и псориатического артрита), видное место занимают ингибиторы фактора некроза опухоли альфа (ФНО-α) [8, 9]. Эффективность этой группы средств (табл. 1) определяется универсальной ролью ФНО-α в иммунопатогенезе ИВРЗ и связана с подавлением активации «иммунных» клеток, синтеза «провоспалительных» медиаторов, матриксных металлопротеиназ, ангиогенеза, лимфоангиогенеза, остеокласт-опосредованной костной резорбции и др. [10]. В то же время необходимо принимать во внимание и важные «физиологические» функции ФНО-α, такие как защита от экзогенных и эндогенных патогенов, иммунорегуляция, регенерация тканей и др. Поэтому ингибирование ФНО-α может приводить к развитию нежелательных лекарственных реакций: инфекционных осложнений (в том числе оппортунистических инфекций), реактивации туберкулезной инфекции, индукции аутоиммунных реакций (волчаночноподобный синдром, демиенилизация, псориаз, саркоидоз), увеличению риска злокачественных новообразований, в первую очередь лимфопролиферативных опухолей [11]. Рациональная стратегия, направленная на повышение эффективности фармакотерапии ингибиторами ФНО-α (как и другими ГИБП), по крайней мере при РА, построена на их комбинации с метотрексатом (МТ). Последний обладает синергическими механизмами действия с ГИБП [12] и подавляет их иммуногенность (синтез антилекарственных антител) [13].

ИНГИБИТОРЫ РЕЦЕПТОРОВ ИНТЕРЛЕЙКИНА-6
В спектре цитокинов, принимающих участие в патогенезе ИВРЗ, важную роль играет интерлейкин-6 (ИЛ-6), который функционирует как аутокринный, паракринный и «гормоноподобный» «регулятор» разнообразных «нормальных» и «патологических» «иммуновоспалительных» процессов – острофазового ответа (синтеза белков острой фазы воспаления, лихорадка), врожденного и приобретенного иммунитета, гемопоэза, неоангиогенеза, ремоделирования костной ткани, функции нейроэндокринной системы и др. [14, 15]. Плейотропные биологические эффекты ИЛ-6 определяются уникальной сигнальной системой, включающей ИЛ-6-рецепторы (Р) и «нисходящие» (dowmstream) сигнальные молекулы – JAK-STAT (Janus kinases-Signal transducer and activator of transcription proteins), которые регулируют экспрессию генов широкого спектра цитокинов. ИЛ-6-Р состоит из 2 цепей: ИЛ-6-связывающая цепи (ИЛ-6-Рα) и трансмембранного белеп gp130 (130 kDa glycoprotein) (ИЛ-6-Рβ), который служит сигнальным рецептором. мИЛ6-Рα экспрессируется только на некоторых клетках (макрофаги, нейтрофилы, Т-клетки и др.), в то время как gp130 (ИЛ-6-Рβ) присутствует практически на всех клетках организма человека. В кровяном русле и тканях присутствует растворимая (р) форма ИЛ-6-Рα, которая предохраняет ИЛ-6 от ферментного расщепления, увеличивает продолжительность его жизни в сыворотке и в комплексе с ИЛ-6 обладает способностью связываться с gp130 и вызывать активацию клеток, не экспрессирующих мИЛ-6-Рα. Этот процесс получил название «транссигнализация», тогда как активация клеток, опо-средованная взаимодействием ИЛ-6 с мИЛ-6-Р, определяется как «классическая» сигнализация. Предполагается, что «транссигнализация» в большей степени, чем «классическая» сигнализация, детерминирует «патогенные» эффекты ИЛ-6.
Недавно был охарактеризован новый механизм действия ИЛ-6 – «транспрезентация» (transpresentation). Суть его заключается в том, что ИЛ-6 в начале связывается с ИЛ-6-Р, присутствующими в цитоплазме дендритных клеток, затем комплекс ИЛ-6-ИЛ6-Р транспортируется на клеточную мембрану и, взаимодействуя с мембранным gp130 близко расположенных Т-клеток, индуцирует их поляризацию в направление формирования «патогенных» Th17-клеток.
Внедрение в клиническую практику в 2010 г. гуманизированного моноклонального антитела (мАТ) к ИЛ-6-Р тоцилизумаба (ТЦЗ) [16, 17], а в 2014 г. – полностью человеческого мАТ сарилумаба (САР) [18, 19], которые блокируют все три пути ИЛ-6-зависимой клеточной сигнализации [14], стало важным этапом на пути совершенствования терапии РА и других ИВРЗ, определяемых как «ИЛ-6-зависимые» болезни человека. ТЦЗ – первый ингибитор ИЛ-6-Р (табл. 2), зарегистрированный для лечения РА и системного варианта ювенильного идиопатического артрита (ЮИА) [16]. При различных клинических субтипах РА ТЦЗ не уступает по эффективности другим ГИБП, его применение позволяет преодолеть резистентность к ингибиторам ФНО-α. К достоинствам ТЦЗ следует отнести более высокую эффективность при монотерапии по сравнению с ингибиторами ФНО-α. Наряду с РА доказана высокая эффективность ТЦЗ при системных васкулитах с преимущественным поражением крупных артерий – гигантоклеточном артериите (в сочетании с ревматической полимиалгией; исследования GiACTA) [20, 21] и артериите Такаясу [22].

Новым представителем класса ингибиторов ИЛ-6-Р является САР: характеристика основных рандомизированных контролируемых клинических исследований (РКИ) этого препарата при РА суммирована в таблице 3. Установлена более высокая эффективность САР при РА, резистентном к терапии МТ [23], другими базисными противовоспалительными препаратами (БПВП) и ингибиторами ФНО-α [24] как по сравнению с плацебо, так и адалимумабом (АДА) [25]. Примечательно, что «переключение» с ТЦЗ на САР у пациентов с недостаточной эффективностью ТЦЗ позволяет преодолеть резистентность к терапии [26, 27].
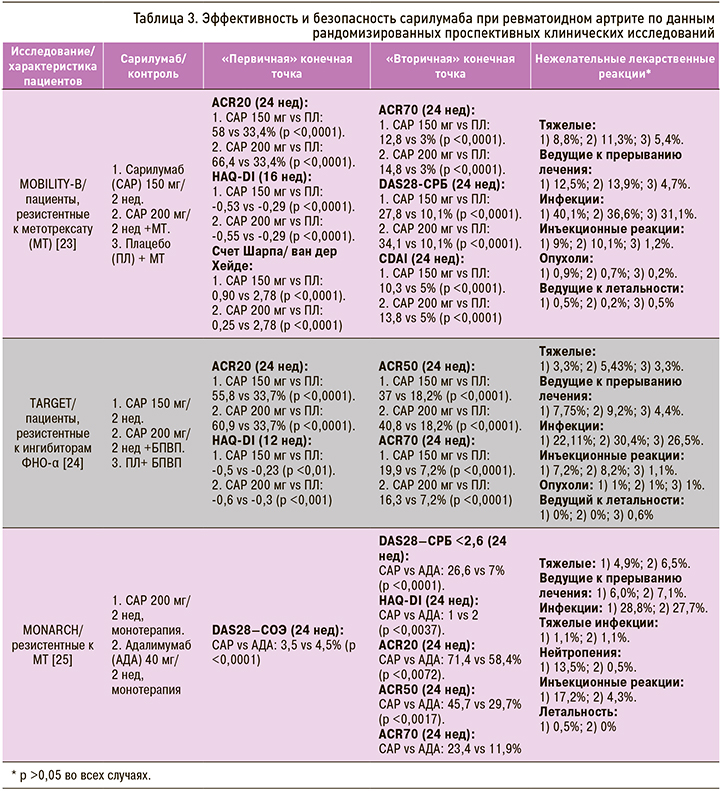
В многоцентровое рандомизированное проспективное клиническое исследование (РПКИ) MOBILITY (The MOnoclonal antiDody to IL-6Rα In RA: a pivotal Trial with X-ray), в которое было включено 1285 пациентов, имевших активный РА, несмотря на лечение МТ, вошли в том числе более 150 пациентов, наблюдавшихся в российских центрах [28]. По нашим данным, у пациентов с активным РА лечение САР в комбинации с МТ приводит к снижению активности воспаления, улучшения качества жизни, замедлению прогрессирования деструкции суставов. В настоящее время наряду со стандартными параметрами эффективности противовоспалительной терапии РА (индексы активности, динамика прогрессирования деструкции суставов и др.) особое внимание привлекают такие показатели, как выраженность боли, усталости, нарушения сна, общего самочувствия, настроение и др., которые определяются как «состояния здоровья по мнению пациента» (patient-reported outcome – PRO) [29, 30]. Эти «субъективные» симптомы обладают значительным негативным эффектом в отношении физического и психологического здоровья пациентов [31], но не всегда коррелируют с лабораторными (и даже клиническими) биомаркерами активности воспаления, а также мнением врача о состоянии больного и эффективности терапии. Это во многом затрудняет реализацию стратегии терапии РА Treat To Target [32]. Участие ИЛ-6 в регуляции функции центральной нервной системы и эндокринной системы (ось гипоталамус–гипофиз–надпочечник) свидетельствует о потенциальной патогенетической роли этого цитокина в развитии клинических симптомов (боль, усталость, депрессия и др.), являющихся основными компонентами PRO при РА [33–36]. В серии исследований было показано, что лечение САР ассоциируется с клинически значимой положительной динамика индекса HAQ-DI (≥0,3), показателей качества жизни, связанного со здоровьем (Health Related Quality of Life – HRQL) и общего состояния по мнению пациента (patient global assessment – PtGA) [19, 37]. Также выяснилось, что САР эффективней АДА в отношении динамики HAQ-DI, «физического» компонента SF-36 и индекса RAID (rheumatoid arthritis impact of disease) [38], который представляет собой композитный индекс, отражающий основные компоненты PRO [39]. Результаты метаанализов РПКИ [40, 41] свидетельствуют о сходной или более высокой эффективности лечения САР по сравнению с другими ГИБП, а монотерапия САР эффективней монотерапии АДА и ингибитором янус-киназ тофацитинибом.
РИТУКСИМАБ, ИНГИБИТОРЫ ИНТЕРЛЕЙКИНОВ-1, -17, -12/23
Гиперпродукция «патогенных» аутоантител – наиболее характерное проявление ИВРЗ [42]. Они могут индуцировать иммунокомплексное воспаление, вызывать разрушение клеток-мишеней или модулировать сигнальные пути, регулирующие функциональную активность клеток. Поэтому В-клетки рассматриваются как перспективная «мишень» фармакотерапии ИВРЗ [43, 44]. В настоящее время разработаны моноклональные антитела (мАТ) к CD20 и другим В-клеточным белкам (CD19 и CD22), антитела, блокирующие активность цитокинов, регулирующих выживание и функцию В-клеток (BAFF/APRILL – B cell activating factor/a proliferation-inducing ligand).
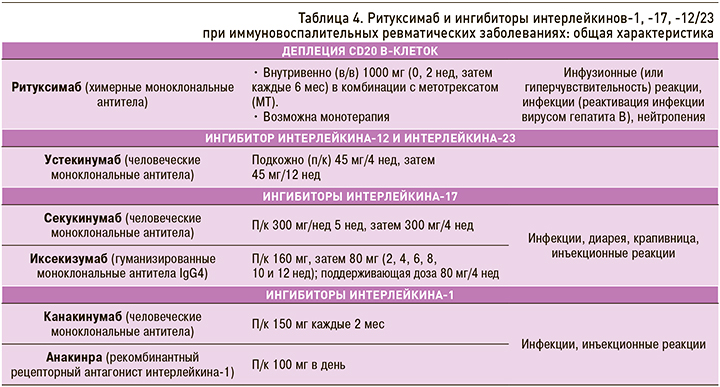
Подавляющее большинство исследований, касающихся эффективности и безопасности анти-В-клеточной терапии при ИВРЗ, связано с изучением ритуксимаба (РТМ) – химерного моноклонального антитела к CD20 антигену В-клеток, который официально зарегистрирован для лечения РА, АНЦА-СВ, вульгарной пузырчатки. Также он широко используется по незарегистрированным показаниям (off label) для лечения таких аутоиммунных ИВРЗ, как СКВ, ССД, СШ, ИВМ, криоглобулинемический васкулит и др. [45, 46]. В настоящее время РТМ рассматривается как эффективный препарат [43, 47, 48], включенный в международные [49] и российские рекомендации [50] по лечению РА.
Другими важными В-клеточными «мишенями» служат цитокины BAFF/APRIL (B cell activating factor/a proliferation-inducing ligand), которые рассматриваются как значимый компонент регуляции функции, пролиферации и дифференцировки В-клеток. Эффективность мАТ к BAFF – белимумаба (БЛМ) – при СКВ доказана в многочисленных исследованиях [51–53], послуживших основанием для его включения в клинические рекомендации по лечению этого заболевания [50, 54].
По современным представлениям, ИВРЗ, в зависимости от преобладающих механизмов активации иммунитета, разделяются на 2 основные категории: аутоиммунные и аутовоспалительные [55]. Впрочем, для них характерен «перекрещивающийся» спектр клинических проявлений, «триггерных» внешнесредовых, эпигенетических и генетических факторов, медиаторов воспаления, а также общие подходы к фармакотерапии [56]. Предполагается, что гиперпродукция «провоспалительного» цитокина ИЛ-1 во многом определяет «перекрест» между аутоиммунитетом и аутовоспалением, характерный для многих ИВРЗ [57–59].
ИЛ-1β – плеотропный «провоспалительный» цитокин, который индуцирует синтез других «провоспалительных» цитокинов (ФНО-α, ИЛ-6 и др.), хемокинов, низкомолекулярных медиаторов воспаления, стимулирует гранулопоэз, участвует в регуляции Th1- и Th17-типов иммунного ответа, обладает деструктивными и катаболическими эффектами, стимулирует дифференцировку остеокластов из мононуклеарных клеток-предшественников, вызывающих костную резорбцию. Гиперпродукция ИЛ1-β индуцирует лихорадку, развитие «воспалительной» и «нейропатической» боли, анорексии, депрессии и др. [55]. Его биологически активная форма представляет собой белок с молекулярной массой 17 kD и образуется из крупного (31 kD) биологически неактивного предшественника – про-ИЛ-1β. Расщепление про-ИЛ-1β реализуется главным образом в моноцитах и макрофагах и связана с активацией NLRP3 (nucleotide-binding domain, leucine-rich-containing family, pyrin domain-containing-3 или Nod-like receptor protein 3) инфламмасомы, которая катализирует конверcию фермента про-каспазы 1 в каспазу 1 (ИЛ-1-конвертирующий фермент), в свою очередь регулирующую образование ИЛ-1β (а также другого «провоспалительного» цитокина – ИЛ-18) из соответствующих предшественников [60]. Мутация гена NLRP3 инфламмасомы лежит в основе большой группы моногенных аутовоспалительных заболеваний, которые развиваются в раннем детском возрасте и характеризуются рецидивирующими атаками системного воспаления, проявляющегося поражением суставов, кожи, гиперпродукцией «острофазовых» белков в сыворотке, развитием амилоидоза.
Большое внимание привлекает роль ИЛ-1β в патогенезе системного ЮИА, болезни Стилла взрослых, подагрического артрита и многих других патологий, которые рассматриваются как спорадические (полигенные) аутовоспалительные заболевания. Например, имеются данные о том, что при подагрическом артрите кристаллы моноурата натрия (МУН) служат мощными индукторами синтеза ИЛ-1β за счет активации NLRP3 инфламмасомы. В настоящее время разработано несколько ингибиторов ИЛ-1β, в том числе мАТ к ИЛ-1β канакинумаб, который зарегистрирован для лечения криопирин-ассоциированных периодических синдромов, семейной средиземноморской лихорадки, болезни Стилла взрослых, системного ЮИА, подагрического артрита. По незарегистрированным показаниям он применяется при широком круге заболеваний, связанных с гиперпродукцией ИЛ-1 [60]. Материалы РПКИ CANTOS (Canakinumab ANti-inflammatory Thrombosis Otcomes Study), продемонстрировавшие эффективность терапии канакинумабом в отношении вторичной профилактики кардиоваскулярных осложнений в общей популяции больных с тяжелым атеросклеротическим поражением сосудов [61], свидетельствуют о хороших перспективах применения ингибиторов ИЛ-1 в лечении ИВРЗ с кардиоваскулярной коморбидностью [62].
Патологическая активация и экспансия Th17-клеток, синтезирующих «провоспалительные» цитокины ИЛ-17А→ИЛ-17F, играет ведущую роль в развитии РА и многих других ИВРЗ [63, 64]. Это стало стимулом для разработки ГИБП, действие которых основано на блокировании ИЛ-17 и других цитокинов (ИЛ-23, ИЛ-22 и др.), связанных с активацией Th17-клеток. Однако материалы клинических исследований свидетельствует об умеренной эффективности мАТ к ИЛ-17 при РА [65], что контрастирует с выраженным положительным действием этих препаратов при других ИВРЗ – псориатическом артрите, анкилозирующем спондилите, а также псориазе [66–68]. Полагают, что это связано с тем, что активация оси ИЛ17/ИЛ23 имеет патогенетическое значение в первую очередь на самых ранних стадиях РА, а именно в период формирования «провоспалительного» потенциала антител к цитруллинированным белкам (АЦБ) [69]. Истинное место ингибирования цитокинов оси ИЛ17/ИЛ23 при РА требует дальнейшего изучения.
Общие характеристики ритуксимаба и ингибиторов ИЛ-1, ИЛ-17, ИЛ-12/23 приведены в таблице 4.
ИНГИБИТОРЫ «СИГНАЛЬНЫХ» МОЛЕКУЛ
Новое направление в лечении РА и других ИВРЗ связано с разработкой низкомолекулярных химически синтезированных препаратов, ингибирующих внутриклеточные «сигнальные» молекулы янус-киназы (JAK, табл. 5) – так называемые Якинибы (Jakinibs) [70, 71]. На молекулярном уровне иммуномодулирующие и противовоспалительные эффекты ингибиторов JAK реализуются за счет уникального механизма – обратимого ингибирования сигнализации широкого спектра цитокинов и факторов роста, являющихся важнейшими «регуляторами» иммунитета и гемопоэза, которые взаимодействуют с клеточными мембранными рецепторами (типа I и II), ассоциированными с молекулами сигнального пути JAK-STAT.

В зависимости от селективности к различным изоформам JAK (JAK1, JAK2, JAK3, TYK2), ингибиторы JAK подразделяются на неселективные (пан) и селективные ингибиторы JAK. Ключевая фармакологическая характеристика ингибиторов JAK – обратимость ингибиции этих ферментов, что определяет быстрое развитие и прекращение противовоспалительного и иммуномодулирующего эффектов в процессе лечения.
Тофацитиниб (ТОФА) – первый ингибитор JAK: он блокирует преимущественно JAK1 и JAK3, в меньшей степени JAK2, классифицируется как «таргетный» синтетический БПВП [72, 73].
В многочисленных РКИ было показано, что ТОФА эффективен при раннем и развернутом РА в комбинации с МТ и в виде монотерапии. Он не уступает по эффективности АДА, позволяет преодолеть резистентность к одному или нескольким ГИБП, замедляет прогрессирование деструкции суставов, а его безопасность сходна с таковой у ГИБП [72, 73]. Завершены РКИ фазы III, свидетельствующие об эффективности ТОФА у пациентов с псориатическим артритом, резистентных к БПВП и ингибиторам ФНО-α [74]. ТОФА официально зарегистрирован для лечения псориатического артрита и включен в клинические рекомендации ACR (American College of Rheumatology) по фармакотерапии этого заболевания [75]. Предварительные результаты свидетельствуют об эффективности ТОФА при анкилозирующем спондилите [71], особенно у пациентов с активным воспалением позвоночника (по данным МРТ) и высоким уровнем С-реактивного белка (СРБ).
Недавно для лечения РА был зарегистрирован новый ингибитор JAK – барицитиниб (БАРИ), преимущественно блокирующий JAK1 и JAK2. Этот препарат эффективен у пациентов, резистентных к МТ, другим БПВП и ГИБП [76], и превосходит монотерапию АДА. Примечательно, что снижение дозы БАРИ (с 4 до 2 мг в сутки) после достижения ремиссии не приводит к обострению РА [77]. Все это в перспективе может иметь принципиально важное значение для совершенствования стратегии лечения РА после достижения ремиссии.
Наряду с аутовоспалительными заболеваниями, связанными с гиперпродукцией ИЛ-1β, выделяют субтипы этой патологии, определяемые как интерферонопатии типа I [78, 79]. Напомним, что интерфероны (ИФН) типа I (ИФНα и ИФНβ) относятся к «провоспалительным» цитокинам, обладающим противовирусной активностью, многообразными гематологическими и иммунными эффектами и имеющим большое патогенетическое значение в развитии ИВРЗ, в первую очередь СКВ [80]. После связывания с гетеродимерным рецептором IFNAR (interferon-α/β receptor) сигнализация этих цитокинов опосредуется JAK1/TYK2. В недавних исследованиях была продемонстрирована эффективность БАРИ у пациентов с 3 формами моногенных интерферонопатий типа I – синдромами CANDLE (chronic atypical neutrophilic dermatosis with lipodystrophy and elevated temperature), SAVI (stimulator of IFN genes-associated [STING associated] vasculopathy) и Aicardi Goutieres. При этом ТОФА показал свою эффективность при другом типе интерферонопатий – семейной ознобленной (chilblain) волчанке, связанной с гетерозиготной мутацией белка STING (Stimulator of interferon genes), а также синдроме SAVI [79].
Несомненный интерес вызывает изучение роли ИФН типа I в патогенезе классических аутоиммунных ИВРЗ, некоторые из которых предварительно классифицируются как спорадические интерферонопатии типа I [81]. К ним относятся СКВ, ИВМ (дерматомиозит), системные васкулиты (включая гигантоклеточный артериит), СШ, ССД. Все они могут рассматриваться как перспективные терапевтические «мишени» для фармакотерапии ингибиторами JAK. По данным РКИ (фаза II), у больных СКВ на фоне лечения БАРИ отмечена положительная динамика поражения кожи и/или артрита у 67, 58 и 53% соответственно (р=0,04 при приеме БАРИ 4 мг/сут по сравнению с плацебо). Клинический эффект по индексу SRI-4, BILAG (British Isles Lupus Assessment Group) А и В и общей оценки состояния пациента врачом (Physician's Global Assessment) был достоверно выше на фоне БАРИ (64%), чем в группе плацебо (48%) (р=0,02). Уменьшение числа болезненных суставов было опять же более выражено на фоне БАРИ (-6,9) по сравнению с плацебо (-5,6) (р=0,04) [82].
В настоящее время активно разрабатываться несколько ингибиторов JAK «второго поколения», основным отличием которых от ТОФА и БАРИ (пан-ингибиторов JAK) является селективность в отношении определенных изоформ JAK. Создание ингибиторов JAK, блокирующих активацию только одной изоформы JAK, потенциально может способствовать снижению риска нежелательных лекарственных реакций. Например, селективные ингибиторы JAK1 могут вызывать более выраженную блокаду ИЛ-6, который, как уже отмечалось, играет важную роль в патогенезе РА и широкого спектра ИВЗ, не вызывая при этом гематологические нарушения (цитопении), связанные с подавлением синтеза «гемопоэтических» цитокинов, ассоциирующихся с JAK2. Следует подчеркнуть, что ингибиторы JAK1 (селективные и неселективные) наряду с мАТ к ИЛ-6 исследователи склонны рассматривать в контексте «анти-ИЛ-6 терапии» [19].
TYK2 участвует в сигнализации относительно небольшой группы цитокинов: ИЛ-12, ИЛ-23 и ИФН типа I и II. Однако, поскольку, как уже отмечалось, ИЛ-12 и ИЛ-23 (а также ИЛ-17, синтез которого регулируется ИЛ-23) играют важнейшую роль в иммунопатогенезе псориатического артрита и анкилозирующего спондилита, а мАТ к этим цитокинам с успехом используются для лечения ИВРЗ [2, 68], возможности селективной блокады TYK2 представляют повышенный интерес. Предварительные результаты свидетельствуют об эффективности ингибитора TYK2 – BMS-986165 – при псориазе [83]. В настоящее время это препарат проходит клинические испытания при псориатическом артрите и СКВ.
Таким образом, ингибиторы JAK – новый класс быстро действующих антивоспалительных и иммуномодулирующих таблетированных препаратов, эффективных при широком круге ИВРЗ. Эти препараты обладают уникальным механизмом действия, связанным с обратимым подавлением сигнализации широкого спектра патогенетически значимых «провоспалительных» цитокинов, который может обеспечивает быстрый и стабильный эффект при различных фенотипах и эндотипах ИВРЗ, за счет влияния на разнообразные патогенетические механизмы, лежащие в основе развития этих заболеваний.
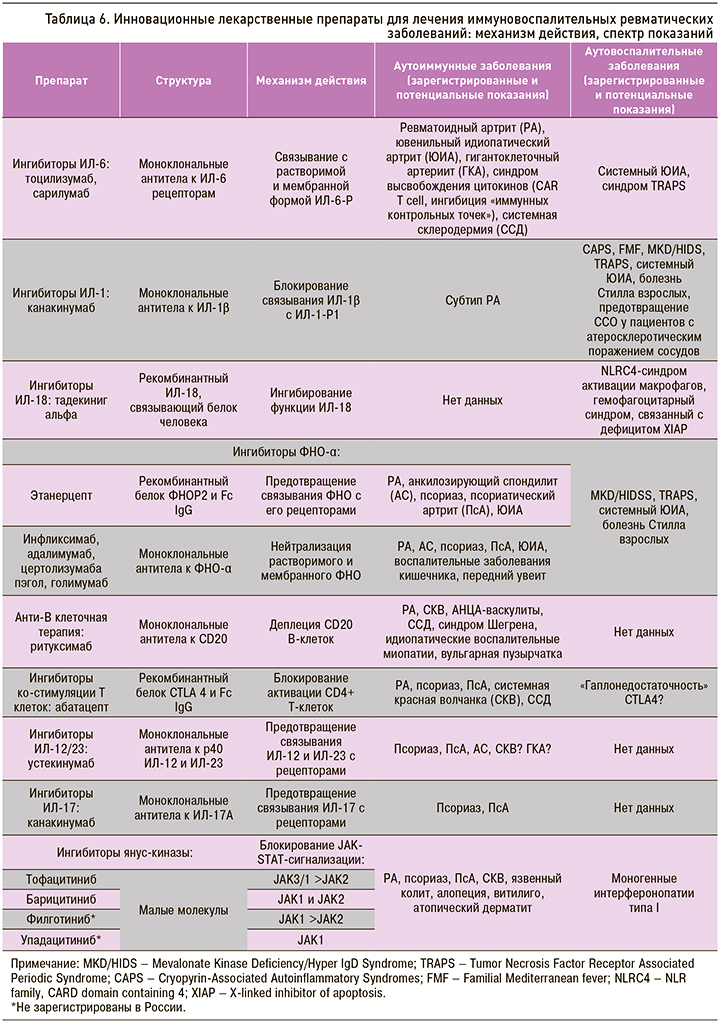
Расшифровка механизмов патогенеза ИВРЗ создало предпосылки для разработки и совершенствования персонифицированной терапии (табл. 6), что в будущем должно привести к кардинальному улучшению прогноза при этих заболеваниях.