Артериальная гипертония (АГ) во время беременности – одно из самых распространенных патологических состояний, способствующих развитию тяжелых и нередко фатальных осложнений как со стороны матери, так и со стороны плода и новорожденного. По данным обсервационного наблюдательного исследования – регистра беременных БЕРЕГ, в реальной клинической практике России различные варианты АГ регистрировались в 14% случаев, что сопоставимо с данными Западной Европы [1, 2]. Необходимо подчеркнуть, что АГ, существующая до беременности (хроническая АГ – ХАГ), нередко сочетается с метаболическими нарушениями – ожирением и сахарным диабетом (СД), частота которых неуклонно возрастает во всем мире. С учетом такой коморбидности эти пациентки требуют комплексного подхода к выбору тактики их ведения не только в период гестации, родов и раннего послеродового периода, но и в дальнейшей их жизни.
Исследователи отмечают, что у женщин с АГ во время беременности в последующем чаще, чем у женщин с нормальным артериальным давлением (АД), выявляются признаки метаболического синдрома: сохраняется АГ, появляются изменения углеводного, липидного обменов, абдоминальное ожирение, инсулинорезистентность, гиперинсулинемия, а также дисбаланс адипокинов, изменения показателей фибринолиза и раньше поражаются органы-мишени – сердце и сосуды [3]. Все это не только свидетельствует о необходимости своевременного выявления гипертензивных состояний у женщин репродуктивного возраста, включая беременных, с целью назначения им адекватной антигипертензивной терапии (АГТ), но и определяет тактику длительного диспансерного наблюдения пациенток, у которых в период гестации была АГ.
Вопрос назначения АГТ у беременных сложный, так как мы лечим двух пациентов – женщину и плод, а значит, обязаны учитывать множество факторов: сроки беременности, уровень АД, наличие коморбидных состояний, анамнез предыдущих беременностей, безопасность лекарственных средств для плода и их эффективность для матери и др. На основании достаточно скудной доказательной базы, обусловленной тем, что рандомизированные клинические исследования у беременных по этическим соображениям не проводятся, в российских и европейских рекомендациях спектр антигипертензивных препаратов для этой категории пациенток ограничен тремя группами: препаратами центрального действия (метилдопа), антагонистами кальция (нифедипин с медленным высвобождением активного вещества, верапамил), высокоселективными бета-адреноблокаторами (метопролола сукцинат, бисопролол) и бета-адреноблокатором с альфа-блокирующими свойствами (лабеталол) [4]. К сожалению, на практике не всегда соблюдается принцип безопасности лекарственного средства, что в ряде случаев приводит не только к нежелательному его воздействию на течение беременности, но и может способствовать неблагоприятным перинатальным исходам и осложнениям со стороны плода и новорожденного.
Целью настоящего исследования стал анализ характера АГТ у беременных с гипертензивными нарушениями, оценка течения беременности, состояния плода и новорожденного в реальной клинической практике по данным регистра беременных БЕРЕГ.
МАТЕРИАЛ И МЕТОДЫ
Работа выполнена на основании данных, полученных в наблюдательном (обсервационном) исследовании «Оценка клинического состояния беременных с кардиоваскулярными заболеваниями в течение гестации, в родах, раннем послеродовом периодах и через 12 месяцев после родов, а также анализ перинатальных исходов, состояния плода, новорожденного и качества лечения этих пациенток с помощью регистра БЕРЕменных – реГистр БЕРЕГ», которое было проведено на базе ГУЗ «Тульский областной перинатальный центр». Регистр БЕРЕГ имел все разрешительные документы Московского комитета по этике и Министерства здравоохранения Тульской области. Обязательным условием включения пациенток в исследование было получение письменного информированного согласия; протокол исследования предусматривал сквозное включение беременных, постоянно проживающих в Туле или Тульской области и поступивших в «Тульский областной перинатальный центр» в течение 2014 г.
На первом этапе исследования все данные брались из амбулаторных и стационарных карт пациенток и включали жалобы, анамнез, в том числе акушерский, информацию о перенесенных заболеваниях, в том числе существующих на настоящий момент, факторы риска сердечно-сосудистых заболеваний (ССЗ), наследственную отягощенность по ССЗ, антропометрические показатели (рост, масса тела на момент вступления в беременность, прибавка массы тела за период беременности), уровень АД и частоту сердечных сокращений (ЧСС), результаты лабораторных анализов и инструментальных методов обследования, а также данные о медикаментозном и оперативном лечении.
Согласно протоколу регистра БЕРЕГ, оценивались следующие «жесткие конечные точки»: материнская смертность, гибель плода и новорожденного: антенатальная (в сроки беременности 28 и более недель); интранатальная (в родах); неонатальная (с 1 до 4 нед жизни); постнатальная (от 28 дней по 11 мес 29 дней 23 ч 59 мин жизни). Заключения о гибели плода/новорожденного взяты из медицинской документации – истории родов, причины гибели плода/новорожденного сделаны на основании протоколов патологоанатомического вскрытия.
«Суррогатными конечными точками» исследования явилось развитие эклампсии; сердечной недостаточности; угрожающих жизни аритмий; тромбоэмболических состояний; преждевременных родов; кровотечений в родах; недоношенности различной степени – I (вес новорожденного 2000–2500 г), II (1500–2000 г), III (1000–1500 г), IV (<1000 г) степени.
Статистическая обработка полученных данных проводилась с использованием пакета программ STATISTICA 10.0 (StatSoft, США). Качественные показатели представлены в виде частот и процентов, количественные – в виде медианы с указанием квартильного размаха в скобках [25-й и 75-й процентили]. Сравнение двух групп по количественному признаку проводилось с помощью U-критерия Манна–Уитни. При сравнении групп по качественному показателю использовалось построение таблиц сопряженности с последующим расчетом критерия согласия Пирсона (χ2). При сравнении данных рассчитывались отношение шансов (ОШ) и 95% доверительный интервал (ДИ).
РЕЗУЛЬТАТЫ
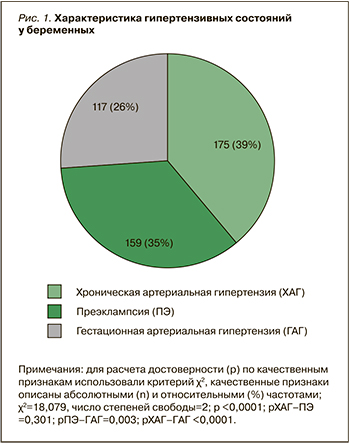 В соответствии с критериями включения/невключения, в регистр БЕРЕГ вошли 3214 беременных в возрасте 28 [25; 33] лет. Среди них у 451 женщины (14,0%) имели место различные клинические варианты АГ: преэклампсия (ПЭ) и ХАГ встречались с одинаковой частотой и достоверно чаще, чем гестационная АГ (ГАГ), случаев эклампсии не было зарегистрировано (рис. 1).
В соответствии с критериями включения/невключения, в регистр БЕРЕГ вошли 3214 беременных в возрасте 28 [25; 33] лет. Среди них у 451 женщины (14,0%) имели место различные клинические варианты АГ: преэклампсия (ПЭ) и ХАГ встречались с одинаковой частотой и достоверно чаще, чем гестационная АГ (ГАГ), случаев эклампсии не было зарегистрировано (рис. 1).
Из 451 пациентки с АГ 279 (62%) женщин в течение всего периода гестации принимали антигипертензивные препараты (1 группа). 172 (38%) женщины по разным причинам постоянно не получали таких препаратов; им лишь периодически вводили внутримышечно спазмолитики (папаверин), дибазол или сернокислую магнезию, что явилось основанием считать их как пациенток с АГ без АГТ (2 группа).
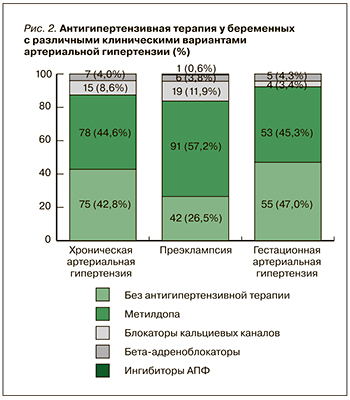
Среди антигипертензивных препаратов при всех клинических вариантах АГ пациентки чаще всего принимали метилдопу в средней суточной дозе 750–1500 мг. При неэффективности метилдопы их переводили на высокоселективный бета-адреноблокатор бисопролол (Конкор, «Мерк») в дозе 5–7,5 мг/сут или нифедипин с медленным высвобождением (Нифекард XL, «Сандоз») в дозе 30 мг/сут с достижением уровня АД менее 140/90 мм рт.ст. Особо следует отметить, что одна пациентка с ПЭ принимала эналаприл в дозе 10 мг/сут, который вследствие подтвержденного тератогенного эффекта запрещен у беременных (рис. 2).
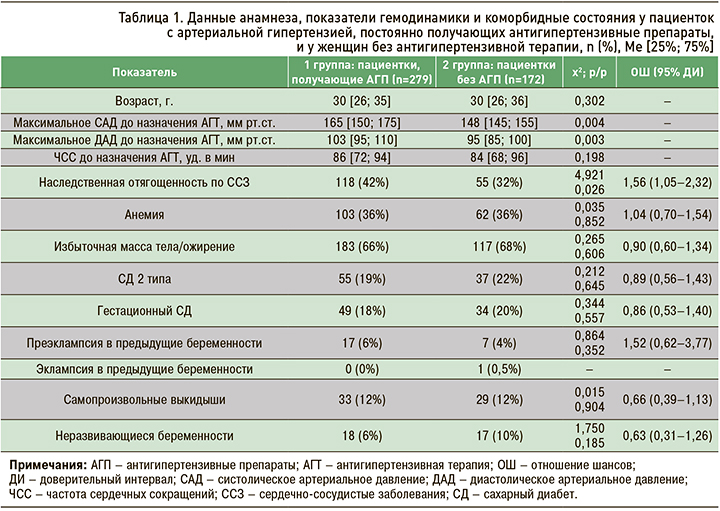
 Как видно из представленных в таблице 1 данных, женщины обеих групп исследования были сопоставимы по возрасту, статусу курения, наличию коморбидных состояний и отягощенному акушерскому анамнезу. Различием стала большая частота наследственной отягощенности по ССЗ у родственников первой линии и высокие показатели систолического (САД) и диастолического АД (ДАД) в группе беременных, получавших антигипертензивные препараты, что свидетельствует, на наш взгляд, о значительной приверженности этих пациенток к лечению.
Как видно из представленных в таблице 1 данных, женщины обеих групп исследования были сопоставимы по возрасту, статусу курения, наличию коморбидных состояний и отягощенному акушерскому анамнезу. Различием стала большая частота наследственной отягощенности по ССЗ у родственников первой линии и высокие показатели систолического (САД) и диастолического АД (ДАД) в группе беременных, получавших антигипертензивные препараты, что свидетельствует, на наш взгляд, о значительной приверженности этих пациенток к лечению.
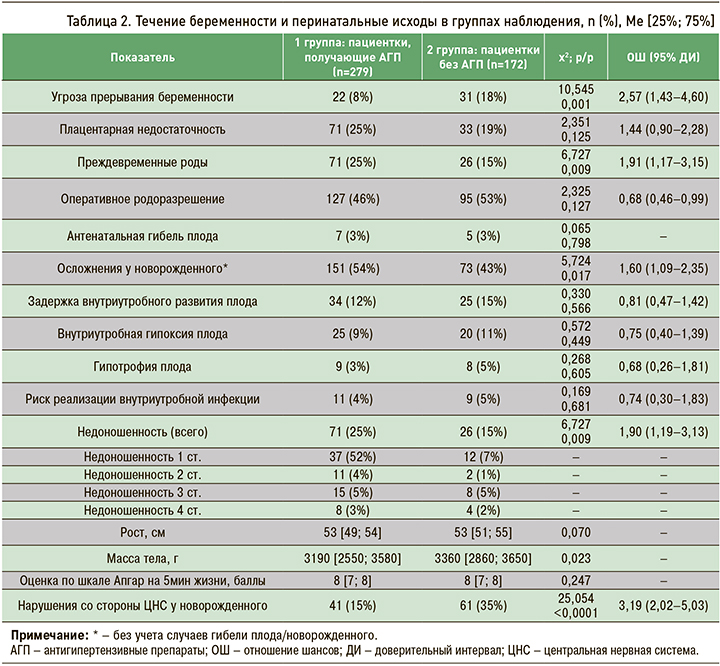
Анализ течения беременности и перинатальных исходов в группах наблюдения показал, что плацентарную недостаточность диагностировали одинаково часто у 1/4 женщин обеих групп, но угроза прерывания беременности осложняла течение гестации у беременных 2 группы в 2,3 раза чаще, чем у пациенток с АГ, получающих АГТ. Вместе с тем преждевременные роды и осложнения у новорожденного, так же как и более низкая масса тела новорожденного, у женщин 1 группы встречались достоверно чаще, чем во 2 группе. Почти половина пациенток с АГ, независимо от приема АГП, была родоразрешена оперативным путем, но частота рождения недоношенных детей у пациенток 1 группы была статистически значимо выше, чем во 2 группе. Это, на наш взгляд, может указывать на более тяжелое течение АГ и подчеркивает обоснованность и необходимость постоянного приема антигипертензивных препаратов у этих пациенток (табл. 2).
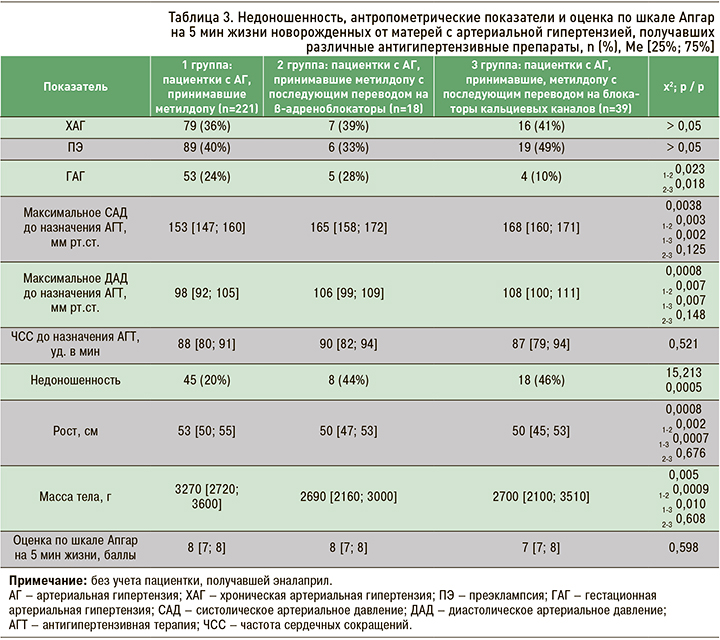
Трудно связать развитие осложнений гестационного периода и неблагоприятных перинатальных исходов с характером АГТ, поскольку всем пациенткам с АГ терапию начинали с метилдопы, и в последующем при ее неэффективности их переводили на бета-адреноблокаторы либо на блокаторы кальциевых каналов. Как видно из данных, представленных в таблице 3, у большинства женщин примерно в равном проценте случаев имела место ХАГ и ПЭ и значительно реже ГАГ. Случаи недоношенности у женщин 1 группы имели место в 2 раза реже, чем во 2 и 3 группах, в которых более 40% женщин были родоразрешены преждевременно; антропометрические параметры новорожденных закономерно в этих группах были достоверно ниже.
Следует отметить, что у 10 новорожденных были диагностированы различные врожденные пороки развития (ВПР). Представлял интерес анализ возможной взаимосвязи ВПР с характером АГТ или другими факторами, которые могли бы оказать влияние на развитие таких осложнений. В таблице 4 представлены клинико-демографические показатели рожениц, характер ВПР и антропометрические показатели новорожденных у этих пациенток.

Безусловно, трудно напрямую связать случаи рождения детей с ВПР с приемом какого-либо антигипертензивного препарата, поскольку в целом число наблюдений в данном исследовании, с одной стороны, было незначительным, а с другой ‒ только половина пациенток получала АГТ. Вместе с тем у пациентки с ПЭ, принимавшей эналаприл (категория Х по FDA), у ребенка был диагностирован множественный ВПР – врожденный порок сердца (ВПС): открытый аортальный проток (ОАП), открытое овальное окно (ООО), множественные диспластические черты. Во всех случаях рождения детей с ВПР обращает на себя внимание тот факт, что у соответствующих пациенток были экстрагенитальные заболевания: ожирение, у значительного числа гестационный СД, реже хронические заболевания желудочно-кишечного тракта и мочеполовой системы, носительство цитомегаловируса, вируса папилломы человека, уреаплазмоз и микоплазмоз.
ОБСУЖДЕНИЕ
В настоящее время в медицине широкое распространение получили регистры, в которых в соответствии с поставленной целью и задачами возможно получение объективной информации в гетерогенной группе, что позволяет сделать важные практические выводы, наметить пути реализации мер по совершенствованию системы профилактики и лечения ряда социально значимых заболеваний [5]. Так, по данным проводимого нами обсервационного наблюдательного исследования – регистр БЕРЕГ, беременность у 175 (5,4%) женщин протекала на фоне ХАГ, у 159 (4,9%) она осложнилась ПЭ, у 117 (3,6%) – ГАГ [6]. Эти данные сопоставимы с результатами рандомизированных контролируемых исследований, в которых показано, что 3–5% всех беременностей протекают на фоне ХАГ, и столько же осложняются ПЭ [2, 7, 8].
Известно, что гипертензивные нарушения у беременных способны приводить не только к развитию тяжелых осложнений со стороны матери и плода, но и в будущем могут стать у этих женщин весомыми факторами риска раннего развития сердечно-сосудистых заболеваний [9, 10] и хронической болезни почек [11]. Особенно возрастает риск при сочетании АГ с метаболическими нарушениями, частота которых в нашем исследовании была высокой: ожирение встречалось почти у 70% пациентов, нарушение углеводного обмена – у 40%. АГ и ожирение связаны множеством патогенетических механизмов, поскольку жировая ткань, обладая высокой метаболической активностью и осуществляя синтез и секрецию биологически активных веществ, которые участвуют в углеводном (адипонектин, резистин, висфатин, оментин) и жировом обмене (белок – переносчик холестериновых эстераз, перилипин, ретинолсвязывающий белок, аполипопротеин Е), пищевом поведении (лептин), процессах воспаления (фактор некроза опухоли α, интерлейкины-6, -8, -10, -12, С-реактивный белок, адипсин, апелин, резистин), свертывания крови (ингибитор активатора плазминогена-1, тканевый фактор), играет активную роль в регуляции АД за счет усиления синтеза ангиотензина II, ангиотензиногена и апелина [12]. Во время беременности воздействие этих физиологических механизмов регуляции метаболических процессов и сосудистого тонуса может усиливаться под влиянием гипертензивных нарушений и увеличивать частоту осложнений гестационного периода и неблагоприятных перинатальных исходов. Так, данные недавно опубликованного метаанализа продемонстрировали, что риск ПЭ возрастает экспоненциально по отношению к числу различных факторов риска. ПЭ в анамнезе (n=138) увеличивает риск ПЭ при данной беременности в 8,1 раза (95% ДИ 5,7–11,2) по сравнению с общей популяцией беременных. Недоношенность (n=57) в предыдущей беременности повышает риск ранней ПЭ в 17,5 раза (95% ДИ 2,1–60,5). Кластер этих двух факторов риска вместе (n=21) увеличивает риск тяжелой ПЭ до 23,8 раза (95% ДИ 5,1–60,6) и ранней ПЭ (роды до 37+0 нед беременности) – до 16,4 раза (95% ДИ 2,0–52,4). Ожирение (n=228) в качестве единственного фактора повышает риск ПЭ в 2,1 раза (95% ДИ 1,1–3,6), при сочетании с ХАГ и гестационным СД эта вероятность возрастает до 4,8 раза (95% ДИ 0,1–21,7), при сочетании с ХАГ, гестационным СД и ПЭ в анамнезе – до 11,4 раз (95% ДИ 4,5–20,9). Вместе с тем ХАГ (n=60) увеличивает риск ПЭ в 5,3 раза (95% ДИ 2,4–9,8), тяжелой ПЭ – в 22,2 раза (95% ДИ 9,9–41,0), раннего развития ПЭ – в 16,7 раза (95% ДИ 2,0–57,6) [13].
АГ выступает весомым фактором риска не только ПЭ, но и других осложнений беременности. Частота этих осложнений зависела, как показано в нашем исследовании, от тяжести АГ, при этом АГТ, безусловно, снижала риск развития тяжелых осложнений со стороны матери, способствовала пролонгированию беременности и увеличению гестационного возраста. Существенного влияния на плод АГТ не оказывала: задержка его внутриутробного развития, гипотрофия и гипоксия, а также риск реализации внутриутробной инфекции с одинаковой частотой встречались в обеих группах, но средний вес новорожденных был достоверно ниже в 1 группе наблюдения, что, по-видимому, связано с большей частотой преждевременных родов и случаев недоношенности. Мертворождение и постнатальная гибель новорожденного не зависели от факта приема антигипертензивных препаратов, однако обращает на себя внимание то, что осложнения со стороны ЦНС у новорожденных 2 группы встречались в 2 раза чаще.
Полученные нами данные подтверждаются результатами метаанализа, в котором оценивались исходы для матери и плода у женщин с различными гипертензивными нарушениями, получающими АГТ, по сравнению с аналогичными пациентками без лечения. Исследователи пришли к выводу, что АГТ на 40–60% снижает частоту возникновения тяжелой АГ и на 40–65% – потребность в дополнительных антигипертензивных препаратов. При этом АГТ не приводит к значительному снижению смертности плода или новорожденного, прежде-временных родов, ПЭ или отслойки плаценты; на плод она не оказывает ни положительного, ни отрицательного влияния [7, 14].
Также интересны результаты другого метаанализа нескольких баз данных Medline (через OVID), Embase (через OVID) и Cochrane Trials, в котором были представлены 15 рандомизированных контролируемых исследований, включающих 1166 беременных с ХАГ. Они показали, что при лечении антигипертензивными препаратами по сравнению с плацебо было получено клинически важное снижение тяжелой АГ (5 исследований, 446 женщин; ОР 0,33; 95% ДИ 0,19–0,56). При этом не было выявлено различий в частоте развития ПЭ на фоне ХАГ (7 исследований, 727 женщин; ОР 0,74; 95% ДИ 0,49–1,11), мертворождения/неонатальной смерти (4 исследования, 667 женщин; ОР 0,37; 95% ДИ 0,11–1,26), весе новорожденного (7 исследований, 802 женщины) и доношенности (4 исследования, 369 женщин; ОР 1,01; 95% ДИ 0,53–1,94) [14].
При каком уровне АД надо назначать медикаментозную терапию и может ли она оказывать влияние на течение беременности, состояние плода и развитие фатальных осложнений со стороны матери? Эти вопросы до настоящего времени остаются до конца не решенными, но согласованное мнение экспертов, основанное на данных доказательной медицины, таково, что медикаментозную терапию назначают:
- при стойком повышении АД ≥150/95 мм рт.ст. у беременных с АГ без поражения органов-мишеней и ассоциированных клинических состояний;
- во всех остальных случаях: при ХАГ с поражением органов-мишеней и/или ассоциированными клиническими состояниями, ГАГ, ПЭ – в случае АД ≥140/90 мм рт.ст. [4].
Следует подчеркнуть, что врачи, которые вели пациенток, вошедших в регистр БЕРЕГ, придерживались этих рекомендаций, но, к сожалению, одна пациентка принимала эналаприл (категория Х по FDA). Необходимо учитывать, что практически все лекарственные средства проникают через плаценту и даже разрешенные к применению у беременных препараты могут быть потенциально опасными в плане неблагоприятного воздействия на плод. В регистре БЕРЕГ у 10 новорожденных были диагностированы различной тяжести ВПР, но четкой связи их с характером АГТ мы не выявили, что может быть связано не только с незначительным числом наблюдений, но и отсутствием такого влияния со стороны антигипертензивных препаратов.
К аналогичным выводам пришли и другие исследователи, которые оценивали риск ВПР у детей, рожденных от нормотензивных матерей, по сравнению с детьми, матери которых имели АГ. Риск ВПР был приблизительно на 80% выше у детей женщин с различными гипертензивными нарушениями (ОР 1,8; 95% ДИ 1,5‒2,2), на 100% ‒ у женщин с ХАГ (ОР 2,0; 95% ДИ 1,5‒2,7) и на 40% ‒ у нелеченых гипертоников (ОР 1,4; 95% ДИ 1,2‒1,7). Величина риска в целом была одинаковой для различных ВПР и для всего спектра антигипертензивных препаратов, однако данных по вкладу каждого из них в этот риск было недостаточно [15].
Другие исследователи также отметили, что женщины с ХАГ, как леченые, так и нелеченые, имеют повышенный, по сравнению с нормотензивными пациентками, риск ВПР у потомства, особенно врожденных пороков сердца. При этом АГП, вероятно, еще больше увеличивают этот риск, но также возможно и то, что АГ и ВПР имеют сходные факторы риска [16]. Мы разделяем мнение авторов о том, что, несмотря на неблагоприятные исходы для плода и новорожденного, зарегистрированные у женщин, получавших антигипертензивные препараты во время беременности, четкие выводы о влиянии этих средств на течение беременности и плод невозможны ввиду значительных методологических недостатков и недостаточной статистической мощности доступных исследований.
Учитывая неопределенность в этой области, клиницистам рекомендуется использовать антигипертензивные препараты строго по показаниям и выбирать те лекарственные средства, которые имеют лучший профиль безопасности [17]. Препаратом первого ряда при лечении АГ у беременных является метилдопа (категория B по FDA), которая продемонстрировала долговременную безопасность для плода, но тем не менее является слабым антигипертензивным средством, имеющим медленное начало действия (от 3 до 6 ч) и обладающим в больших дозах значительным седативным эффектом. Клинические испытания (например, CHIP) показали, что у женщин, получавших метилдопу, были лучшие перинатальные исходы по сравнению с женщинами, применявшими лабеталол, но, как при этом подчеркивают авторы, эти данные могут быть необъективными [18]. В то же время многие пациентки не достигают целевого АД при монотерапии метилдопой, и в этом случае возникает необходимость либо комбинации антигипертензивных препаратов, либо замены лекарственного средства, что было продемонстрировано в нашей работе. В европейских странах, Великобритании и США беременным с ХАГ предпочитают назначать лабеталол – бета-адреноблокатор с альфа-блокирующим эффектом. В открытом исследовании, которое проводилось в 4 британских центрах с августа 2014 г. по октябрь 2015 г., при наблюдении за 112 женщинами с ХАГ (98% из них завершили исследование), получавшими лабеталол 200–1800 мг/сут (n=55) либо модифицированный нифедипин 20–80 мг/сут (n=57), с I триместра беременности в обеих группах были получены схожие результаты [19].
Высокоселективные бета-адерноблокаторы, которые по классификации FDA относятся к категории С, назначают в рамках монотерапии или в комбинации с другим антигипертензивным препаратом либо при неэффективности метилдопы, либо при ее непереносимости (желательно со II триместра беременности). Это дополнительно подчеркивается теми немногочисленными исследованиями, в которых получены сведения (правда, неопределенные) о возможном риске ВПР у детей, чьи матери принимали бета-адреноблокаторы с I триместра беременности. Так, в систематическом обзоре 13 популяционных исследований «случай–контроль» или когортных исследованиях, посвященных оценке риска ВПР, связанных с воздействием перорального бета-адерноблокатора в I триместре, по сравнению с отсутствием его воздействия, не было общего увеличения основных ВПР (ОШ 0,90; 95% ДИ 0,91–1,10). При этом однако наблюдались ассоциации применения бета-адреноблокатора с некоторыми органо-специфическими пороками развития: сердечно-сосудистыми дефектами (ОШ 2,01; 95% ДИ 1,18–3,42; 4 исследования), расщелиной губы/нёба (ОШ 3,11; 95% ДИ 1,79–5,43; 2 исследования) и дефектами нервной трубки (ОШ 3,56; 95% ДИ 1,19–10,67; 2 исследования) [20]. Эти данные сопоставимы с результатами другого систематического обзора, опубликованного в 2015 г., в котором сообщалось о связи независимо от статуса лечения и повышенном риске ВПР у женщин, получавших бета-адреноблокаторы, по сравнению с нелечеными женщинами с ХАГ (ОР 2,1; 95% ДИ 1,6–2,7) [15].
На наш взгляд, резюмирующие выводы были сделаны на основании результатов Национального исследования по профилактике врожденных дефектов (NBDPS), проведенного повторно на дополнительных данных NBDPS в период с 2004 по 2011 г. После исключения женщин, у которых отсутствовала информация об АГ, гестационном СД, СД, многократных родах или применении гипотензивных средств без повышения АД, были сопоставлены данные 10 625 случаев ВПР и 11 137 контроля (матери с АГ без ВПР плода). Были рассчитаны скорректированные ОШ [95% ДИ] для оценки риска конкретных ВПР, связанных с использованием антигипертензивных препаратов в течение месяца, предшествующего зачатию, до 3 мес беременности с учетом возраста матери, расы/этнической принадлежности, индекса массы тела и факта курения в I триместре. Исследователи наблюдали повышенный риск возникновения четырех вариантов ВПР независимо от класса АГП: коарктации аорты (ОШ 2,50; ДИ 1,52–4,11), стеноза устья легочной артерии (ОШ 2,19; ДИ 1,44–3,34), перимембранозного дефекта межжелудочковой перегородки (ОШ 1,90; ДИ 1,09–3,31) и дефекта межпредсердной перегородки (ОШ 1,94; ДИ 1,36–2,79). Ассоциации для этих ВПР были статистически значимыми у матерей, которые сообщили об использовании бета-адреноблокаторов или блокаторов РААС; оценки для других классов АГП, как правило, основывались на меньшем числе выявленных случаев и были менее стабильными, но оставались повышенными. Авторы считают, что результаты подтверждают и расширяют ранее полученные данные NBDPS о том, что применение антигипертензивных препаратов может быть связано с повышенным риском развития определенных ВПР, хотя и полностью не исключают возможной связи этих ВПР с наличием АГ у матери [21].
Недавно завершилось крупное американское исследование, включившее 3577 женщин с АГ в северной когорте и 14 900 женщин в США, из которых 682 (19,1%) и 1668 (11,2%) соответственно принимали бета-адреноблокаторы с I триместра беременности. В нем оценивались любые серьезные ВПР: врожденные пороки сердца, расщелины губы или нёба, пороки развития ЦНС. Совокупный скорректированный относительный риск (ОР) и разница риска на 1000 человек у женщин, принимающих бета-адреноблокаторы (RD1000), составили соответственно 1,07 (95% ДИ 0,89–1,30) и 3,0 (ДИ от -6,6 до 12,6) для любого ВПР; 1,12 (ДИ от 0,83 до 1,51) и 2,1 (ДИ от -4,3 до 8,4) – для любого врожденного порока сердца; 1,97 (ДИ от 0,74 до 5,25) и 1,0 (ДИ от -0,9 до 3,0) – для расщелины губы или нёба. Для пороков развития ЦНС скорректированный ОР был равен 1,37 (ДИ от 0,58 до 3,25), а RD1000 была 1,0 (ДИ от -2,0 до 4,0) (основываясь только на данных когорты США). Выводы исследования: использование бета-адреноблокаторов в I триместре беременности не связано с большим увеличением риска общих ВПР или врожденных пороков сердца [22]. Безусловно, наши немногочисленные наблюдения, а именно 10 случаев тяжелых ВПР у женщин с гипертензивными нарушениями, не позволяют сделать вывод о возможном влиянии антигипертензивных препаратов на факт рождения таких детей. Однако нельзя не отметить, что все женщины имели коморбидную патологию, в первую очередь ожирение и нарушения углеводного обмена. Возможно, как считают и другие исследователи [23], эти состояния могут являться дополнительными и, может быть, даже определяющими факторами риска ВПР у их детей.
ЗАКЛЮЧЕНИЕ
Таким образом, в реальной российской клинической практике частота гипертензивных нарушений у беременных достаточно высокая, но не отличается от данных других европейских стран. Почти в 70% случаев у этих пациенток имеет место ожирение, в 40% – СД 2 типа и ГСД, в 36% – анемия, что, несомненно, утяжеляет состояние женщин, способствует развитию осложнений со стороны плода и новорожденного и неблагоприятным перинатальным исходам. Лечение АГ, по данным регистра БЕРЕГ, соответствовало современным требованиям, что привело к пролонгированию беременности до сроков, близких к физиологическому. Анализ вероятности влияния антигипертензивных препаратов на рождение детей с ВПР не выявил такой связи, однако наличие АГ и у большинства этих пациенток сопутствующей коморбидной патологии (прежде всего метаболических нарушений) требует дальнейших исследований в этом направлении.


